聚酰胺和聚甲基丙烯酸甲酯微塑料对异菌脲土壤环境行为的影响
2021-10-27赵雪君刘士领王鸣华
赵雪君, 李 达, 刘士领, 王鸣华
(南京农业大学 植物保护学院,南京 210095)
近年来,塑料行业快速发展,塑料制品种类繁多,其主要类型包括聚乙烯 (PE)、聚丙烯 (PP)、聚苯乙烯 (PS)、聚氯乙烯 (PVC)、聚酰胺 (PA)、聚甲基丙烯酸甲酯 (PMMA) 和低密度聚乙烯(LDPE) 等传统塑料以及聚丁二酸丁二醇酯 (PBS)、聚乳酸 (PLA) 等新型可降解塑料。因其性能优异、价格低廉,现被广泛应用到人们生产生活的方方面面,如农用地膜、一次性塑料餐具、管道或门窗等。虽然塑料制品大大便利了人们的生活,但是塑料垃圾也对环境造成了一定的污染。据报道,2017年全球塑料产量已高达3.48 亿吨[1],预计到2050 年,向环境中排放的塑料将达到120亿吨[2]。暴露于环境中的塑料经物理、化学及生物降解作用,会形成尺寸更小的塑料颗粒或碎屑。目前,学术界通常认为粒径小于5 mm 的塑料颗粒为微塑料 (microplastics)[3-4]。微塑料污染是全球普遍性的环境问题,但近年来对微塑料污染的研究主要集中在水生环境中,而对陆地环境微塑料污染问题的关注较少。已有研究表明,土壤亦是重要的微塑料储存库之一,土壤中的微塑料污染也应引起重视[5-8]。例如,浙江桑沟湾楮岛和上海农田中微塑料丰度分别为17.1 和10.3 个/kg[9-10],山东滨海潮滩土壤和杭州湾沿岸平原农田土壤中微塑料丰度分别为634 和263~571 个/kg[11-12],而陕西农田土壤及武汉郊区蔬菜地土壤中微塑料丰度最高可达3 140 和12 560 个/kg[13-14]。
农药施用后大部分散落于土壤中,在土壤中发生扩散、迁移和降解等行为。近年来,有研究发现微塑料可以影响农药的环境行为。如Wang等研究表明,PE 对氟环唑、戊唑醇、腈菌唑、嘧菌酯、西玛津、特丁津、莠去津和精异丙甲草胺8 种农药的水解具有抑制作用,抑制率为36.84%~192.14%,此外还发现高浓度的微塑料可以减少农药在水-沉积物中的残留量,但会延长其在环境中的半衰期,增加农药在环境中的持久性与危害[15]。Fang 等研究了PS 对己唑醇、腈菌唑和三唑醇的吸附行为,发现PS 对3 种杀菌剂的吸附容量大小顺序为己唑醇>腈菌唑>三唑醇,且当PS 粒径为10 μm 时,对3 种杀菌剂的吸附容量最大,粒径为100 μm 时吸附容量最小[16]。Wang 等研究发现,室内模拟条件下,PE 可吸附多菌灵、敌百虫、除虫脲、马拉硫磷和苯醚甲环唑,吸附容量大小顺序为:除虫脲>苯醚甲环唑>马拉硫磷>多菌灵>敌百虫[17]。
异菌脲 (iprodione) 是二甲酰亚胺类保护性杀菌剂的代表品种[18],据中国农药信息网统计,目前我国登记的含有异菌脲成分的产品占二甲酰亚胺类杀菌剂登记数量的58%,广泛用于防治葡萄、番茄、油菜和马铃薯等作物上由灰葡萄孢属、核盘菌属、丛梗孢属、小菌核菌属等引起的多种病害,对病原菌生活史中的各发育阶段均有抑制作用[19-20]。但异菌脲对非靶标生物的毒性较高,如对虹鳟鱼为中毒,急性毒性LD50(96 h) 值为4.1 mg/L;对羊角月牙藻中毒,急性毒性EC50(72 h) 值为1.9 mg/L;对蜜蜂高毒,接触毒性LD50(48 h) > 0.4 mg/bee[21]。此外,异菌脲对斑马鱼具有发育毒性、肝毒性和心脏毒性,还会改变小鼠微粒体酶活性,导致小鼠肝细胞增殖和肝肿大[22],并导致雄性大鼠的生殖畸形、延缓其青春期的发育[23]。目前关于异菌脲的研究主要集中在检测、活性、毒性以及环境行为等方面,如程冰峰发现异菌脲在东北黑土、青海草甸土、南京黄棕壤和江西红壤土中为易降解农药,但不易移动,难淋溶[24]。研究表明,土壤中的微塑料可以吸附农药等有机污染物,抑制其在土壤中的移动和降解,从而加重对生态环境的负面效应。然而关于微塑料对异菌脲在土壤中环境行为的影响尚不明确。因此,本文在室内模拟条件下研究了PA 和PMMA 微塑料对异菌脲在土壤中吸附、迁移、淋溶和降解的影响,以期明确微塑料对异菌脲乃至二甲酰亚胺类农药环境行为影响的共同规律,并为微塑料对其他农药环境行为的影响规律研究提供借鉴,从而为微塑料污染防控、农药合理应用提供理论依据。
1 材料和方法
1.1 药剂及仪器
异菌脲 (iprodione) 标准品 (质量分数99.5%,上海安谱实验科技股份有限公司);PA 微塑料和PMMA 微塑料 (0.075 mm,东莞市樟木头华创塑胶原料商行)。乙腈 (色谱纯);乙腈 (分析纯);丙酮 (分析纯);无水硫酸镁、无水硫酸钠、氯化钙和氯化钠 (分析纯)。pH 4~7 缓冲溶液按照GB/T 31270.2—2014 配制[25]。
Agilent 1260 高效液相色谱仪 (配有UV 检测器,美国Agilent 科技有限公司);HWS 智能恒温培养箱 (宁波江南仪器厂);R-3 旋转蒸发器 (瑞士Buchi 公司);JN25-12D 超声波清洗机 (宁波江南仪器厂);TDL-40B 台式离心机 (上海安亭仪器有限公司);涡旋混合仪[桂宁 (上海) 实验器材有限公司];BT50-1J 蠕动泵 (保定兰格恒流泵有限公司)。
1.2 供试土壤
供试土壤为南京黄棕壤,采自江苏省农业科学院试验基地。取0~20 cm 的表层土壤,除去动植物残体、石块等杂质,风干、磨碎后过筛 (土壤降解和迁移淋溶试验土壤过0.85 mm 筛、土壤吸附试验土壤过0.25 mm 筛),避光保存于4 ℃冰箱。测定土壤pH 值、有机质含量和阳离子交换量,其理化性质如表1 所示。使用前将土壤取出恢复至室温,并加水至饱和持水量的40%,于人工气候箱中恒温 (25 ℃)、恒湿 (相对湿度75%)避光培养14 d 备用。吸附试验的土壤使用前需在120 ℃条件下湿热灭菌30 min。

表1 供试土壤的理化性质Table 1 The physico chemical properties of the tested soil
1.2.1 含微塑料土壤的制备 在预试验中,分别在土壤中添加质量分数为0.5%、1%和2%的微塑料。结果表明,添加2%的PA 和PMMA 分别使土壤的吸附性增强了8.6%和24.7%,其他2 个添加水平和对照处理相比差异不显著。因此,选取2%的微塑料添加量进行土壤吸附试验。称取土壤于白瓷盘中,分别加入质量分数为2%的微塑料PA 和PMMA,搅拌均匀备用。以不含微塑料的土壤作为对照。
1.2.2 含药土壤的制备 称取100 g 1.2.1 节中制备的含不同类型微塑料的土壤于烧杯中,添加2.5 mL 1 000 mg/L 的异菌脲丙酮溶液,待丙酮挥发完全后将土壤混合均匀。再向其中加入400 g空白土壤,充分混匀,得到异菌脲添加水平为5 mg/kg 的含药土壤。
1.3 试验方法
1.3.1 土壤吸附 选取PA 和PMMA 为供试微塑料,通过预试验发现,土壤对PA 和PMMA 的饱和吸附率分别为25.67%和42.7%。异菌脲在对照土壤中不同水土比[V(水) :m(土壤),mL/g]条件下的吸附结果表明,当水土比分别为5 : 1、10 : 1、20 : 1 和50 : 1 时,土壤对异菌脲的吸附率分别为67.4%、63.7%、58.3%和38.3%。由于异菌脲在水中的溶解度较小,并考虑到加入微塑料后土壤对异菌脲的吸附率会提高,因此在正式试验中选择水土比为50 : 1 进行土壤吸附试验。
1.3.1.1 吸附动力学试验 分别称取2.0 g 含2%PA 的土壤、含2% PMMA 的土壤和空白对照土壤于250 mL 锥形瓶中,加入100 mL 含异菌脲质量浓度为5 mg/L 的0.01 mol/L 氯化钙水溶液,盖上橡胶塞。将锥形瓶置于恒温振荡器中,在25 ℃、180 r/min 条件下振荡平衡,分别于0、0.5、2、4、6、8、12 和24 h 取样,通过高效液相色谱 (HPLC)测定异菌脲的含量。同时设置加入含5 mg/L 异菌脲的氯化钙水溶液的土壤为对照。每处理设3 个平行。
1.3.1.2 等温吸附试验 分别称取2 g 含2% PA 的土壤、含2% PMMA 的土壤和空白对照土壤于250 mL 锥形瓶中,分别加入100 mL 含不同质量浓度 (0.2、0.5、1.0、2.0 和5.0 mg/L) 异菌脲的氯化钙水溶液,盖上橡胶塞。将锥形瓶置于25 ℃、180 r/min 的恒温振荡器中,振荡平衡24 h。离心后取上清液,过0.22 μm 滤膜,HPLC 测定异菌脲的含量。同时以加入5 个质量浓度异菌脲的氯化钙水溶液的土壤为对照。每处理设3 个平行。
1.3.1.3 pH 值对吸附的影响 异菌脲在碱性条件下易水解[14],为减少异菌脲水解对吸附试验的干扰,吸附试验在pH 值为4、5、6 和7 的缓冲液中进行。分别称取2 g 含2% PA 的土壤、含2%PMMA 的土壤和空白对照土壤于250 mL 锥形瓶中,加入100 mL pH 值分别为4、5、6 和7 的含5 mg/L 的异菌脲水溶液,盖上橡胶塞。在恒温振荡器中 (25 ℃、180 r/min) 振荡平衡24 h,离心,取上清液过0.22 μm 滤膜,测定不同pH 缓冲液中异菌脲的含量。同时设未加土壤的异菌脲水溶液为对照。每处理设3 个平行。
1.3.2 异菌脲在土壤中的降解 参照《化学农药环境安全评价试验准则》进行[25]。分别称取5.0 g含2% PA 的含药土壤、含2% PMMA 的含药土壤和空白对照含药土壤于 50 mL 离心管中,加入1.2 mL超纯水,调节土壤含水量为24%。旋转振摇使水分在土壤中均匀分布,称重。使用透气硅胶塞塞紧瓶口,置于25 ℃恒温培养箱内黑暗培养,每48 h 称重并及时补充水分。设置9 个取样时间点(0、3、7、14、21、28、35、49 和63 d),定时取样后,检测土壤样品中异菌脲的含量。每处理设3 个平行。
1.3.3 异菌脲在土壤中的迁移、淋溶
1.3.3.1 土壤薄层层析法 分别称取30.0 g 1.2.1 节制备的3 种供试土壤于烧杯中,加入24 mL超纯水,搅拌直至土壤呈均匀的泥浆状。将泥浆涂布于7 cm × 20 cm 的层析玻璃板上,控制土层厚度约1.0 mm,振荡使泥浆表面水平且均匀分布,在室内阴凉处避光阴干。在距层析板底部1.5 cm处均匀点滴20 μL 500 mg/L 的异菌脲丙酮溶液,待丙酮挥发后,将层析板置于层析槽内,用水作展开剂。待展开剂到达薄板前沿2 cm 处时,取出层析板并在室温下避光晾干。将层析板上土壤等距离分为6 段,分别测定每段土壤中异菌脲的含量,并计算比移值 (Rf) 值。每处理设3 个平行。
1.3.3.2 土柱淋溶法 将直径5 cm、柱长35 cm的PVC 管底部用纱布封紧后,分别加入500 g 过0.85 mm 筛的3 种供试土壤,制成约30 cm 高的土柱。在土柱中缓慢、均匀地加入118 mL、 0.01 mol/L 的氯化钙水溶液,放置过夜,保证水分均匀地渗透于整个土柱。在土柱表层覆盖约1 cm 厚的石英砂,在其表面均匀滴加5 mL、 100 mg/L 的异菌脲丙酮溶液,用300 mL 氯化钙水溶液以0.5 mL/min 的速率淋洗土柱,收集淋出液。淋洗完毕后,将土柱等距离分为3 段,采用HPLC 测定各段土柱及淋出液中异菌脲的含量。每处理设3 个平行。
1.4 分析方法
1.4.1 样品前处理
1.4.1.1 土壤样品 称取5 g 土壤样品于50 mL离心管中,加入5 mL 超纯水和30 mL 乙腈,于2 000 r/min 涡旋10 min,超声20 min。再加入3 g 氯化钠和3 g 无水硫酸镁,涡旋5 min,于4 000 r/min 离心5 min。取15 mL 上清液过无水硫酸钠于平底烧瓶中,旋转蒸发至近干,加2 mL 乙腈溶解,待HPLC 检测。
1.4.1.2 水样 取1 mL 水样,过0.22 μm 滤膜,HPLC 检测。
1.4.2 添加回收试验 在空白水样、空白土壤、含2% PA 的土壤和含2% PMMA 的土壤样品中分别添加 0.05、0.2 和5.0 mg/kg 的异菌脲标准溶液,每个水平重复5 次,测定回收率及相对标准偏差 (RSD)。
1.4.3 液相色谱检测条件 Eclipse XDB-C18 色谱柱 (150 mm × 4.6 mm, 4.0 μm);流动相为V(乙腈) :V(水) = 60 : 40 ;流速1.0 mL/min;柱温30 ℃;进样量20 μL;检测波长208 nm。
准确称取0.010 1 g 异菌脲标准品于10 mL 容量瓶中,以乙腈溶解并定容,配成1 005 mg/L 的异菌脲标准母液,再用流动相梯度稀释,配制成0.05、0.1、1.0、5.0 和10.0 mg/L 的异菌脲标准工作溶液。在上述仪器条件下检测,以异菌脲的质量浓度为横坐标 (x),峰面积为纵坐标 (y) 绘制标准曲线。
1.5 数据处理
1.5.1 土壤吸附 异菌脲在土壤中的吸附率和吸附浓度可按照公式 (1) 和 (2) 计算。
式中:A为异菌脲在土壤中的吸附率;M为初始溶液中异菌脲质量,mg;Ce为经土壤吸附平衡时水相中异菌脲的质量浓度,mg/L;V0为水溶液体积,mL;x为吸附于土壤中的异菌脲质量,mg。
式中:C0为土壤样品中异菌脲的初始含量,mg/kg;Ct为t时刻土壤样品中异菌脲的含量,mg/kg;k为降解速率常数,1/d;t为反应时间,d;t1/2为降解半衰期,d。
1.5.3 土壤中的迁移、淋溶
1.5.3.1 土壤中的迁移 根据各段土壤中异菌脲含量在层析板上的分布情况,可按照公式 (6) 计算异菌脲在土壤中的比移值 (Rf)。
式中:Ri为淋出液及各段土柱中异菌脲含量占添加总量的比例,%;m0为异菌脲添加总量,mg;mi为淋出液及各段土柱中异菌脲质量,mg。其中,i= 1、2、3 和4,分别表示0~10 cm、10~20 cm、20~30 cm土壤和淋出液。
2 结果与分析
2.1 方法的准确度、精密度和检出限
以异菌脲标准溶液质量浓度为横坐标,以HPLC 的峰面积为纵坐标绘制标准曲线,回归方程为y= 152x+ 4.69,R2= 0.999 9,保留时间为6.0 min (图1)。结果表明,异菌脲在0.05~10.0 mg/L 质量浓度范围内呈良好的线性关系,峰型对称,准确性好,灵敏度高,出峰时间合理,可以满足对异菌脲的定量检测需要。
添加回收试验结果 (表2) 表明,异菌脲在空白土壤、含2% PA 的土壤和含2% PMMA 的土壤中添加水平为0.05~2.0 mg/kg时,平均回收率为78.1%~97.9%,RSD 为1.4%~8.3%。

表2 异菌脲在土壤中的平均添加回收率及相对标准偏差Table 2 The average recoveries and relative standard deviation for iprodione in soil
2.2 微塑料对异菌脲在土壤中吸附的影响
2.2.1 吸附动力学 异菌脲在3 种土壤中的吸附曲线如图2 所示。土壤对异菌脲的吸附量随着时间的延长而增加,其吸附率在0~2 h 内快速上升,之后缓慢增加,直至24 h 达到吸附平衡。土壤对农药的吸附主要包括液膜扩散和粒内扩散。初始阶段的吸附主要以液膜扩散为主,液膜扩散趋于饱和后则粒内扩散开始占主导,导致扩散阻力增加,因此吸附速率减小,最后达到吸附平衡。在吸附平衡时,对照土壤、含2% PA 的土壤、含2% PMMA 的土壤对异菌脲的吸附率分别为48.7%、57.3%和73.4%,含2% PA 和2% PMMA的土壤对异菌脲的吸附率分别是对照组土壤的1.2 倍和1.5 倍,表明微塑料可以显著提升土壤对异菌脲的吸附性能。
2.2.2 等温吸附 如表3 所示,利用Freundlich模型对异菌脲在3 种土壤中的等温吸附进行拟合,其相关系数均大于0.93,表明异菌脲在3 种土壤中的等温吸附符合Freundlich 模型,且1/n均小于1,可知异菌脲在3 种土壤中的吸附均属于非线性吸附。此外,异菌脲在对照土壤、含2%PA 的土壤和含2% PMMA 的土壤中的Kf值分别为91.67、110.18和262.32,进一步表明微塑料可以明显增加土壤对异菌脲的吸附能力,且PMMA比PA 对提升土壤吸附性能的效应更显著。
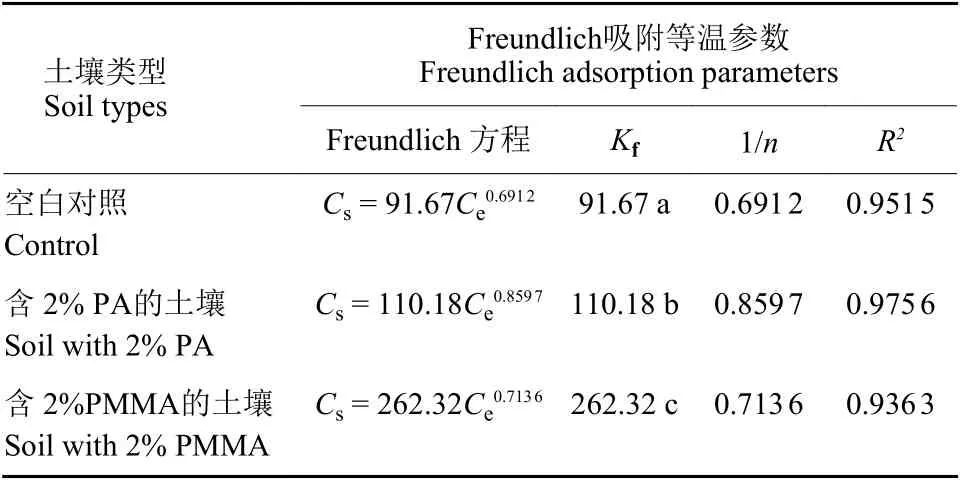
表3 异菌脲在3 种供试土壤中的等温吸附方程及其相关参数Table 3 The adsorption parameters of iprodione in three types of soil
2.2.3 pH 值对吸附行为的影响 不同pH 值下土壤对异菌脲的吸附率如图3 所示。结果表明,pH 值可显著影响3 种土壤对异菌脲的吸附。pH值为4 时,3 种土壤对异菌脲的吸附率均最小;随着pH 值的增加,吸附率均呈现出增加的趋势,pH 值为7 时吸附率均最大,此时,对照土壤、含2% PA 的土壤和含2% PMMA的土壤对异菌脲的吸附率分别为40.0%、50.9%和59.7%。
2.3 微塑料对异菌脲在土壤中降解的影响
微塑料对土壤中异菌脲降解的影响结果如图4 所示,异菌脲在3 种土壤中的降解符合一级动力学方程 (表4)。结果显示,异菌脲在对照土壤中降解最快,半衰期为19.8 d,降解速率常数为0.035 d-1;在含2% PA 的土壤中降解次之,半衰期为26.7 d,降解速率常数为0.026 d-1;在含2% PMMA 的土壤中降解最慢,半衰期为40.8 d,降解速率常数为0.017 d-1。可见PA 和PMMA 可以延缓异菌脲在土壤中的降解,结合吸附试验结果,发现微塑料对异菌脲的吸附能力越强,其对异菌脲在土壤中降解的延缓作用也就越强。

表4 异菌脲在3 种土壤中的降解动力学参数Table 4 The degradation kinetics parameters of iprodione in three types of soil
2.4 微塑料对异菌脲在土壤中移动、淋溶的影响
2.4.1 微塑料对异菌脲在土壤中移动的影响 异菌脲在3 种土壤薄层中的Rf值分别为0.12、0.097和0.091。异菌脲在对照土壤中的Rf值最大,在含2% PMMA 的土壤中的Rf值最小。异菌脲在微塑料添加土壤中的Rf值均小于对照土壤中的Rf值,同时添加微塑料的土壤的Rf值与对照土壤相比均存在显著性差异 (P<0.05)。由此推断PA和PMMA 可以抑制异菌脲在土壤中的迁移。
2.4.2 微塑料对异菌脲在土壤中淋溶的影响 结果 (图5) 表明,添加微塑料对异菌脲在土壤中淋溶的影响较大。异菌脲在对照土柱中移动性能较好,在第一、第二和第三段土柱中的分布比例分别为85.4%、10.7%和3.9%,淋出液中未检出。异菌脲在含2% PA 和含2% PMMA 的土柱中移动性较差,全部分布在0~10 cm 段,含量为100%,第二、第三段土柱以及淋出液中均未检出。
3 结论与讨论
本研究结果表明,PA 和PMMA 两种微塑料对异菌脲表现出了较强的吸附性能,土壤中添加质量分数为2%的上述两种微塑料后,土壤对异菌脲的吸附性能明显增强,Kf值分别是空白对照土壤的1.2 倍和2.9 倍,吸附率分别是空白对照土壤的1.2 倍和1.5 倍。其次,通过拟合Freundlich模型可知,异菌脲在3 种处理土壤中的吸附均属于非线性吸附。这与前人的研究结果一致。如Jiang 等发现,微塑料可以不同程度地吸附三唑酮和苯醚甲环唑,且PBS 的吸附能力显著强于传统不可降解微塑料,PBS 可使两种农药在12 h 达到吸附平衡,速率几乎是PE 和PVC 的两倍,且PBS 对两种农药的最大吸附容量是PE 和PVC 的1.3~7.4 倍;此外,他们利用扫描电镜对3 种微塑料进行表征,发现表面有褶皱的PE 和PBS 吸附能力强于表面光滑无孔的PVC[26]。Gong 等发现,不同微塑料对氟虫腈的吸附能力不同,PBS>PLA>PP>PE>PS>PVC;对微塑料表面形态的表征实验也发现了相似的结果,PE、PS、PLA 和PBS 呈不规则的碎片状,表面平整或皱缩,其层状结构提高了吸附能力和吸附容量;而PVC 和PP 则呈颗粒状,因此吸附能力较弱。其中PP 表面有大量微孔,导致PP 吸附能力大于PVC[27];Yang 等研究发现,PA 和PMMA 对Cu2+的吸附能力大于PE。PA 和PMMA 除了与PE 和PP 拥有相同的官能团 —CH2之外,表面还分别有极性官能团酰胺基(-NHCO-) 和酰氧基 (-COO-) 的存在[5];当微塑料接触液体时,表面具有极性基团的微塑料更有利于液体分子在塑料表面展开,发生润湿现象,从而更易吸附环境中的小分子[28]。从以上研究结果可知,不同微塑料的物理和化学结构差异是导致微塑料对农药吸附行为差异的主要因素。
农药在土壤中的吸附和迁移、淋溶往往表现出负相关关系,即随着吸附性能的增强,迁移及淋溶性能相应减弱。如刘娟等发现,噻虫嗪的水溶性较好,因此其吸附性能较好,但移动扩散能力较弱[29]。在本研究中,土壤中添加两种微塑料对异菌脲的吸附性能提高的同时,其迁移和淋溶性能也相应减弱。淋溶试验结果表明,异菌脲在对照土壤中淋溶性较好,3 段土柱中均有异菌脲检出,而在含微塑料的土壤中淋溶性较差,异菌脲全部分布在第一段土柱中。根据《化学农药环境安全评价试验准则》的等级划分[30],异菌脲在对照土壤中为不易移动,在含微塑料的土壤中均为不移动。表明土壤中的微塑料会增加土壤对农药的吸附性能,从而减弱农药在土壤中的移动性能。
本研究表明,异菌脲在土壤中的降解符合一级动力学方程,降解半衰期为19.8 d,属于易降解的农药,这与此前的报道一致[24]。然而,在土壤中添加PA 和PMMA 两种微塑料后,异菌脲在土壤中的降解半衰期明显延长,而且吸附效果更好的PMMA 对其降解的延缓作用强于PA,二者分别使异菌脲在土壤中的半衰期延长了3 5% 和106%,这可能是由于微塑料吸附农药后,隔离了其与微生物的接触,最终延缓了土壤中异菌脲的降解。其他研究结果也表明,环境中的微塑料会延长农药的降解半衰期。Wang 等的研究表明,PE 可以延长8 种农药的降解半衰期,而对于降解半衰期中等、logKow值较高的农药,其延缓降解的效果更明显[15]。由此可以推测,微塑料可以延缓农药在环境中的降解,增强了农药在环境中的持久性,这不仅增加了对环境生物的风险,而且药物也可能通过食物链进入人体内,对人体健康产生潜在危险。
综上,微塑料可以提高土壤对异菌脲的吸附能力,延长农药在土壤中的降解半衰期,进而抑制农药向土壤深层的迁移和淋溶,减少了农药对地下水的污染风险,但加剧了农药对表层土壤和地表水的威胁。
