革兰氏阳性与阴性细菌RNA提取方法的比较与优化
2021-10-25云飞夏婷石雅丽雷鹏
云飞 夏婷 石雅丽 雷鹏
摘要:RNA 是除DNA外的存储遗传信息的主要载体。随着分子生物学技术的发展,提取高纯度和完整性的RNA是微生物分子生物学研究的必要前提。RNA提取的本质就是破碎细胞壁,释放细胞内部的RNA,利用不同试剂去除多糖、脂类、蛋白以及DNA 等杂质,最终获得高纯度、高质量的RNA。本实验选择总RNA提取试剂盒和改良Trizol法对大肠杆菌(Escherichia coli)和枯草芽孢杆菌(Bacillus subtilis)的RNA进行提取,并对结果进行分析。
关键词:革兰氏阳性细菌;革兰氏阴性细菌;RNA提取;改良Trizol法;
引言
RNA是在蛋白质生物合成、生物进化和基因表达中起重要作用的遗传信息载体。RNA提取是分子生物学研究中的重要试验,在反转录、cDNA文库建立、蛋白质体外翻译中对RNA的要求很高[1]。RNA的提取方式多种多样,RNA的完整性和纯度都会因不同提取方式而有所不同。常用的RNA提取方法有:CTAB(十六烷基三甲基溴)法[2]、热硼酸法[3]、SDS-Phenol(十二烷基磺酸钠-苯酚)法[4],Trizol法[5]等。本实验以商品化的总RNA提取试剂盒为对照,对Trizol法进行改良,以大肠杆菌(Escherichia coli)和枯草芽孢杆菌(Bacillus subtilis)为实验材料提取RNA,目的是获得操作简单,并且可以大量提取RNA的方法。
1. 常用RNA提取方法
RNA提取的本质就是破碎细胞壁,释放细胞内部的RNA,利用不同试剂去除多糖、脂类、蛋白以及DNA 等杂质,经过一系列的相关操作,最终获得高纯度、高质量的RNA的过程。常用的RNA提取方法有:CTAB法、强变性剂法、热硼酸法、SDS-Phenol法,Trizol法等。
1.1 CTAB法
CTAB与β-巯基乙醇混合后,可使蛋白质的结构和性质发生改变,从而RNA酶的活性降低。CTAB提取法刚开始被广泛的应用到提取植物的DNA,之后为提取RNA所用,该方法可除去提取RNA过程中可能影响RNA质量的一些物质,再进行洗涤沉淀,将RNA沉淀出来,达到提取RNA的目的。这种方法提取RNA的过程简捷,提取成本不高。
1.2强变性剂法
强变性剂法的特点是在RNA提取液中存在蛋白强变性剂,这种蛋白质强变性剂能很好的降低RNA酶对RNA的影响,这种方法可以提取大量的细菌总RNA。异硫氰酸胍、盐酸胍以及饱和酚等物质是蛋白强变性剂且这些物质不仅能让RNA酶的活性降低,也可以成功地使核蛋白和核酸的结合物分解,在β-巯基乙醇和N-月桂酰肌氨钠混合之后,其作用可以让RNA酶的活力降低。
曾有科学家尝试用变性剂来溶解细菌的细胞膜 [6~7],成功的从微生物中提取到了mRNA。有研究者通过实验来比较不同成分的裂解液对RNA提取效果的影响,结果表明,添加4 mol/LGuscn做变性剂能够有效的阻碍RNA降解,同时使RNA酶的活性降低,提高所提取的RNA的质量[8]。异硫氰酸胍作强变性剂来提取RNA,提取RNA所需的时间长,不适用于大量样品的提取。
1.3 SDS-Phenol法
SDS能很好地使核蛋白與核酸结合体分解,还可以与有机溶剂苯酚等物质一起混合使用。SDS-phenol法可以在使RNA酶活性降低的同时,使蛋白质的结构和性质发生改变等。吴丽娟等[4]改良了SDS-Phenol法,这种方法提取细胞总RNA耗时少,速度快。Jahn等人通过热SDS-phenol法提取到了质量较高,纯度较高的微生物RNA,提取到的RNA用于基因表达的研究[9]。该方法所提取到的RNA纯度较高且完整性好,是一种步骤简捷、耗时少且高效提取RNA的方法。
1.4 热硼酸法
硼酸和酚类相结合构成结合物,这类结合物可以防止菌体本身所携带的酚影响到所要提取的RNA,并且这类结合物可以和RNA再结合。在某些特殊离子的作用下,可以使菌体内的糖、酚类物质分离并使其沉淀,从而达到提取RNA的目的。热硼酸盐法提取RNA的时间短,提取过程简单。
deSaizieu[10]和Selinger[11] 用热酚法提取RNA,在60℃~ 65℃的温度下,细胞的溶解速度非常快,而且RNA酶不会影响到RNA的提取。还有一种较为简便的提取RNA方法,使用温度适宜的阻断液,该溶液可以让RNA不受影响,之后用溶菌酶使细菌裂解,最后用热酚和氯仿提取RNA。使用比较多的稳定总RNA是RNA Later溶液(Ambin and Qiagen)和RNAprotectBacteria Reagent(Qiagen),这种溶液的优点是可以快速稳定mRNA 群体,使细胞在未提取RNA前,在适当的条件下mRNA存活更长时间。
2. 本实验提取RNA的方法
2.1 供试菌株
大肠杆菌(Escherichia coli)和枯草芽孢杆菌(Bacillus subtilis)。大肠杆菌属于革兰氏阴性细菌,枯草芽孢杆菌属于革兰氏阳性细菌。
2.2试剂与仪器
(1)试剂:Trizol试剂,氯仿,75%的乙醇,无RNA酶水。
(2)器材:移液枪,无核酸酶枪头,超净台,1.5ml无核酸酶离心管,离心机,水浴锅,微波炉。
2.3试验方法
2.3.1 Eastp®Super总RNA试剂盒提取微生物RNA
Eastp®Super总RNA试剂盒可以从动植物组织、培养的细胞和细菌内提取总RNA,它是通过离心柱膜来快速提取RNA。
(1)操作步骤
取1.5ml菌液(12h,37℃,200rpm培养),提取RNA操作步骤参见试剂盒说明书。提取后,加入30μl无RNA酶水。电泳检测RNA质量,1.5%琼脂糖凝胶,6μl Marker,2μl RNA,电泳电压150V,5min,凝胶成像仪拍照。
(2)实验结果
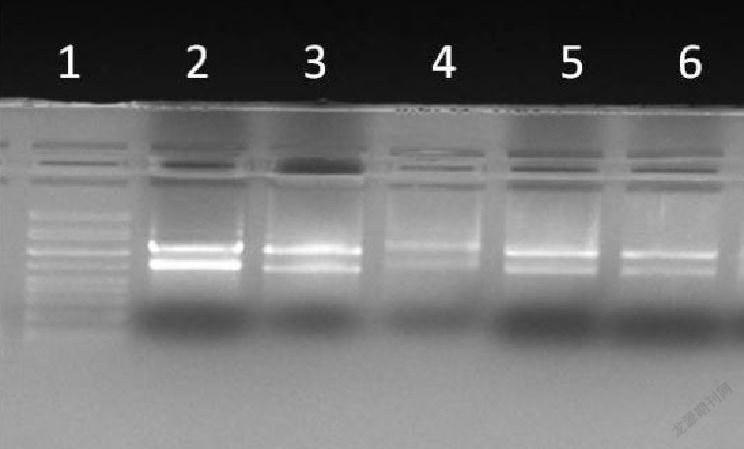
利用Eastp®Super总RNA试剂盒提取两种细菌RNA的凝胶成像图如下(图1)。
(3)结果分析
由图1可以看出:这种试剂盒提取出来的RNA质量高,完整性好,没有蛋白质和基因组DNA的污染。但一次只能处理1-2ml菌液,处理菌液量有限,对于提取大量菌液的RNA不合适。其中图1中的4号泳道在电泳时没有加样1,可能是旁边泳道的样品飘样过来的。
2.3.2 Trizol法提取微生物RNA
Trizol是一种总RNA提取试剂,它是以 “硫氰酸胍-酚-氯仿抽提法”(简称“一步法”)为基础的RNA提取试剂,这种试剂提取RNA的速度快,效率高,提取出没有污染的RNA质量高、产量大。
(1)实验步骤
1)各取1.5ml的菌液,以转速为10000×g,时长2min离心。去除上层液体,留沉淀。在含有菌体沉淀的离心管中添加200μl溶菌酶溶液(浓度为3mg/ml),静置1min;
2)往管中加入1ml的Trizol试剂,轻轻弹动,让沉淀悬浮试剂中,静置5min。
3)加400μl的氯仿,使之混合,以转速为10000×g,时长5min离心。
4)吸取上层清液500μl置于干净的离心管内,再添加1ml的无水乙醇,于零下20℃的环境中放置2-3min。
5)放置结束后,以转速为10000×g,时长10min离心,去除上层清液,干燥2-3min,加入30μl无RNA酶水。
提取后,电泳检测RNA质量,1.5%琼脂糖凝胶,6μl Marker,2μl RNA,电泳电压150V,5min,凝胶成像仪拍照。
(2)实验结果
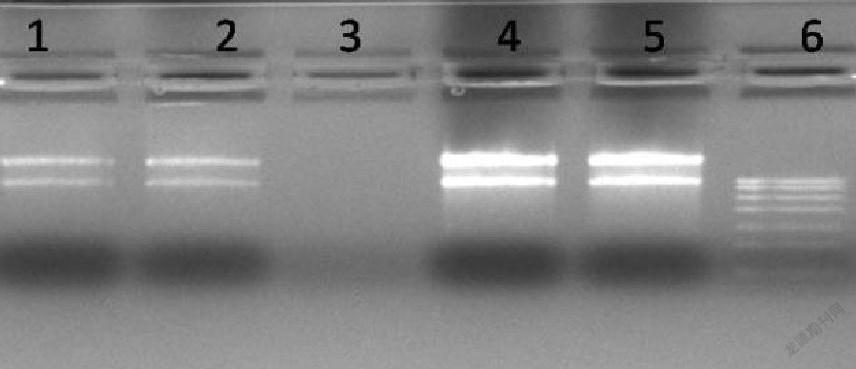
Trizol法提取两种细菌RNA的凝胶成像图如图2。
2.3.3 改良Trizol法提取微生物RNA
(1)操作步骤
1)各取1.5ml的菌液,调节离心机的转速为10000×g,时长2min进行离心。去除上层液体,留下菌体沉淀。在含有菌体沉淀的离心管里添加200μl溶菌酶溶液(浓度为3mg/ml)
2)在有混合液的离心管中添加1ml的Trizol试剂。
3)向混合液中添加200μl的氯仿,上下轻轻摇晃,使之混合,10000×g,时长10min离心。
4)吸出上层清液500μl放于其他的离心管内,再向内 添加2倍体积的无水乙醇10000×g,时长5min离心,去除上层清液,再干燥2-3min。加入30μl无RNA酶水。
电泳检测RNA质量,1.5%琼脂糖凝胶,6μl Marker,2μl RNA,电泳电压150V,5min,凝胶成像仪拍照。
(2)实验结果
改良Trizol法提取两种细菌RNA的凝胶成像图如图2。
(3)结果分析
实验结果如图2所示,用Trizol法提取到的RNA条带清晰、整齐、干净,没有蛋白質和基因组DNA的污染;而用改良Trizol法提取的2种细菌RNA,不仅RNA条带清晰、整齐、干净,没有蛋白质和基因组DNA的污染,而且RNA的量较大。
3 展望
本实验所用的大肠杆菌Escherichia coli和枯草芽孢杆菌Staphylococcus aureus分别属于革兰氏阴性细菌和革兰氏阳性细菌,前者细胞壁肽聚糖较薄,易于破壁,后者细胞壁肽聚糖较厚,不易破壁。总RNA试剂盒也能很快提取到RNA,提取时间为1h左右,而且试剂盒内提供的试剂中有能使RNA酶活性降低的物质,可以减少RNA降解。用这种方法提取的RNA的质量好、有较好的完整,纯度也高。但是产物量少,大量提取时成本较高。用Trizol法能提取出的细菌RNA,RNA质量较好,纯度较高,但是产物量少。改良Trizol法可以很快速提取出细菌RNA,不仅质量好、纯度高、产量高,而且可以大量获得细菌RNA,所以本实验摸索的改良Trizol法达到了预期效果。
参考文献:
[1] Jun HL, Chuan HT. A simple rapid and effective method for total RNA extraction from Lentinu laedodes [J].Lett Biotechnol, 2006, 28: 1193-1197.
[2]淦国英,漆艳香,蒲金基,张欣,谢艺贤.改良CTAB法提取高质量香蕉叶片总RNA.广东农业科学,2009,7:192-195.
[3]姚玉新, 赵玲玲, 郝玉金等. 改良热硼酸法高效提取苹果果实RNA[J]. 果树学报, 2005, 22(6): 737-740.
[4] 吴丽娟, 黎燕, 胡美茹等.改进SDS-Phenol法快速提取细胞RNA.第三军医大学学报, 1999, 1:57-59.
[5] 刘强,王金胜. 改良Trizol法提取尖孢镰刀菌RNA .山西农业大学生命科学学院,2013, 8(5): 813-815.
[6] Fleming JT, Yao WH, Sayler GS. Optimization of differential display of prokaryotic mRNA: Application to pure culture and soil microcosms.Appl Environ Microbiol, 1998, 64: 3698~3706.
[7] Hurt RA, Qiu XY, Wu LY, RohY, Palumbo AV, Tiedje JM, Zhou JZ. Simultaneous recovery of RNA and DNA from soils and sediments. Appl Environ Microbiol, 2001, 67 (10) : 4495~4503.
[8] Jahn CE, Charkowski AO, Willis DK. Evaluation of isolation methods and RNA integrity for bacterial RNA quantitation. J Microbiol Methods, 2008, 75: 318~324.
[9] 辛运超,张玉妥,尚小领.细菌生物膜RNA提取方法研究.国际检验医学杂志. 2015, 2: 244-246.
[10] Chomczynski P, Sacchi N.Single-step method of RNA isolationby acid guanidinium thiocyanate-phenol-chloroform extraction[J].Anal Biochem. 1987, (162): 156-159.
[11] Jeffrey WH, Nazaret S, Haven RV. Improved method for recovery ofmRNA from aquatic samples and its application to detection of merexpression. Appl Environ Microbiol, 1994, 60 : 1814~1821.
作者简介:云飞(1981年9月-),男,蒙古族,内蒙古土左旗人,博士,讲师,研究方向为基因工程。
通讯作者:石雅丽,(1981年10月-),女,汉族,内蒙古正蓝旗人,博士,讲师,硕士生导师,研究方向为基因工程。
基金项目:此文由2020年内蒙古自治区自然科学基金面上项目,项目名称:来源于蒙古牛瘤胃的坚硬芽孢杆菌降解纤维素机理的研究,项目负责人:石雅丽,项目编号:No. 2020MS03030
由2015年内蒙古工业大学科学研究项目,项目名称:海拉尔赋煤区煤系共生锗赋存规律,项目负责人:云飞,项目編号:No. ZD201524
由2017年内蒙古工业大学科学研究项目,项目名称:基于瘤胃微生物组学中纤维素酶的研究,项目负责人:石雅丽,项目编号:No. ZD201703 。
