三疣梭子蟹IAG基因的原核表达及质谱鉴定
2021-10-25喻国洪朱冬发
脱 萍,谢 熙,喻国洪,朱冬发
(宁波大学 海洋学院,宁波 315211)
三疣梭子蟹(Portunustrituberculatus)隶属于甲壳纲(Crustacea),十足目(Decapoda),梭子蟹科(Portunidae),梭子蟹属(Portunus),生长速度快、市场价值高、经济潜力大,是我国重要的经济养殖蟹类[1]。但同类相残、养殖成活率低、养殖群体性早熟等问题仍困扰着三疣梭子蟹人工增养殖业的发展,单性养殖有助于降低同类相残,提高成活率,并能有效控制养殖群体性早熟[2]。性别控制是实现单性化养殖的关键,然而,甲壳纲动物性别决定和分化的调控机制尚不明确,但普遍认为雄性发育是由促雄腺(androgenic gland,AG)分泌的胰岛素样促雄腺激素(insulin like androgenic gland hormone,IAG)来调控的[3]。通过一系列的促雄腺切除和移植实验,证明促雄腺在十足目甲壳动物雄性性征的发育、维持及对雌性性征分化的抑制等方面具有关键作用。Sagi课题组通过RNA干扰雄性罗氏沼虾(Macrobrachiumrosenbergii)IAG基因的表达,成功诱导雄性罗氏沼虾性逆转为“假雌性(neo-females)”,并将假雌性个体与正常雄性交配以产生全雄性的后代[4-5]。表明IAG基因在虾蟹类雄性分化中的关键作用,也预示了基于IAG的性别调控技术具有良好的应用潜力。三疣梭子蟹促雄腺较小,生化提取天然的IAG蛋白操作困难、获得量较少、无法满足生产需要[6],体外制备IAG重组融合蛋白对研究其功能作用及分子机制具有重要意义。
IAG是由促雄腺分泌的一类蛋白类激素,因其与哺乳动物胰岛素类似,故命名为胰岛素样促雄腺激素[7],是关键的性别分化调节因子[8]。IAG具有胰岛素超家族蛋白质的特征,其前体激素原与前胰岛素原一致,从N端到C端依次是信号肽、B链、C肽和A链,信号肽和C肽被裂解成为成熟肽,由A链和B链通过2对二硫键互连而成,A链内另有一对二硫键[9-10]。二硫键的正确配对对胰岛素样促雄腺激素的活性至关重要[11]。此外,A链处存在一个潜在的N-糖基化位点(NCT)以及两个多肽裂解位点[12]。已有报道利用pET原核表达系统成功诱导表达了普通卷甲虫(Armadillidiumvulgare)、拟穴青蟹(Scyllaparamamosain)IAG重组融合蛋白,为包涵体表达[13-14]。pET原核表达系统经常发生蛋白质错误折叠,产生非功能性包涵体蛋白,为了提高原核表达系统的表达水平和蛋白质的溶解度,利用某些分子伴侣蛋白可以帮助目的蛋白折叠的特性,将这些分子伴侣与目的蛋白共表达以促进蛋白的折叠[15-16]。
研究将已克隆到的三疣梭子蟹促雄腺IAG基因的cDNA序列(NCBI登录号为MK355618)插入到不同的原核表达载体,转入大肠杆菌BL21(DE3)和Rosetta(DE3)表达菌株,筛选原核表达系统并优化表达条件,以期获得高效表达的可溶性重组蛋白,为后续抗体制备以及功能研究奠定物质基础。
1 材料与方法
1.1 材料
1.1.1 菌株与载体
E.coliDH5α、Rosetta(DE3)和BL21(DE3)感受态均购自康为世纪,原核表达载体pET-22b、pET-28a和pET-28a-sumo均由本实验室保存。
1.1.2 主要试剂
限制性内切酶NdeI、XhoI、NcoI、Hind III和T4 DNA连接酶均为宝日医生物公司产品;质粒提取试剂盒、DNA胶回收试剂盒购于Omega公司;反转录试剂盒、His标签蛋白纯化试剂盒、ECL发光液、PVDF膜、His-tag鼠多抗、辣根过氧化物酶标记的山羊抗小鼠购于康为世纪;Bradford蛋白浓度测定试剂盒购于碧云天;蛋白预染Marker购于赛默飞世尔科技;其他试剂均为国产分析纯试剂。
1.2 方法
1.2.1 Pt-IAG的引物设计
根据Pt-IAG的cDNA序列运用Primer 5.0设计3对带有酶切位点及保护碱基的特异性引物,pET-22b重组载体目的基因上游引物F:5′-CATGCCATGGATG-TGCCTGCGCGTGATC-3′(下划线为NcoI酶切位点),下游引物R:5′-GGGAAGCTTCTGCCTATTTCGGGAAG-CT-3′(下划线为Hind III酶切位点)。pET-28a重组载体目的基因上游引物F:5′-GGAATTCCATATGATGGC-GGGCAGATTTGAG-3′(下划线为NdeI酶切位点),下游引物R:5′-CCGCTCGAGTTAGACCGCATTGGTGTGA-TCG-3′(下划线为XhoI酶切位点);pET-28a-sumo重组载体目的基因上游引物F:5′-GGAATTCCATATGA-TGTGCCTGCGCGTGATC-3′(下划线为NdeI酶切位点),下游引物R:5′-CCGCTCGAGTTACTGCCTAT-TTCGGGAAGCT-3′(下划线为XhoI酶切位点);引物交由上海生工生物工程有限公司合成。
1.2.2 Pt-IAG的克隆及重组表达载体的构建
采集雄性三疣梭子蟹的促雄腺提取总RNA,反转录为cDNA作为模板进行PCR扩增。反应条件为94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共33个循环;72 ℃再延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳鉴定,回收和纯化的目的片段连接至pMD18-T载体,转化到大肠杆菌DH5α感受态细胞,对菌落PCR鉴定为阳性的重组菌,用限制性内切酶NdeI、XhoI、NcoI和Hind III对相应的重组质粒和原核表达载体进行双酶切,酶切产物分别用1%的琼脂糖凝胶电泳分离,回收酶切产物,目的片段与表达载体在T4 DNA连接酶作用下4 ℃连接过夜,连接产物转化至大肠杆菌DH5α感受态细胞,进行菌落PCR鉴定筛选阳性克隆菌株,送往上海生工生物工程有限公司测序,构建成功的重组载体分别命名为pET-28a-IAG、pET-22b-IAG和pET-28a-sumo-IAG。
1.2.3 IAG在大肠杆菌中的诱导表达
将3个表达载体分别转化进入大肠杆菌BL21(DE3)和Rosetta(DE3)菌株。以1%的接种量扩大培养,37 ℃,200 r/min培养至OD600=0.6~0.8,进行诱导表达。根据影响蛋白诱导的3个主要因素,对成功表达的菌株进行单因素试验[17]:(1)诱导温度对目的蛋白表达的影响。将培养过夜的表达菌株以1%接种量于37 ℃,200 r/min扩大培养至OD600为0.6~0.8,在培养液IPTG终浓度为1 mmol/L时,3个表达载体分别于37 ℃、28 ℃诱导6 h,16 ℃诱导16 h,收集菌体,进行SDS-PAGE电泳检测。(2)IPTG浓度对目的蛋白表达的影响。将培养液中的IPTG终浓度分别设为0.2、0.4、0.6、0.8和1.0 mmol/L,并于16 ℃培养16 h后收集菌体进行SDS-PAGE电泳检测。(3)诱导时间对目的蛋白表达的影响。培养过夜的菌株以1%接种量培养至OD600为0.6~0.8,培养液IPTG终浓度为0.6 mmol/L,16 ℃,分别于1、2、3、4、5、6、16和24 h取样2 mL,收集菌体进行SDS-PAGE电泳检测。
1.2.4 pET-IAG重组蛋白的纯化与质谱鉴定
在最优表达条件下,将成功表达IAG重组融合蛋白的Rosetta-pET-28a-sumo-IAG菌株以1%的接种量转接至1 L的LB液体培养基(含Kanamycin 50 μg/mL)中,诱导后离心收集菌体,超声破碎,4 ℃,12 000 r/min离心10 min,收集上清液,利用His标签蛋白纯化试剂盒(康为世纪:CW0894),用含有50、100和500 mmol/L咪唑的Tris-HCl(Tris-HCl浓度为50 mmol;200 mmol NaCl;0.1% tween20,10%甘油;pH 8.0)洗脱液洗脱[18],收集洗脱液,分别取80 μL上述各梯度洗脱液与20 μL 5×SDS-PAGE上样缓冲液混合,95 ℃变性10 min,进行SDS-PAGE电泳检测,确定最佳洗脱浓度,使用Millipore超滤管对含有重组融合蛋白的洗脱液进行浓缩,浓缩后的蛋白运用Bradford法测定浓度,纯化后的IAG重组蛋白经SDS-PAGE电泳后,使用蛋白印迹装置进行Western Blot检测分析,同时对诱导表达的条带切胶送至上海中科新生命生物科技有限公司采用LC-MS-MS对酶解后的样品进行质谱鉴定。
2 结果与分析
2.1 PCR产物鉴定
PCR产物电泳检测结果(图1),在450 bp左右有明显的亮带,片段长度与目的条带大小相符,表明目的基因克隆成功。

M:1 kb DNA Marker;泳道1~3:pET-22b-IAG、pET-28a-IAG、pET-28a-sumo-IAG表达载体的目的基因。图1 IAG基因的PCR结果Figure 1 PCR amplification of IAG gene
2.2 重组载体的构建
重组质粒双酶切鉴定结果(图2),酶切后出现2条条带,一条为目的条带,位于450 bp左右,一条为酶切后载体片段,位于2 000 bp以上。表明利用基因工程方法成功得到重组原核表达载体pET-22b-IAG、pET-28a-IAG和pET-28a-sumo-IAG。

M:2 kb DNA Marker;1:pET-22b-IAG;2:Nco I、Hind III双酶切pET-22b-IAG;3:pET-28a-IAG;4:Nde I、Xho I双酶切pET-28a-IAG;5:pET-28a-sumo-IAG;6:Nde I、Xho I双酶切pET-28a-sumo-IAG。图2 重组载体双酶切鉴定Figure 2 Identification of recombinant vector plasmids by restriction enzyme digestion
2.3 IAG重组蛋白在不同原核表达载体中的诱导表达
分别诱导含有重组表达质粒pET-22b-IAG、pET-28a-IAG和pET-28a-sumo-IAG的原核表达菌株BL21(DE3)和Rosetta(DE3),进行SDS-PAGE分析(图3)。由图3可知,IAG重组融合蛋白在BL21-pET-28a-sumo-IAG[图3(a)6泳道]及Rosetta-pET-28a-sumo-IAG[图3(b)6泳道]中均有表达,Rosetta-pET-28a-sumo-IAG菌株蛋白表达条带亮度明显高于BL21-pET-28a-sumo-IAG,故后续实验选用Rosetta(DE3)表达菌株。
2.4 pET-28a-sumo-IAG在大肠杆菌Rosetta(DE3)中的表达
2.4.1 最佳诱导温度
在其他条件一致的情况下,在16 ℃、28 ℃和37 ℃诱导温度下重组融合蛋白的表达量有差异(图4),在16 ℃条件下pET-28a-sumo-IAG蛋白条带亮度明显高于28 ℃和37 ℃,16 ℃即为IAG表达的最佳诱导温度。
2.4.2 最佳诱导物浓度
在16 ℃条件下,随着诱导剂浓度升高,重组融合蛋白表达量先增加后降低(图5),浓度为0.6 mmol/L的IPTG诱导的重组蛋白表达条带最亮(泳道4),其他浓度诱导重组蛋白条带较暗且无明显变化,该融合蛋白的IPTG最佳诱导浓度为0.6 mmol/L。
2.4.3 最佳诱导时间
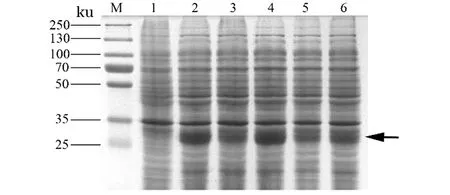
16 ℃,0.6 mmol/L IPTG经0~24 h诱导后,随着诱导时间的增加,重组融合蛋白的表达条带亮度逐步增加(图6),在16 h重组融合蛋白的条带最亮,表达量最高(泳道8),IAG重组融合蛋白的最佳诱导时间为16 h。

(a)M:蛋白预染Marker;1~6:BL21-pET-22b-IAG诱导前、BL21-pET-22b-IAG诱导后、BL21-pET-28a-IAG诱导前、BL21-pET-28a-IAG诱导后、BL21-pET-28a-sumo-IAG诱导前、BL21-pET-28a-sumo-IAG诱导后。(b)M:蛋白预染Marker;1~6:Rosetta-pET-22b-IAG诱导前、Rosetta-pET-22b-IAG诱导后、Rosetta-pET-28a-IAG诱导前、Rosetta-pET-28a-IAG诱导后、Rosetta-pET-28a-sumo-IAG诱导前、Rosetta-pET-28a-sumo-IAG诱导后。图3 重组载体在大肠杆菌BL21(DE3)和Rosetta(DE3)中的表达Figure 3 Expression of recombinant vector plasmid in E.coli BL21 (DE3)and Rosetta (DE3)
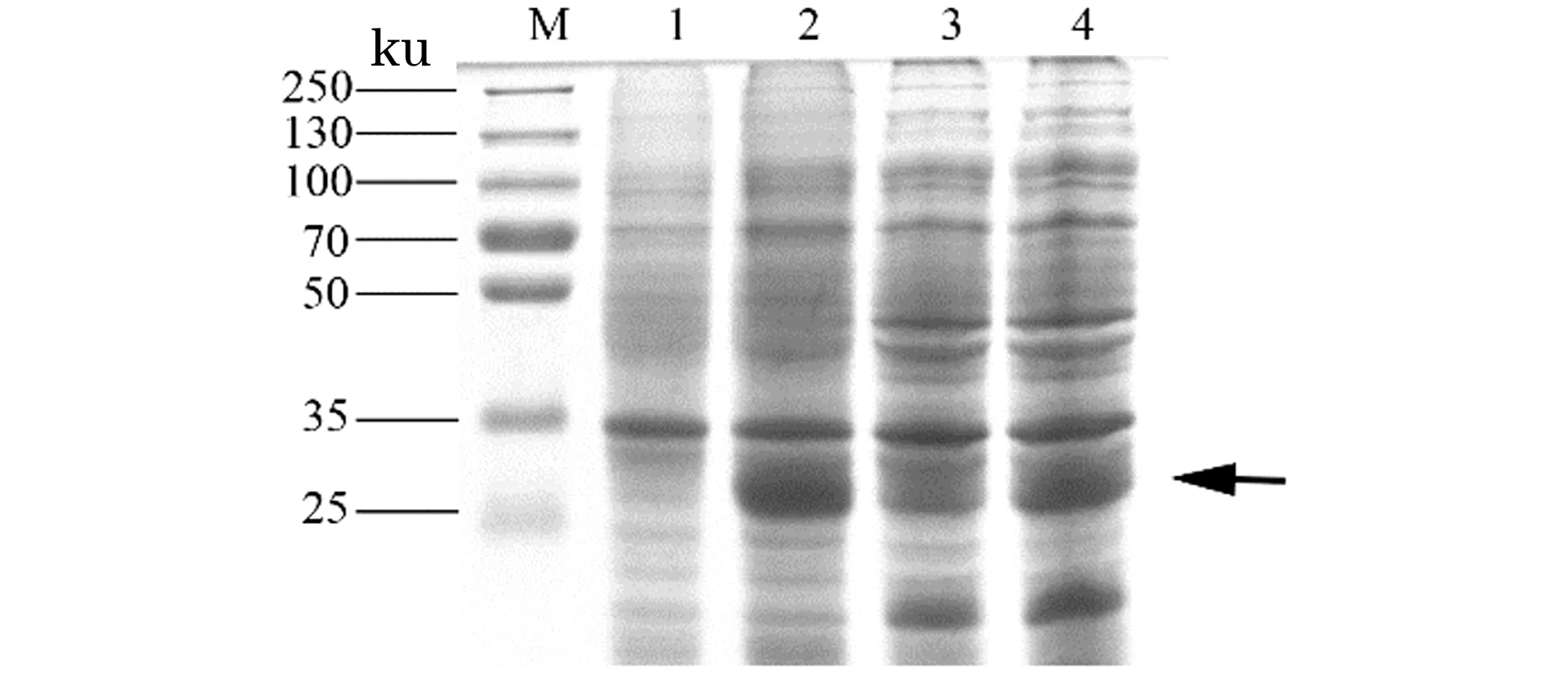
M:蛋白预染Marker;1:诱导前;泳道2~4:分别为16 ℃、28 ℃、37 ℃诱导后全菌蛋白。图4 不同温度诱导表达的SDS-PAGE分析Figure 4 SDS-PAGE analysis of expression of the IAG fusion protein at different temperatures
M:蛋白预染Marker;1:诱导前;泳道2~6:分别为0.2、0.4、0.6、0.8和1.0 mmol/L IPTG诱导后的菌液。图5 不同IPTG浓度诱导表达的SDS-PAGE分析Figure 5 SDS-PAGE analysis of expression of the IAG fusion protein at different concentrations of IPTG

M:蛋白预染Marker;1:诱导前;泳道2~9:分别为诱导1、2、3、4、5、6、16和24 h后的菌液。图6 不同诱导时间的SDS-PAGE分析Figure 6 SDS-PAGE analysis of expression of the IAG fusion protein at different induction time
2.5 IAG重组融合蛋白的纯化及鉴定
最佳诱导条件即16 ℃,0.6 mmol/L IPTG,培养Rosetta-pET-28a-sumo-IAG 16 h,收集菌体进行超声破碎,结果显示,上清液、沉淀(泳道3、泳道4)均有大量的重组融合蛋白[图7(a)]。对得到的上清液用Ni柱进行纯化,不同浓度的咪唑溶液洗脱,收集含有目标蛋白的洗脱液,经过超滤浓缩后,条带较亮且无其他杂带,纯度大于85%[图7(b)]。应用Bradford法测定浓缩后的蛋白浓度为0.95~1.17 mg/mL。收集洗脱前后菌液进行Western Blot分析,诱导前有微弱的结合条带,表明IAG重组融合蛋白有微量的本底表达,诱导后菌液,破碎菌体上清液及沉淀均可与HRP标记的His-tag多克隆抗体发生特异性结合,且与重组融合蛋白条带大小一致[图7(c)]。
切取纯化后的目标条带[图7(b)],经胰蛋白酶消化形成肽段进行质谱分析,使用MASCOT质谱匹配软件对质谱数据与蛋白质数据库进行比对分析,获得肽段的序列。结果显示,检测到两个多肽片段分别能够与蛋白数据库中三疣梭子蟹IAG相匹配,分别为B链的SFSSVCLTYK和A链的NVNGYDECCPQSTK,确定表达产物为三疣梭子蟹IAG重组融合蛋白(图8)。
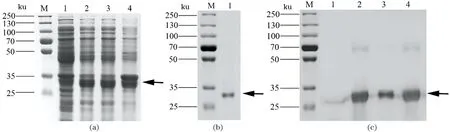
(a)M:蛋白预染Marker;泳道1~4:分别为诱导前、诱导后、破碎后上清液、破碎后沉淀。(b)M:蛋白预染Marker;1:浓缩纯化后蛋白。(c)M:蛋白预染Marker;泳道1~4:分别为诱导前、诱导后菌液、破碎上清液、破碎沉淀Western Blot印迹。图7 IAG重组融合蛋白纯化及Western Blot分析Figure 7 Purification and Western Blot analysis of IAG recombinant fusion protein

图8 IAG重组融合蛋白质谱鉴定Figure 8 Mass spectrum of the IAG recombinant fusion protein
3 讨论
大肠杆菌表达系统是目前最常用的外源蛋白表达系统,由于遗传背景清楚,容易培养、有大量可供选择的克隆载体与表达载体,使之成为人们克隆载体的主要菌株[19]。研究基于基因工程与原核表达的方法利用大肠杆菌BL21(DE3)及Rosetta(DE3)菌株成功表达出三疣梭子蟹IAG重组融合蛋白。对表达的结果进行分析发现,不同的表达载体跟菌株中的表达情况及表达量存在差别,这与人C反应蛋白表达情况一致[20]。
pET-28a-sumo-IAG表达载体在大肠杆菌BL21(DE3)及Rosetta(DE3)菌株中均有可见表达,而pET-22b-IAG和pET-28a-IAG未见表达或表达量过低未检测到,根据马超[21]的报道可能是不同的表达载体所具有的蛋白质标签不同所造成的。pET-28a-sumo-IAG表达载体能够成功诱导表达出重组融合蛋白,可能因为该载体增添了小泛素相关修饰物(SUMO),作为分子伴侣防止中间产物聚集,通过对靶细胞的类伴侣效应协助折叠来提高蛋白质表达水平[22]。同时,因其固有的伴侣特性,它具有减少蛋白质水解降解和简化纯化的巨大优势[23]。实验发现,同样的表达载体,相同的诱导条件,BL21菌株中目的蛋白的表达量也不同于Rosetta(DE3),这可能是由于Rosetta(DE3)宿主菌是从BL21衍生来的,该菌株有一个相容性氯霉素抗性质粒补充大肠杆菌稀有密码子AUA、AGG、AGA、CUA、CCC和GGA的tRNA,可增强真核蛋白表达[24],这也表示当要表达的目的蛋白中含有稀有密码子较多时,可考虑Rosetta(DE3)这种菌株。
对成功诱导表达Rosetta-pET-28a-sumo-IAG进行培养温度优化,发现重组菌株的最佳诱导温度为16 ℃,低温能够减缓蛋白的合成、折叠,减少因蛋白质翻译速率远高于折叠速率形成不稳定或者错误折叠的空间构象[25]。IPTG诱导终浓度从0~1.0 mmol/L梯度增加,目的蛋白的表达量逐渐升高到0.6 mmol/L时达到最大,随后开始降低,认为诱导剂最适浓度为0.6 mmol/L,IPTG浓度过高或者过低均会抑制表达[26]。另外诱导时间对表达量影响较大,添加诱导剂后重组融合蛋白开始表达,随诱导时间增加,表达量达到最高。低温和较低的IPTG浓度确实使蛋白质折叠明显减慢,可溶性蛋白水平升高,此外,长时间的诱导也是必要的。蛋白质质谱鉴定是基于Western Blot和ELISA传统检测方法基础上的新兴检测技术,LC-MS/MS鉴定蛋白质是目前蛋白质组学研究中普遍应用的方法[27]。
尽管将大肠杆菌表达的蛋白用于体内时,具有缺乏翻译后修饰、有内毒素和重组蛋白空间构象改变的缺点,但蛋白自然空间构象对制备多克隆抗体血清并不起决定性作用[28],故研究采用大肠杆菌Rosetta(DE3)来表达重组蛋白。研究结果对大量可溶性蛋白样品的制备具有指导意义,也为后续制备多克隆抗体及进一步在蛋白水平上研究该基因的功能奠定基础。
4 结论
成功构建了三疣梭子蟹IAG基因不同的原核表达载体pET-22b-IAG、pET-28a-IAG和pET-28a-sumo-IAG;16 ℃、IPTG浓度为0.6 mmol/L,诱导16 h后重组融合蛋白表达量最大,并能以可溶性形式分泌表达,最终纯化得到浓度为0.95~1.17 mg/mL可溶性蛋白;经过Western Blot分析及LC-MS/MS鉴定,pET-28a-sumo-IAG在Rosetta(DE3)中成功表达。
