分清主次,攻克速率平衡图像中的“U形图”
2021-10-24梁卓
梁 卓
速率平衡图像中的“U形图”(例如图1),与化工生产实际密切结合,是近几年高考的新热点,很好地考查了学生化学学科核心素养中的“变化观念与平衡思想”“证据推理与模型认知”“科学探究与创新意识”,在“宏观辨识与微观探析”“科学精神与社会责任”方面也有所体现。
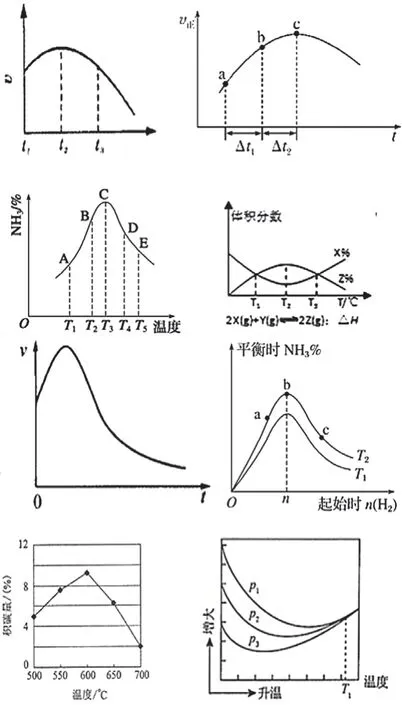
图1
不同的U形图呈现了共同的特征:随着x的增大,y的变化不单调。不同原因的背后是否会有共同的本质?解决这一类问题,突破口在哪里?图中的拐点有什么意义?图像上如何表示平衡状态?这种图像的实际意义又是什么?对这些问题的思考不仅有助于具体题目的解决,也有助于化学学科核心素养的培养。
平衡图像可以千变万化,建立平衡图像解题模型、拓展结构化的解题思路,有助于学生形成知识迁移的素养。我们知道改变温度、浓度、压强、催化剂等外界条件,会对正、逆反应速率产生影响(可能不同,也可能相同),改变条件的瞬间,正、逆反应的相对大小,决定了平衡移动的方向;结合条件的改变以及反应的具体特点(反应的热效应,左右气体物质的化学计量数之和的大小关系),也可以判断平衡移动的方向。笔者将以上关系设计成两个“知二求一”(图2),这是我们解决常规平衡图像题的思路,也是解决U形图问题的基础。
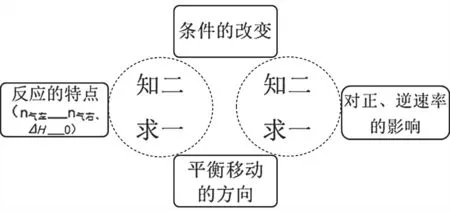
图 2
下面在此模型的基础上,来研究速率平衡图像中的U形图。
一、瞬时量—时间图
例1.【苏教版选4-41页第5题(1)问】把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,产生氢气的速率变化情况如图3所示。

图3
(1)t1~t2速率变化的主要原因是_____;
(2)t2~t3速率变化的主要原因是_____。
分析:
1.明确装置特征—镁和盐酸在试管中迅速反应,近似绝热恒容体系。
2.反应特征—放热;不可逆(不用讨论平衡)。
3.影响速率的真正条件—随横轴t增大:①c(H+)逐渐下降(速率减小);②温度逐渐升高(速率增大)。
4.由图像特征分析不同阶段影响速率的主要条件—t2之前速率增大,这和温度升高对速率的影响一致,说明此阶段温度升高是影响速率的主要条件,同理t2之后c(H+)的下降是影响速率的主要条件。
答案:(1)因反应为放热反应,随反应的进行,温度渐高,导致反应速率增大;
(2)随反应的进行,溶液中c(H+)逐渐减小,导致反应速率减小。
变式1.【改编自2011年天津卷,6题】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应+NO(g)达到平衡,正反应速率随时间变化如图4所示。
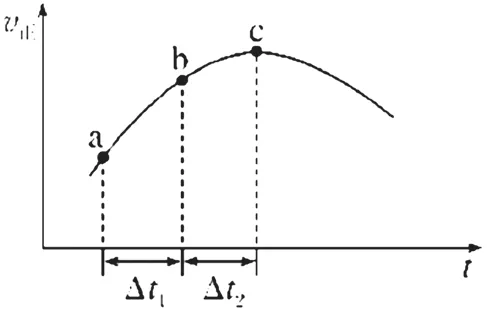
图4
(1)反应在c点是否达到平衡状态? (填“是”“否”)
(2)反应物浓度:a点 b点(填“小于”“大于”或“等于”)
(3)反应物的总能量 生成物的总能量(填“低于”“高于”或“等于”)
分析:
1.明确装置特征—绝热恒容。
2.反应特征—热效应未知,可逆(需讨论平衡)。
3.影响v正的真正条件—随横轴t增大:①c反应物逐渐下降(v正减小);②温度变化未知(若温度升高,则v正增大;若温度降低,则v正减小)。
4.由图像特征分析不同阶段影响速率的主要条件—ac段v正增加,说明一定有增速的条件,且影响超过减速条件(c反应物逐渐下降)的影响。这个增速的条件就是“温度升高”,因此该反应是放热反应,反应物的总能量高于生成物的总能量。c之后一段v正减小,说明减速条件(c反应物逐渐下降)的影响超过增速条件(温度升高)的影响,既然c反应物、温度依然在变,根据“变量不变才平衡”可知c点不是平衡状态。
答案:(1)否 (2)大于 (3)高于
总结:横轴是时间的U形图记录的是一次实验的连续过程,纵坐标是每一时刻对应的“瞬时量”。图像上显示y随x—时间变,但真正影响y的是时间背后的温度、浓度、压强在变,这些条件对纵坐标若产生相反的影响,且不同阶段主要条件不同,就会出现增减不一致的U形图。
二、等时量—温度图
例2.【苏教版选4-41页第5题(2)问】解释过氧化氢在酶催化作用下的分解反应速率随温度的变化关系(如图5)的原因。

图5
分析:题目探究的是反应速率随温度、酶活性变化的关系,则说明其他条件如过氧化氢浓度是一致的,可以把该图像看成是由一组温度不同的对比实验绘制的。
1.明确装置特征—一系列温度恒定且逐渐增大的平行实验装置。
2.反应特征—热效应未知,不可逆(不讨论平衡)。
3.影响速率的真正条件—①温度升高(速率增大);②温度升高,导致催化剂活性先增大后减小(速率先增大后减小)。
4.由图像特征分析不同阶段影响速率的主要条件:拐点之前,有两个增速条件—温度升高、催化剂;拐点之后,催化剂活性下降,增速的幅度显著减小,这个影响远超温度升高的增速影响。
答案:酶的催化作用在一定的温度范围,温度过高或过低都会降低催化效率。
变式2.【2018年 江 苏卷,20题(4)问】在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。反应相同时间NOx的去除率随反应温度的变化曲线如图6所示,在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是 ;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是 。
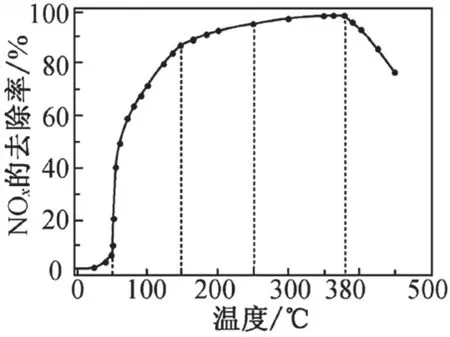
图6
提示:NH3与NOx反应速率越大,则相同时间内NOx的去除率越大,影响速率的因素是温度和随温度而变的催化剂活性、选择性(催化剂可能催化其他反应了)。
答案:迅速上升段催化剂活性随温度升高增大,与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高引起的NOx去除反应速率增大。
催化剂活性下降;NH3与O2反应生成了NO。
例3.在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应并 分别在t秒时测定其中NH3的体积分数,绘制下图(图7):
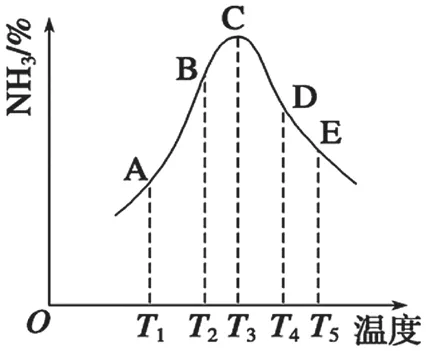
图7
(1)A~E五点中,尚未达到化学平衡状态的点是_____。
(2)此可逆反应的正反应是_____反应(填“放热”或“吸热”)。
(3)AC段的曲线是增函数,CE段曲线是减函数,试从反应速率和平衡角度说明理由。
分析:
1.明确装置特征—多个温度恒定且不同,反应时间相同。
2.反应特征—热效应未知,可逆(需讨论平衡)。
3.影响NH3%(反应相同时间)的真正条件—①温度升高,v增大;②温度升高,K变化。
4.由图像特征分析不同阶段影响速率的主要条件—C~E:NH3%减小,说明减少NH3%的条件的影响超过了增加NH3%的条件(温度升高,v增大)的影响,这个减少NH3%的条件只能是温度升高,反应在给定的时间里已达平衡,但随着温度的升高,反应正向进行的限度减小,即K减小,说明正反应是放热反应。A~C:温度升高,v增大,NH3%增大。说明A、B温度低,反应速率慢,在相同时间内尚未达到平衡。图像上的拐点C在给定的时间内正好达到了平衡状态。
答案:(1)A、B点 (2)放热 (3)AC 段:达到平衡前,温度越高,速率越快,相等时间内生成的NH3越多。CE 段:已达到平衡,升温使平衡左移, NH3%变小。
我们再来概括一下这个图像的特征,横轴是温度,纵轴是反应相同时间的量,这是一组对比实验。正反应ΔH<0,温度越高,速率越快,正反应进行限度越小,我们从曲线上的拐点C出发,在图中补出C之前平衡时NH3%随温度变化的曲线(图8)。
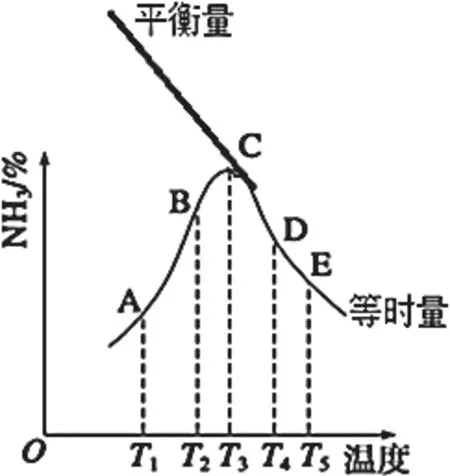
图8
这就如同一场特殊的赛跑—速度越慢的选手,需要跑的距离越长;速度越快的选手,需要跑的距离越短。比赛相同时间,结果是:速度慢的选手还未跑到终点,但跑速越快,跑的距离越长;速度快的选手早已跑到终点,原地踏步,但跑速越快,对应的跑距越短;也恰巧有选手在给定的时间内正好跑到了终点,他是一组选手中跑的距离最长的。
变式3.在一个体积为2 L的真空密闭容器中加入0.5 mol CaCO3,发生反应CaCO3(s)测得二氧化碳的物质的量浓度随温度的变化关系如图9所示。图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2浓度的变化曲线。请按要求回答下列问题:
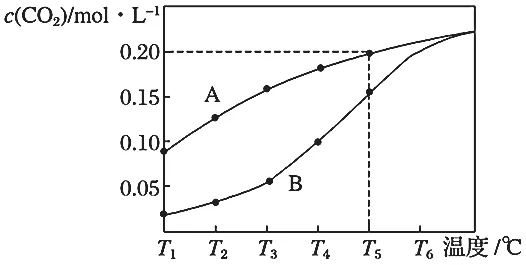
图9
(1)该反应正反应为_____(填“吸”或“放”)热反应。
(2)请说明随温度的升高,曲线B向曲线A逼近的原因。
提示:跑相同的时间,跑速越快的选手,跑的距离越长,但距离的增长幅度小于跑速的增长幅度。
答案:(1)吸。(2)随着温度升高,反应速率加快,达到平衡所需要的时间变短。
通过对横轴是温度、纵坐标是每一温度下的“等时量”(反应相等时间的量)的U形图的分析,可得出以下规律:
(1)图像记录的是一组控制变量的对比实验,温度的变化对速率、平衡、催化剂活性等多个量都有影响,而这些量对y的增减影响不同,影响大的决定曲线的趋势。
(2)温度升高导致“等时”转化率、产率下降的可能原因有: ①平衡逆向移动(已平衡,正反应为放热反应);②催化剂的活性降低;③副反应的发生。
三、平衡时产物的百分含量—投料关系图
例4.某科研小组探究在其他条件不变的情况下,改变起始物H2的物质的量对合成NH3反应(放热反应)的影响。实验结果如图10所示。

图10
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是_____(填字母)。
②若容器容积为1 L,b点对应的n(H2)=0.15 mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度为_____mol·L-1。
分析:当反应物的起始通入量为系数比时,产物的体积分数最大。拐点b点对应的n(H2)=0.15 mol,则n(N2)=0.05 mol。

答案:①c ②0.02
四、多重平衡(或多重反应)对应的U形图
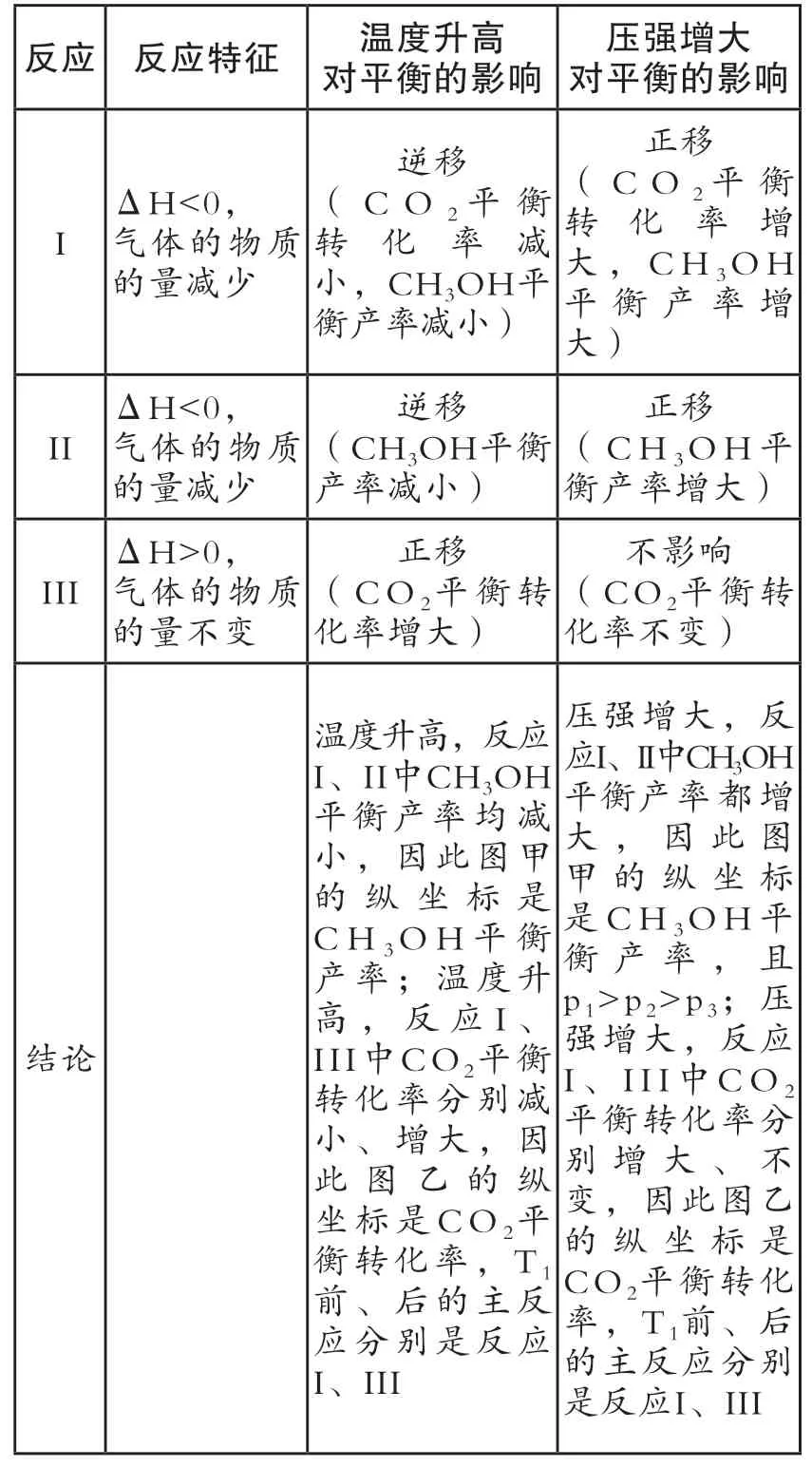
例5.【2020年山东新高考卷,18题(3)问】探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
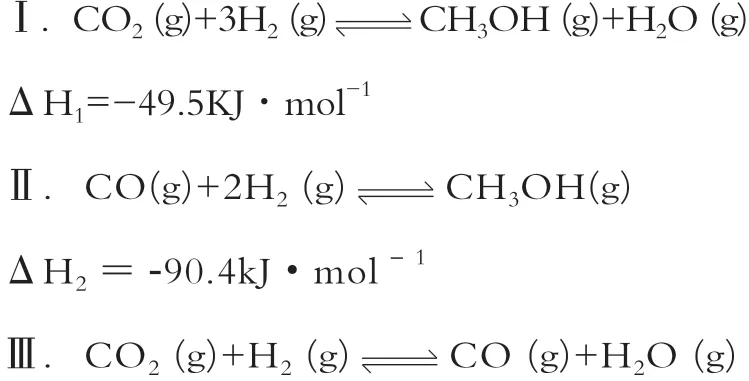
不 同 压 强 下,按 照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图11所示。

图11
其中纵坐标表示CO2平衡转化率的是图_____(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为_____;图乙中T1温度时,三条曲线几乎交于一点的原因是_____。
分析:
?
答案:乙; p1、p2、p3; T1时以反应Ⅲ为主,反应Ⅲ前后气体分子数相等,压强改变对平衡没有影响。
变 式4.【2021年××省 新 高 考 选择性试卷,14题】反应X=2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图12所示。下列说法不正确的是( )
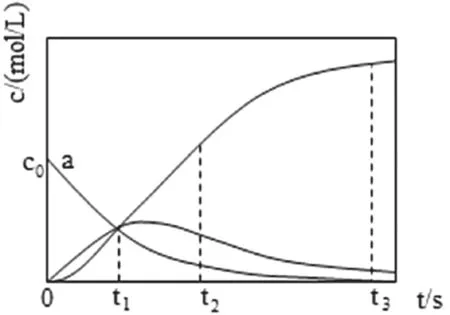
图12
A.a为c(X)随t的变化曲线
B.t1时,c(X)=c(Y)=c(Z)
C.t2时,Y的消耗速率大于生成速率
D.t3后,c(Z)=2c0-c(Y)
提示:反应①消耗Y,随着时间的延续c(Y)减少;反应②生成Y,随着时间的延续c(Y)增大。
答案:D
通过对以上几类U形图的分析,可总结解题步骤如下:
第一步:明确横纵坐标的含义。尤其要明确纵坐标是一次连续实验的“瞬时量”,还是一组对比实验的“平衡量”或“等时量”。
第二步:分析x变化的背后,引发了哪些因素的变化。这些因素对y增减变化的影响,可能相同,也可能相反。两个因素对y的影响相反时,y的变化由影响大的因素决定。
同时,我们也发现,化学平衡图像不是单纯为考试而“精心打造”的,更对化工生产有着重要的实际意义,比如U形图的拐点,往往是我们要选择的合适的生产周期、生产条件。
