3种猪病毒多重荧光PCR同步检测和鉴别方法的建立
2021-10-23史喜菊赖平安张红梅刘全国柏亚铎徐立伟
史喜菊,赖平安,张 伟,张红梅,刘全国,柏亚铎,徐立伟,种 焱
(1.中国海关科学技术研究中心,北京 朝阳 100026;2.北京海关,北京 朝阳 100026)
近些年我国对于活动物的进口需求逐年递增,每年种猪进口数量都超过2万头,供港、澳活猪数量也非常巨大。对于这些出入境的动物每头都要进行检疫,目前主要的猪病检疫对象都是对养殖业危害巨大、世界动物卫生组织(OIE)重点关注、世界各国重点防控的疫病。但目前的检测标准和方法基本上都是针对某种病原的单一检测,针对不同的检疫条款,往往需要逐个检测不同病原。如果条款中没有规定检测某种疾病,但事实上动物可能已经感染了,就会造成漏检。而且,进境动物经过长途运输后,在隔离检疫期间可能会出现一些临床疾病,很多病原都可以引起相似的临床症状,现有单一检测技术难以全面、真实地反应畜禽感染状态和发病死亡原因[1-2]。因此,本研究选择了临床上经常混合感染又难以鉴别诊断的伪狂犬病病毒(Porcine pseudorabies virus,PRV)、猪细小病毒(Porcine parvovirus,PPV)和猪圆环病毒2(Porcine circovirus type 2,PCV-2)[3-6],建立了可用于这3种病毒混合感染检测和鉴别诊断的多重荧光PCR方法,以实现多种病原同步检测、快速灵敏地筛查“未知”病原并对混合感染进行鉴别诊断的目的。
1 材料与方法
1.1 试验材料 伪狂犬病病毒(PRV)、猪细小病毒(PPV)和猪圆环病毒2(PCV-2),均由本实验室收集、保存;质控对照品及其他用于特异性测试的病毒对照品,均为本实验室制备的体外重组质粒。
1.2 试剂 IQ Powermix PCR是BioRad公司产品;病毒总核酸提取试剂盒,购自天根生化科技(北京)有限公司;探针、引物由宝生物工程(大连)有限公司合成。
1.3 试验方法
1.3.1 多重荧光PCR反应引物和探针设计 根据PRV、PPV和PCV-2的基因序列特点,通过CLCMain Workbench 7.0.3和BioEditor 1.6.1软件进行了多重比较,分别选取了最为保守的基因片段gE基因、NS1基因和ORF2基因作为扩增靶基因,根据多重荧光PCR引物、探针设计原则[1,7-8]以及后续标准化反应体系和程序要求,利用Primer 3.0设计了引物和探针,所有引物和探针序列均经过二级结构和二聚体以及错配和交叉反应性检验[1,9-12],其序列如表1所示。引物和探针用灭菌水稀释成100 mmol/L储藏液,-20 ℃保存备用。
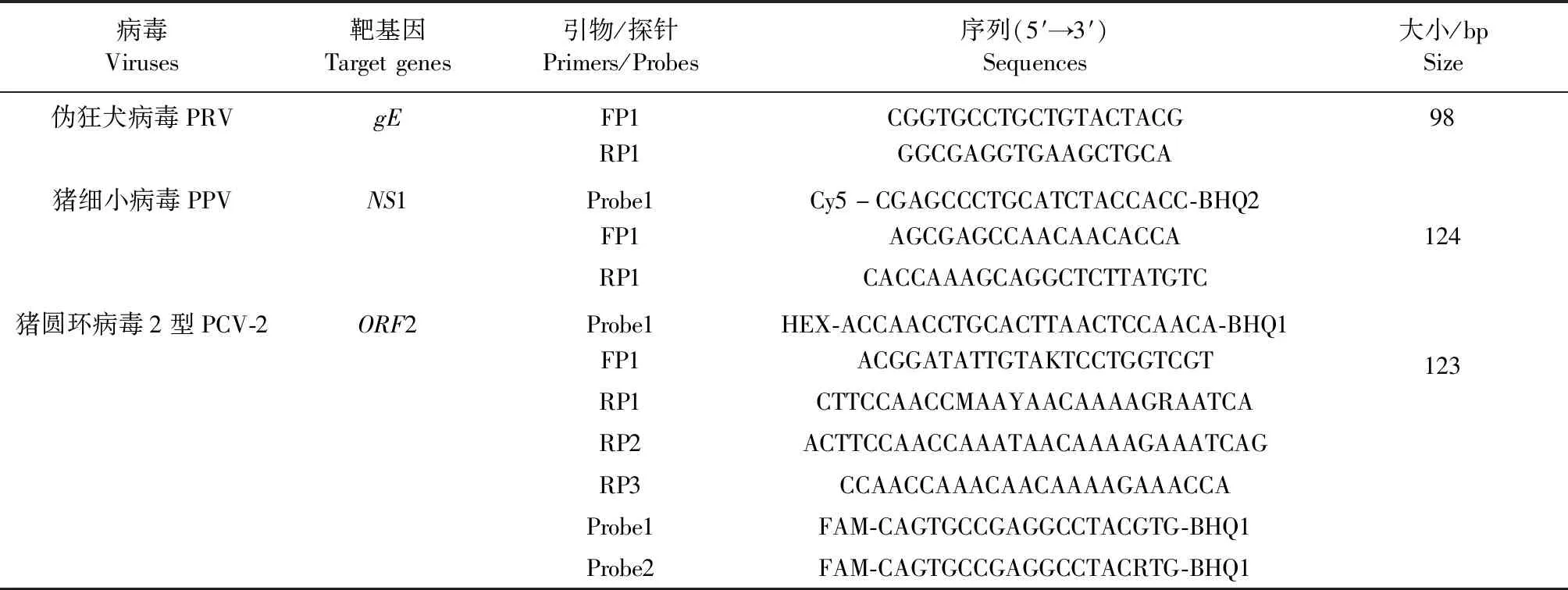
表1 PRV、PPV和PCV-2一步法多重荧光PCR检测引物和探针Table 1 Primers and probes of one-step multiplex real-time PCR for PRV,PPV and PCV-2
1.3.2 阳性质控品的制备 按照常规方法[1,13],分别扩增PRV的gE基因片段(2 745 bp)、PPV的NS1基因片段(500 bp)和PCV-2的ORF2基因片段(666 bp),并克隆于pGEM-Teasy载体,经PCR和酶切鉴定,分别获得阳性重组质粒PRV-gE-DNA、PPV-NS1-DNA和PCV2-ORF2-DNA,经测序确认后测定其OD260值和OD280值,按照质粒拷贝数(copies/μL)=(6.02×1023)×(ng/μL×10-9)/质粒大小(bp)×660计算质粒浓度,保存于-20 ℃备用。
1.3.3 多重荧光PCR反应体系的建立 将引物和探针储备液进行10倍梯度稀释,将引物进行充分混合,配制成引物混合物终浓度为400 nmol/L,探针终浓度为200 nmol/L,反应混合液包括2×IQ Powermix PCR缓冲液10 μL、引物混合物0.8 μL、PRV探针0.4 μL、PPV探针0.2 μL、PCV-2探针0.2 μL,模板DNA 1~5 μL,DEPC处理水补齐至总反应体积20 μL。将混合液充分混合后,最后加入模板,按照95 ℃、5 min;95 ℃、15 s,60 ℃、45 s,44个循环的反应程序进行一步法荧光PCR反应,所用设备为BioRad公司的CFX-96。
1.3.4 标准曲线绘制和最低检测限确定 分别将PRV、PPV和PCV-2质控品进行10倍梯度稀释后进行荧光PCR,用模板浓度-荧光Ct值做浓度标准曲线,最高稀释倍数能检测出的Ct值所对应的浓度即为最低检测限。
再将PRV、PPV和PCV-2质控品等量混合后,进行10倍梯度稀释,进行多重荧光PCR,用模板浓度-荧光Ct值做浓度标准曲线,最高稀释倍数能检测出的Ct值所对应的浓度即为最低检测限。
1.3.5 特异性试验 选择了实验室制备的猪流感病毒(SIV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV-2)、伪狂犬病病毒(PRV)、猪传染性胃肠炎病毒(TGEV)、口蹄疫病毒(FMDV)、猪细小病毒(PPV)、猪瘟病毒(CSFV)、猪流行性腹泻病毒(PEDV)共9种猪病毒质控品,分别用PRV、PPV和PCV-2的引物和探针进行了单一荧光PCR,验证引物和探针的特异性。
用建立的多重荧光PCR对上述9种病毒质控品进行了检测,验证引物和探针混合后多重反应体系的特异性。
1.3.6 多重荧光PCR和单一荧光PCR的比较 将PRV、PPV和PCV-2质控品等量混合后进行10倍梯度稀释,分别进行多重荧光PCR和PRV、PPV和PCV-2单一荧光PCR,将相同模板浓度对应的荧光Ct值进行比较,求解回归方程,比较多重荧光PCR和各单一荧光PCR的符合性。
1.3.7 临床样品测试 对实验室收集的已知PRV阳性组织样品31份、PPV阳性组织样品52份、PCV-2阳性组织样品49份以及阴性样品122份,用病毒基因组总核酸提取试剂盒(TIANamp Virus DNA/RNA Kit)按照说明书要求提取总核酸,用建立的多重荧光PCR进行检测,进行临床样品验证。
2 结果
2.1 阳性质控品的定量 将制备好的阳性质控品,分别用紫外分光仪测定其260 nm和280 nm的吸光度值并计算出质粒拷贝数,结果见表2。

表2 阳性质控品DNA纯度及含量测定Table 2 DNA purity and quantity of positive control plasmids
2.2 标准曲线绘制和最低检测限确定 分别用PRV、PPV和PCV-2质控品做浓度-Ct值标准曲线(图1)。从图1可以看出,标准曲线PCR扩增效率E值、R2和曲线斜率均在正常范围内,说明扩增效率良好。将模板进行1011倍稀释仍能检测到荧光信号,根据表2计算出对应的最低检测限在3.51~8.99 拷贝/μL。

图1 单一荧光PCR标准曲线Fig.1 Standard curves of single real-time PCRA:PRV;B:PPV;C:PCV-2
PRV、PPV和PCV-2混合质控品做多重荧光PCR浓度-Ct值标准曲线,如封二彩版图2。从中可以看出,各个多重荧光参数E值、R2和曲线斜率均在正常范围内,说明扩增效率并没有多重混合受到干扰。最高稀释倍数检出限跟单一荧光PCR没有明显差异,均可达到10拷贝/μL以下。
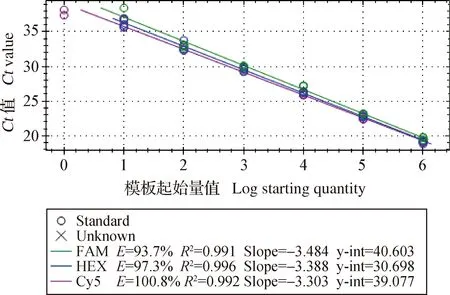
图2 PRV、PPV和PCV-2多重荧光PCR标准曲线Fig.2 Standard curve of multiplex real-time PCR of PRV,PPV and PCV-2
2.3 特异性检测 结果表明,每种病毒的引物和探针均只能扩增出各自的病毒核酸,其他病毒模板的扩增均为阴性,表明所设计的引物和探针特异性良好。利用建立的多重荧光PCR方法对1.3.5中的病毒进行检测,结果PRV、PPV和PCV-2有扩增曲线,其他病毒均无特异性扩增信号,表明所建立的方法特异性良好,结果见表3。
2.4 多重荧光PCR和单一荧光PCR的比较 利用相同模板对多重荧光PCR和单一荧光PCR的符合性测试结果表明,PRV、PPV和PCV-2单一荧光PCR与多重荧光PCR的相关性系数R2分别为0.999 9、0.998 7和0.998 4,说明多重荧光PCR和各单一荧光PCR的符合性良好,多重荧光PCR并没有产生相互干扰,扩增效率没受影响,结果见封二彩版图3。
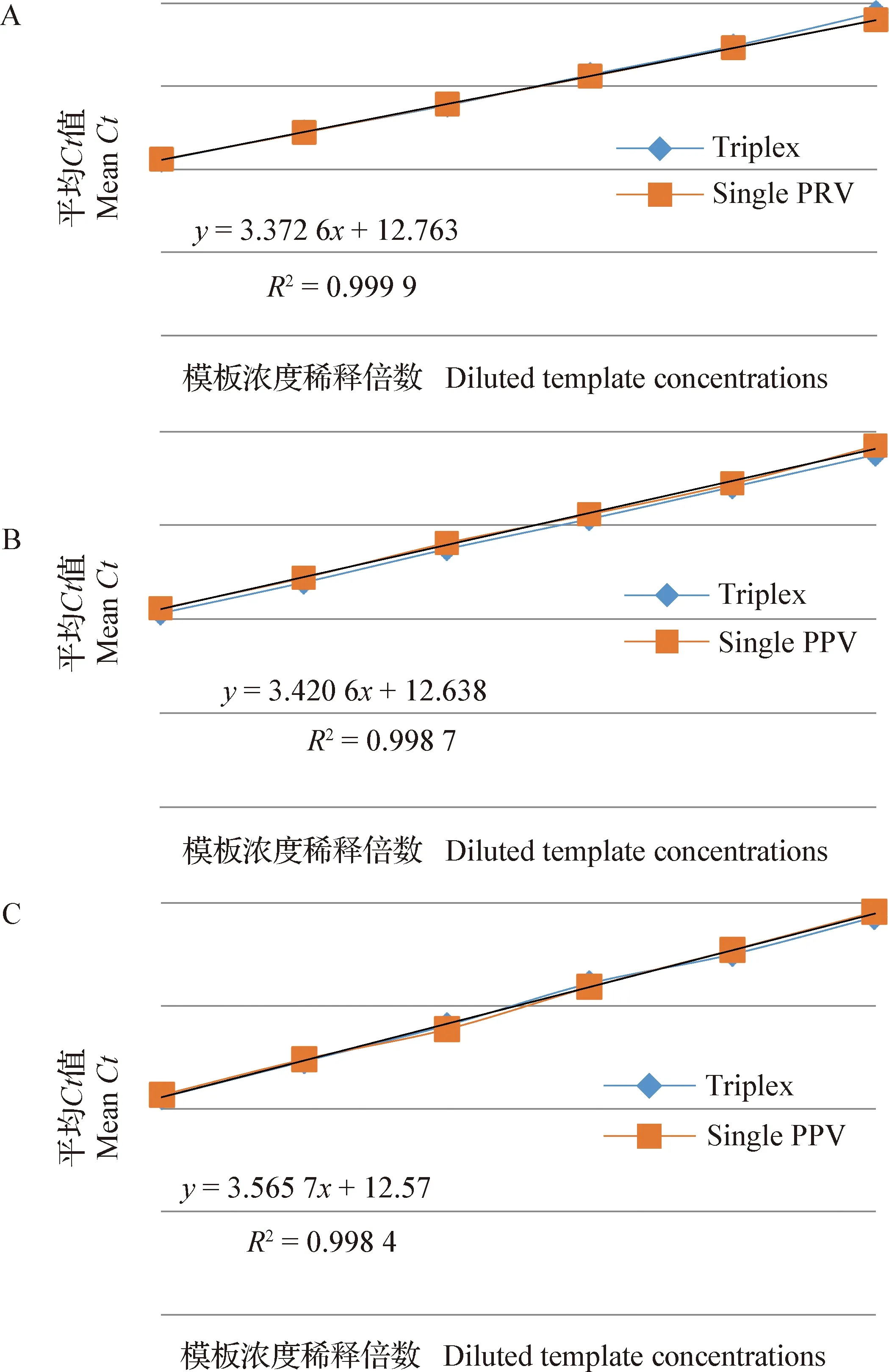
图3 多重荧光PCR与各单一荧光PCR的比较Fig.3 Comparasion between multiplex real-time PCR and the singular real-time PCRsA:多重荧光PCR与PRV单一荧光PCR的比较;B:多重荧光PCR与PPV单一荧光PCR的比较;C:多重荧光PCR与PCV-2单一荧光PCR的比较A:Comparasion between multiplex real-time PCR and PRV singular real-time PCR;B:Comparasion between multiplex real-time PCR and PPV singular real-time PCR;C:Comparasion between multiplex real-time PCR and PCV-2 singular real-time PCR
2.5 临床样品测试 用本研究建立的多重荧光PCR对已知的31份PRV阳性样品、52份PPV阳性样品和49份PCV-2阳性样品及122份阴性样品进行检测,其结果均与样品已知状态一致。不同的是,由于这些已知样品原来只做了单目标病原检测,其他病毒感染情况未知,但是通过本研究建立的多重荧光PCR检测,发现在共计132份阳性样品中,有15份呈PRV和PPV双阳性(15/132),有29份呈PPV和PCV-2双阳性(29/132),有14份呈PRV和PCV-2双阳性(14/132),有9份呈PRV、PPV和PCV-2三重阳性(9/132),表明PRV、PPV和PCV-2混合感染现象比较多见,多重荧光PCR可以检测到原来靠单一荧光PCR没有进行筛查的非目标病原,检出了混合感染,避免了漏检。
3 讨论
PRV、PPV和PCV-2均为DNA病毒,是引起猪多系统疾病的常见病原,经常混合感染,诊断和防治比较困难,是世界各国养猪场检疫净化的主要对象[1-5]。本研究针对目前单一病原检测方法的不足,建立了PRV、PPV和PCV-2三种猪病毒一步法多重荧光PCR检测和鉴别方法。
方法敏感性分析表明,本研究建立的多重荧光PCR方法最低检测限可以达到10拷贝/μL以下,与各自病原单一荧光PCR相比,虽然略有降低,但没有明显差异,这与报道的荧光PCR技术的敏感性指标一致[1,7,10]。
方法特异性分析表明,本研究建立的多重荧光PCR引物和探针特异性均为100%,3个病原的引物和探针混合后,特异性并没有受到干扰。特别是PCV-2病毒变异比较大,为了最大限度地覆盖所有分离毒株,设计了3条反向引物和2条探针,这些引物在后期单一和多重扩增中各项PCR参数均在正常范围内,扩增效率良好。
多重荧光PCR与单一荧光PCR比较分析表明,对于同一浓度模板,多重荧光PCR分别与各自单一荧光PCR扩增得到的Ct值相关性非常高,R2可达0.999,再次证明了引物和探针的混合并没有互相干扰,没有影响扩增效率。据报道,三重荧光PCR可以达到与单一荧光PCR相等的指标参数,但是四重以后敏感性和特异性均会受到不同程度的影响[7,10-11],本研究也曾尝试加入第4种病原,四重荧光PCR标准曲线指标参数很难都落在合理范围内(未公开发表),说明产生了干扰。
本研究建立的多重荧光PCR对已知阴阳性样品检测结果与已知完全一致。不同的是,从这132份 阳性样品中检测到PRV和PPV混合感染15份(15/132),检测到PRV和PCV-2混合感染14份(13/132),PPV和PCV-2混合感染29份(29/132),检测到这3种病原混合感染9份(9/132)。出现差异的原因是这些样品之前是单项病原检测筛选出来的,并没有对其他项目进行检测,而用多重荧光PCR检测后,发现了已经存在的二重和三重感染,表明这3种病原在临床上混合感染比较常见,这在Cao等(2005年)和Lee等(2007年)的研究中也有过类似报道[3-4]。这正是建立此多重检测方法的目的,实现一次采样、一次分析,多种病原同步检测,可以对混合感染的“未知病原”进行同步筛查和鉴别。
