烟草Nt14-3-3-like C基因的克隆与功能分析
2021-10-21宋坤锋郝风声刘卫群
宋坤锋 郝风声 姚 欣 王 静 刘卫群
(1河南农业大学生命科学学院,450002,河南郑州;2中国农业大学植物保护学院,100089,北京)
烟草花叶病毒(tobacco mosaic virus,TMV)属于正义单链RNA病毒,具有非常强的传染性,葫芦科、茄科和十字花科等38科268种植物均能被TMV感染[1]。由TMV引起的病害是作物生产主要的病害之一,会使作物的品质和产量受到严重影响。对 TMV发生规律和防治等方面已有大量的研究。林祥永等[2]研究发现,品种、栽培方式和气象因素都会影响烟草花叶病的发病率。从三叶鬼针草中提取的黄酮甙对TMV的抑制效果可达91.3%,表明外源施加化学或生物源物质能够有效抑制TMV的侵染[3]。此外,将基因技术应用在抗TMV的外壳基因、运动蛋白基因和复制酶基因等方面进行TMV的防治,也取得了较好的效果。如颜培强等[4]用编码 TMV外壳蛋白的 RNA片段构建反义基因,导入植株对TMV呈现免疫级抗性。植物在与病原物共同进化的过程中逐渐形成了自身免疫防御系统。利用植物体内的抗性基因进行病害防治,具有无环境污染、整个植物生长时期都起防治作用的优点。如Stange等[5]研究发现,烟草NH基因通过激活植物过敏反应和防御相关基因的表达,增强烟草对TMV的防御。本课题组前期在2个对TMV侵染具有不同耐受性品种研究[6]中发现,14-3-3蛋白家族中的14-3-3-like C、14-3-3 h1和14-3-3 h2等7个蛋白在不同耐受品种中的表达量均发生变化,说明14-3-3蛋白可能在TMV侵染过程中起着重要作用。
14-3-3蛋白家族是一类广泛存在于真核细胞中高度保守的调控蛋白,通常由多个基因编码成不同的亚型,不同亚型之间能够形成同源或异源二聚体。作为具有多亚型的蛋白家族,14-3-3蛋白发挥功能的方式也多种多样,其不仅可作为激活因子或抑制因子调控靶蛋白的结构、活性以及稳定性,还参与调控靶蛋白的核质转运与亚细胞定位[7],甚至还可以发挥与分子伴侣相似的功能,协助蛋白跨膜转运[8]。14-3-3蛋白通过与相应的靶蛋白结合,在植物生长发育、代谢、物质运输和逆境胁迫等过程中发挥重要作用,如参与植物初级代谢[9]、生长发育[10]、生物和非生物应答[11]、气孔运动[12]、油脂合成[13]等。14-3-3蛋白在植物―病原互作中也具有重要作用。Taylor等[14]发现番茄14-3-3蛋白基因TFT1是PAMPs引发的免疫反应(PAMP-triggered immunity,PTI)所必需的,从而引起该途径下游标志基因PTI5、GRAS4、WRKY28和LRR22的表达增加。Konagaya等[15]在烟草与TMV互作研究中发现,14-3-3h与N蛋白的富含亮氨酸重复结构域和病毒解旋酶结构域结合,可提高植株的抗病性。为探究14-3-3-like C在 TMV侵染过程中的生物学功能,本研究克隆了该基因并对其进行初步的功能分析。
1 材料与方法
1.1 试验材料
烟草材料为本氏烟和K326;所用PMD19-T载体、大肠杆菌感受态DH5α和农杆菌感受态GV3101均购自上海唯地生物技术有限公司;植物抑制表达载体pRNAi-LIC由本实验室保存。植物RNA提取试剂盒购自北京艾德莱生物科技有限公司;反转录试剂盒购自北京全式金生物技术有限公司;荧光定量试剂盒购自OMEGA公司;限制性内切酶购自赛默飞世尔科技有限公司;引物合成与测序均由河南尚亚生物技术有限公司完成。
1.2 基因克隆
从NCBI基因组数据库(https://www.ncbi.nlm.nih.gov/)下载基因序列并设计引物Nt1433-C-F(5′-CCATGGCGGTGGCACCGACGGCGCGTG-3′)和Nt1433-C-R(5′-CCATGGAATTTTTGGCTTCATCA GG-3′);以cDNA为模板进行扩增,扩增体系:模板 1μL,正、反引物各 1μL,2× EsTaqMasterMix 10μL,ddH2O 7μL。扩增程序:95℃预变性5min;95℃变性30s,56℃退火45s,72℃延伸1min,32个循环;72℃终延伸5min,12℃保温;扩增产物于1.2%琼脂糖凝胶进行电泳,用胶回收试剂盒回收目的条带,将其与 PMD19-T载体连接,然后转入大肠杆菌DH5α,挑取菌斑进行PCR检测,阳性克隆用于测序,测序正确的单克隆菌液于-80℃保存待用。
1.3 生物信息学分析
利用ExPASy网站ProtParam(http://web.expasy.org/protparam)预测和分析14-3-3-like C蛋白的理化性质;利用 TMHMM Server V.2.0(http://www.cbs.dtu.dk/services/TMHMM/)对14-3-3-like C蛋白进行跨膜结构预测;利用Signal-P4.1(http://www.cbs.dtu.dk/services/SignalP-4.1/)对14-3-3-like C蛋白进行信号肽预测;利用NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)在线工具分析14-3-3-like C蛋白磷酸化位点;利用SWISS-MODEL(https://swissmodel.expasy.org/interactive)预测蛋白三级结构;利用 MEGA 7.0软件对包括 14-3-3-like C蛋白在内的18个烟草14-3-3蛋白氨基酸序列进行同源性分析;利用 WoLF PSORT(https://wolfpsort.hgc.jp/)预测 14-3-3-like C蛋白亚细胞定位;利用 cNLS Mapper(http://nls-mapper.iab.keio.ac.jp/cgi-bin/NLS_Mapper_form.cgi)预测核定位序列。
1.4 14-3-3-like C蛋白的亚细胞定位
亚细胞定位使用的载体为pCAMBIA1302,选择NcoI和Spe1酶切位点,采用双酶切的方法,构建Nt14-3-3-likeC基因与绿色荧光蛋白(green fluorescent protein,GFP)的融合表达载体35S::14-3-3-likeC-GFP,用冻融法将重组质粒转入农杆菌感受态GV3101,28℃震荡培养(200转/min),当OD600为0.6~0.8时,收集50mL菌液并重悬于转染缓冲液,调节OD600为1.5,室温静置2h,使用注射器将菌液注射到本氏烟叶中,培养3d,取叶片于激光共聚焦荧光显微镜下观察。
1.5 抑制表达载体的构建
采用酶切法构建抑制载体pRNAi-LIC-14-3-3:使用引物 LIC-1(5′-CGACGACAAGACCCTATGG CGGTGGCACCGACGGCG-3′)与 LIC-2(5′-GAG GAGAAGAGCCCTTCAATTTTTGGCTTCATCAG G-3′)扩增目的基因序列,切胶回收得产物1,以其为模板,以 LIC-3(5′-CCAGCACGGAACCCTTGA GGAGAAGAGCCCT-3′)和 LIC-4(5′-AGAGCACA CGACCCTTCGACGACAAGACCCT-3′)为引物进行 PCR反应,回收得到产物 2,用限制性内切酶SmaI酶切空载体,T4DNA聚合酶处理产物1、2后和空载体用 T4连接酶连接,连接产物转入大肠杆菌DH5α并涂抗性筛选板。挑取菌斑进行菌液PCR验证。用冻融法将验证正确的重组质粒转入农杆菌感受态GV3101,农杆菌置于-80℃保存待用。
1.6 组织培养和转基因苗的鉴定
转入抑制载体 pRNAi-LIC-14-3-3的农杆菌于28℃摇床培养(200转/min),当OD600约为0.6~0.8时,收集50mL菌液用于烟草叶盘的侵染,将被侵染的烟草叶盘(1.0cm×1.0cm)在含有IAA、6-BA和卡那霉素的MS固体培养基中进行筛选,最终获得愈伤组织和通过抗性筛选的阳性小芽。
1.7 转基因烟草基因表达分析
按照RNA提取试剂盒说明书提取RNA,保证所得RNA产物OD260/OD280为1.8~2.1,OD260/OD230大于 1.8;使用反转录试剂盒进行反转录;使用SYBR Green分析法进行荧光定量,所用试剂盒为Fast Super EvaGreen® qPCR Master Mix;仪器为Applied Biosystems ABI 7500实时定量 PCR仪;PCR 反应体系:2× EvaGreen qPCR Master Mix 5.0μL,前、后引物各 0.5μL,cDNA 模板 1.0μL,ROX REFERENCE DYE 0.1μL,ddH2O 2.9μL。PCR 反应条件:95℃ 2min;95℃ 5s,60℃ 5s,72℃ 50s,40个循环。以烟草Actin为内参基因,每个样品3次重复,采用-ΔΔCt法分析数据。
2 结果与分析
2.1 烟草Nt14-3-3-like C基因的克隆
提取 K326叶片的总 RNA,以反转录合成的cDNA为模板进行PCR扩增,得到780bp的特异性条带(图1),与预期的片段大小相符。测序和比对结果表明,克隆序列与烟草基因组数据库中的Nt14-3-3-likeC基因相似性为98.34%(图2),说明成功克隆Nt14-3-3-likeC基因。
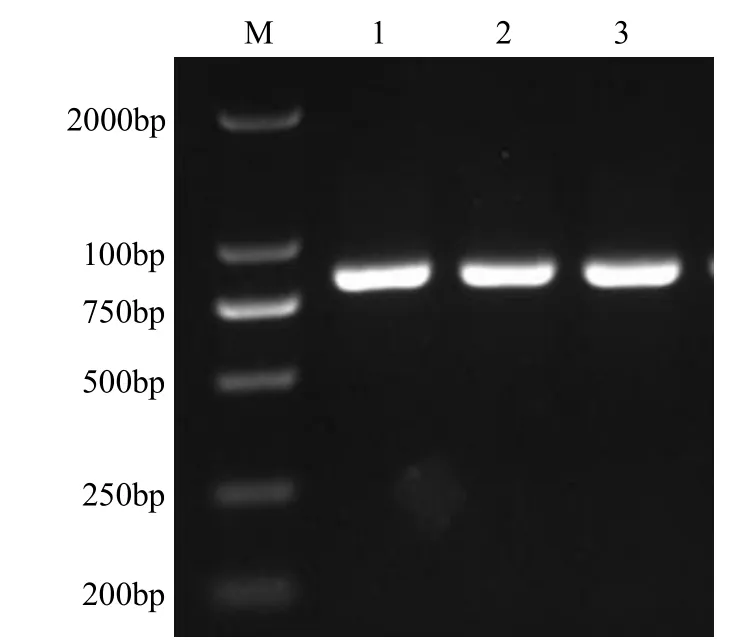
图1 Nt14-3-3-like C PCR产物电泳图Fig.1 Electrophoretogram of Nt14-3-3-like C PCR products

图2 测序序列比对结果Fig.2 Comparison of sequencing and alignment results
2.2 烟草14-3-3-like C蛋白的生物信息学分析
ExPASy ProParam在线软件分析表明,14-3-3-like C蛋白大小为29.36kDa,编码260个氨基酸;理论等电点pI为4.78;有49个带负电荷的氨基酸残基(Asp+Glu),32个带正电荷的氨基酸残基(Arg+Lys);不稳定系数为43.39,为不稳定蛋白;总疏水性平均系数为-0.543,为疏水蛋白。TMHMM Server V.2.0和Signal-P4.1软件对14-3-3-like C蛋白的跨膜结构和信号肽预测结果(图3a、b)表明,14-3-3-like C蛋白没有跨膜螺旋区和信号肽,推测该蛋白不是跨膜蛋白和分泌蛋白。NetPhos 3.1 Server的磷酸化位点分析结果(图3c)表明,该蛋白含有丝氨酸(10个)、苏氨酸(4个)和酪氨酸(6个)磷酸化位点,说明该蛋白能被激酶磷酸化。利用SWISS-MODEL软件对14-3-3-like C蛋白三级结构进行预测,结果(图3d)表明,14-3-3-like C蛋白具有 14-3-3蛋白的典型沟槽结构,该结构可能与该蛋白发挥其功能相关。

图3 14-3-3-like C蛋白的生物信息学分析Fig.3 Bioinformatics analysis of 14-3-3-like C protein
2.3 烟草14-3-3-like C蛋白同源性分析
用MEGA 7.0软件对包括14-3-3-like C蛋白在内的18个烟草14-3-3蛋白氨基酸序列进行同源聚类分析(图4),发现14-3-3-like C蛋白与烟草14-3-3 c1和14-3-3 c2亲缘关系最近,说明该蛋白可能具有14-3-3 c1和14-3-3 c2蛋白类似的功能。

图4 14-3-3-like C同源蛋白的系统进化树分析Fig.4 Phylogenetic tree analysis of 14-3-3-like C
2.4 烟草14-3-3-like C蛋白的亚细胞定位
通过WoLF PSORT预测14-3-3-like C蛋白亚细胞定位于细胞膜、细胞核、细胞质和叶绿体,cNLS Mapper预测 14-3-3-like C具有 1个核定位信号RACNLAKQAFDEAIAELDTLGEESYKDSTLIM,为了确定该蛋白在细胞中的定位,构建14-3-3-like C蛋白与GFP的融合表达载体35S::14-3-3-likeCGFP。如图 5所示,检测重组载体的菌液,通过PCR成功扩增出1条约780bp的特异性条带,表明融合GFP的14-3-3-like C表达载体构建成功,将重组表达载体转入农杆菌GV3101,利用农杆菌在本氏烟表皮细胞中瞬时表达,结果(图6)显示,14-3-3-like C蛋白位于细胞膜和细胞核中,表明该蛋白可能在细胞膜和细胞核中发挥一定的作用。

图5 融合GFP的35S::14-3-3-like C重组表达载体菌液PCR产物电泳Fig.5 Electrophoretogram of recombinant expression vector 35S::14-3-3-like C-GFP PCR amplification

图6 14-3-3-like C蛋白亚细胞定位Fig.6 Subcellular localization of 14-3-3-like C
2.5 Nt14-3-3-like C基因抑制表达载体的构建
使用引物LIC-1与LIC-2对构建的pRNAi-LIC-14-3-3载体进行菌液PCR验证,结果(图7a)显示,扩增的条带约 480bp,与预期大小一致。将 2号和3号菌液扩大培养后提取质粒,使用限制性内切酶SalⅠ和BamHⅠ双酶切,理论上酶切后有 3条带,分别为:质粒片段9.7kb、酶切片段1(622bp+480bp)和酶切片段2(1053bp+480bp),酶切结果与理论一致(图7b),表明抑制表达载体构建成功。

图7 Nt14-3-3-like C抑制表达载体的鉴定Fig.7 Identification of Nt14-3-3-like C expression vector
2.6 组织培养和转基因植株鉴定
构建成功的抑制表达载体转入农杆菌,利用农杆菌介导的叶盘转化法进行烟草组织培养,最终获得了具有卡那霉素抗性的T0代转化阳性苗(图8)。提取阳性烟苗叶片基因组DNA进行PCR扩增,以检测外源插入DNA片段,电泳结果(图9)表明,扩增的目的片段大小为500bp,与引物设计扩增序列的大小一致,初步表明Nt14-3-3-likeC抑制载体已成功转入烟草植株中。qPCR从转录水平检测阳性植株中Nt14-3-3-likeC基因表达水平的抑制程度。结果(图10)表明,阳性植株中Nt14-3-3-likeC基因表达成功受到抑制。

图8 农杆菌介导的遗传转化Fig.8 Agrobacterium-mediated genetic transformation

图9 转基因植株PCR检测结果Fig.9 Detection results of transgenic plants

图10 转录水平上基因表达抑制的检测Fig.10 Detection of gene expression inhibition at transcription level
2.7 转基因烟草基因表达分析
TMV侵染植物时会诱导病原防卫途径中的基因表达,侵入植物体内后,TMV会破坏植物的光合途径,因此以野生型K326为对照(CK),通过qPCR分别检测了CK和Nt14-3-3-likeC基因抑制烟草植株叶片中与病原防卫和光合途径相关的基因表达水平。结果(图11)显示,病原防卫途径中的NtN基因(烟草抗病标志基因)与NtPR1-a基因(反映植物抗病能力)和光合途径中的NtPsaA、NtPsbA、NtPetD、NtTIC32、NtGDR、NtOEEp基因表达量均极显著下调,表明Nt14-3-3-likeC基因抑制影响病原防卫和光合途径中的基因表达。
3 讨论
植物在与病原物共同进化的过程中逐渐形成了自身的免疫防御系统,利用该系统进行病菌的防治,不仅为抗病基因在结构、功能和进化等方面的基础研究提供了重要理论基础,也为植物病害的防治提供了新思路,因此,植物病原互作越来越受到关注。植物―TMV病原互作是一种典型的植物―病原互作模式,其互作机制复杂,具体机制仍不清楚。本课题组前期在2个对TMV侵染具有不同耐受性的烟草品种中发现,14-3-3蛋白家族中的14-3-3-like C、14-3-3 h1、14-3-3 h2等7个蛋白在不同耐受品种的表达量均发生变化[6],说明14-3-3蛋白在植物响应TMV侵染的过程中起着重要作用。越来越多的证据表明,14-3-3蛋白在植物―病原互作中具有重要作用,但具体的机制并不清楚。本研究以Nt14-3-3-likeC为候选基因,克隆出Nt14-3-3-likeC基因并对其进行初步的功能分析,为进一步探究14-3-3-like C蛋白在TMV侵染中的功能奠定了基础。
序列比对和进化树分析表明,14-3-3-like C与14-3-3 c1和14-3-3 c2同源性最高,说明三者可能具有相似的功能。Malgorzata等[16]研究表明,14-3-3 c1与植物质膜H+-ATP酶结合,参与细胞内外物质运输调控。14-3-3-like C蛋白亚细胞定位结果显示,14-3-3-like C蛋白位于细胞膜和细胞核,而生物信息学分析表明,14-3-3-like C蛋白不具有跨膜结构域,说明14-3-3-like C蛋白不位于细胞膜上,而是可能与膜蛋白结合,在细胞物质转运或信号转导等方面行使一定功能,另外,14-3-3-like C也定位于细胞核,暗示14-3-3还可能通过与转录因子结合,参与基因的表达调控。Viso等[17]研究表明,14-3-3蛋白和脱落酸调控相关的转录因子 ABl3共同结合于拟南芥后胚胎发生基因AfEm7和AfEm6的启动子上,对其转录表达进行调控,在结合Em基因启动子的转录复合物中,14-3-3蛋白可能作为接头蛋白发挥功能。另有研究[18]表明,TMV侵染会破坏光合系统,也会激活植物的病原防卫机制。因此,本研究通过qPCR对转基因材料相关基因的表达进行分析,发现在Nt14-3-3-likeC基因抑制材料中,病原防卫相关基因NtN、NtPR-1a和光合途径相关基因NtPetD、NtPsbA、NtPsaA、NtTIC32、NtGDR、NtOEEp的表达水平都显著下调,说明Nt14-3-3-likeC基因可能通过抑制植物病原防卫和光合途径相关基因的表达参与对 TMV侵染的响应。今后我们将通过对T1代植株接种TMV,展开后续研究,来进一步明确14-3-3-like C蛋白在TMV侵染中的功能。本研究为14-3-3蛋白在TMV侵染过程中的生物学功能和植物―TMV病原互作机制奠定基础,对TMV的防治具有重要意义。
4 结论
从烟草K326中成功克隆出Nt14-3-3-likeC基因。生物信息学分析结果表明,14-3-3-like C是一个典型的14-3-3蛋白家族成员,与14-3-3 c1和14-3-3 c2同源关系最近。亚细胞定位结果显示,14-3-3-like C蛋白位于细胞膜和细胞核中,说明该蛋白可能在细胞膜和细胞核发挥一定的作用。通过qPCR对转基因材料中相关基因的表达进行了分析,结果表明,在Nt14-3-3-likeC基因抑制材料中,病原防卫相关基因NtN、NtPR-1a和光合途径相关基因NtPetD、NtPsbA、NtPsaA、NtTIC32、NtGDR、NtOEEp表达水平均极显著下调,说明该基因可能通过抑制植物的病原防卫和光合途径的相关基因表达参与对TMV侵染的响应。
