圣路易斯脑炎病毒实时荧光定量RT-PCR检测方法的建立
2021-10-21姚彦红吴晓卫张伟
姚彦红吴晓卫张伟
(1.甘肃医学院病原生物学教研室,甘肃 平凉 744000;2.深圳市尚维高科有限公司分子生物学研究室,广东 深圳 518000)
前言
圣路易斯脑炎病毒(St.Louis encephalitis virus,SLEV)隶属于黄病毒科(family Flaviviridae)黄病毒属(Flavivirus),病毒直径大小为40~50nm,有表面突起的囊膜和浓集的核心,其基因组为单股正链RNA[1]。血清学分类与日本脑炎病毒、西尼罗热病毒、墨累谷脑炎病毒等同属乙型脑炎病毒群[2]。SLEV病毒于1933年首次发现于美国,主要流行于北美洲的密西西比河和俄亥俄河流域等区域,虫媒是这种病毒的关键传播载体,容易导致感染者患上颇为严重的中枢神经系统疾病,目前并无专门的疫苗与特效药[3,4]。
圣路易斯脑炎病尚未在我国暴发流行,故国内对此病原检测技术的研究目前很少,2017年张娜娜等[5]报道了一种基于制备含SLEV基因的假病毒颗粒的荧光定量PCR检测方法用于检测圣路易斯脑炎病毒,该方法的最低检测限为1.8×103copies·mL-1。但是近些年,国际交流频繁度不断攀升,这意味着这种病毒有较大几率传入我国。为此,开发一种安全有效、简便快捷的检测方法对于该病毒的及时诊断和防控具有重要意义。
本文主要研究重组质粒技术结合荧光定量实时PCR检测方法,这种方法凭借其灵敏度高、检测快速、特异性高等优势,在病原的基因表达水平分析、定量定性检测等领域运用颇广[6]。通过合成含有圣路易斯脑炎病毒的保守靶标基因和设计特异性引物和TaqMan探针,建立一种圣路易斯脑炎病毒实时荧光定量RT-PCR检测方法,并对该方法进行验证测试,探究其对于圣路易斯脑炎病毒的检测效果,为相关部门或医疗机构对圣路易斯脑炎病毒的流行病学调查和传染病监测提供一种技术基础。
1 材料方法
1.1 病毒株、质粒
重组西尼罗病毒和黄热病毒购自南京赛泓瑞生物科技有限公司,登革热病毒由江苏国际旅行卫生保健中心惠赠,日本乙型脑炎病毒减毒活疫苗采购自成都生物制品研究所,圣路易斯脑炎病毒由本公司提供序列交于南京金斯瑞生物科技有限公司合成。
1.2 试剂和仪器
MgCl2、dNTPs、Taq DNA聚合酶、MMLV酶、荧光定量PCR通用试剂盒premix Taq购自宝生物工程(大连)有限公司。BL21感受态细胞、T4 DNA连接酶、限制性内切酶EcoR I/HindIII/NotI以及高保真酶PrimeSTAR均由NEB生产。pUC57载体及连接试剂盒由北京TIANGEN公司生产。上海华舜生物公司所提供的试验用材分别为胶回收试剂盒、质粒提取、RNA提取试剂盒。本次使用的实时荧光定量PCR仪由美国应用生物系统公司生产,对应的系统是StepOne Software v2.0。
1.3 荧光定量RT-PCR方法的建立
1.3.1 引物和探针设计
由NCBI数据库中(https://www.ncbi.nlm.nih. gov/)下载多条SLEV的基因序列进行反复比对分析,选取的圣路易斯脑炎病毒保守NS5基因核苷酸序列(GenBank登录:KY271953.1)作为靶标,利用DNAStar系统开展同源性分析,由此筛选出特异核苷酸且高度保守的区域作为靶标区域合成氨苄抗性的质粒序列。在设计特异性荧光探针和引物过程中,使用的系统是Primer Express 5.0,而本次所选用的探针与引物均来自于南京金瑞斯生物公司,序列详见表1。

表1 圣路易斯脑炎病毒NS5基因实时RT-PCR检测的引物和探针
1.3.2 质粒鉴定与DNA核酸标准品制备
质粒合成后经测定,浓度为40ng·μL-1(原材料为干粉质粒4μg,加入100μL的TE溶液溶解),拷贝数为2.99×1011copies·mL-1,测定方法参考徐珍等研究方法[7]。以10倍梯度稀释浓度至2.99×102copies·mL-1,取少量各浓度下的质粒进行电泳鉴定,在100~250bp中间均有明显的条带。
制备SLEV病毒核酸标准品:-80℃下EP管中保存的BL21感受态细胞于冰上解冻,吸取浓度为40ng·μL-1的合成质粒5μL加入到95μL的BL21感受态细胞中,冰浴30min后,42℃热休克90s再于冰上放置5min;加入900μL的LB培养基,37℃振荡培养1h;离心后吸取100μL上清液涂布于LA平板上,37℃倒置培养过夜;挑取单菌落接种于LA液体培养基,37℃振荡培养2h,取1.5mL的菌液根据酶切位点进行酶切,对酶切产物回收进行电泳,电泳跑出140bp条带对应的菌液送上海生工测序鉴定。将测序正确的质粒克隆扩增作为SLEV病毒核酸标准品pUC57-NS5,使用质粒DNA快速小提试剂盒提取核酸并纯化,-80℃保存备用。核酸标准品经过测定,浓度为6.61×109copies·mL-1。
1.3.3 样本RNA提取
采用上海华舜生物技术有限公司的RNA提取试剂盒提取核酸,具体参考产品说明书。
1.3.4 Real-time PCR反应体系的建立及优化
在本次研究中,模板使用的是稀释的重组质粒,获取的指标主要是最高荧光增量值与最小Ct值,通过矩阵法分别对探针浓度(0.2~2μM)及探针浓度(0.1~1μM)加以优化,然后基于RT-PCR反应条件,选用最优的退火温度来对浓度一致的重组质粒加以检测,这个温度区间在55~65℃。
1.3.5 标准曲线建立与结果判定
以质粒为对象,对其进行10倍梯度稀释,使之为2.99×1010~29.9×100copies·mL-1,在最优反应环境下进行扩增,完成标准曲线的绘制。判定为阳性的条件为荧光强度增加值达到阴性对照3倍,同时循环阈值不超过40(含),否则就可以将其判定为阴性。
1.3.6 特异性试验
依次采用重组西尼罗病毒、黄热病毒、登革热病毒、日本乙型脑炎病毒减毒活疫苗,以pUC57-NS5重组质粒为模板,完成RT-PCR扩增,由此对本试验方法的特异性进行检测。
1.3.7 敏感性试验
以FBS将SLEV病毒核酸重组质粒标准品pUC57-NS5进行10倍梯度稀释至6.61×101copies·mL-1,依次提取DNA与反转录cDNA,完成灵敏度检测。
1.3.8 重复性试验
以相同样品为对象,基于一致性的条件,完成5次组间、组内试验,完成本次试验方法重复性检测。
1.3.9 检测方法的初步应用
从甘肃、新疆、内蒙等地牧场采集蚊虫27份,从大连、天津、厦门、深圳等沿海港口城市郊区使用诱蚊灯捕捉蚊虫49份,共计检测蚊虫样品66份,将所有的蚊虫研磨处理之后,取其中10份分别加入等量SLEV病毒核酸重组质粒(浓度为6.61×106copies·mL-1),提取核酸圣路易斯脑炎病毒检测。产物扩增结果送上海生工进行测序。
2 结果
2.1 质粒鉴定
质粒经过稀释后进行凝胶电泳鉴定,凝胶电泳结果显示,目的条带约为140bp,与预期的长度大小一致,见图1。

图1 质粒电泳鉴定结果
2.2 反应体系的优化
优化探针、引物的退火温度、浓度等参量,获得最优RT-PCR反应体系:模板5μL,上/下游引物SLEV 3341Fp/SLEV 3480Rp (10pmol·μL-1)分别为1.5μL、TaqMan探针SLEV3380Probe(10pmol·μL-1)0.8μL、2×Premix Taq 12.5μL、MMLV酶(5U·μL-1)0.2μL、ddH2O 3.3μL、ROX Reference Dye(50×)0.2μL。具体反应条件:50℃15min,95℃ 5min,95℃ 15s,60℃30s、65℃ 30s,45个循环。60℃30s完成FAM荧光信号的采集。
2.3 标准曲线的绘制
以阳性重组质粒为对象,对其进行10倍稀释,然后将其用作模板并进行扩增,由此便能获得动力学曲线,其浓度为2.99×1010~29.9×100copies·mL-1,扩增效率与R2值分别为94.25%和0.9999,标准曲线方程为y=-3.4678x+44.682,具体可参见图2。

图2 荧光定量PCR标准曲线
2.4 特异性测试
依次选用SLEV病毒重组质粒pUC57-NS5、重组西尼罗病毒、黄热病毒、登革热病毒、日本乙型脑炎病毒减毒活疫苗核酸用作模板,得到的扩增结果为阴性,没有非特异性扩增情形,意味着此方法拥有颇佳的特异性。

图3 荧光定量PCR特异性试验
2.5 敏感性测试
将浓度为6.61×109copies·mL-1的SLEV病毒核酸重组质粒标准品pUC57-NS5进行10倍梯度稀释至6.61×101copies·mL-1,将浓度6.61×108copies·mL-1、6.61×107copies·mL-1、6.61×106copies·mL-1、6.61×105copies·mL-1、6.61×104copies·mL-1、6.61×103copies·mL-1、6.61×102copies·mL-1、6.61×101copies·mL-1的稀释样品分别提取DNA并反转录cDNA,进行灵敏度检测。结果显示,最低可检测到浓度为6.61×102copies·mL-1的SLEV病毒核酸重组质粒标准品。
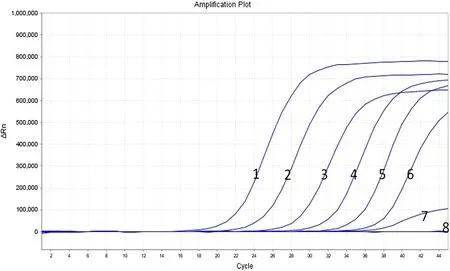
图4 荧光定量PCR检测灵敏度试验
2.6 重复性测试
通过重复性扩增试验,能够获得Ct值变异系数不超过1.5%,这意味着RF-PCR检测法具有较佳的可重复性,同时也有颇高的稳定性,详细数据可参见表2。

表2 实时荧光定量PCR的组内、组间重复性试验结果
2.7 检测方法的初步应用
对采集的66份蚊虫样品经过检测均为圣路易斯脑炎病毒阴性;加入SLEV病毒核酸重组质粒的5份蚊虫样品检测结果为圣路易斯脑炎病毒阳性,扩散产物经过上海生工测序结果一致;单独圣路易斯脑炎病毒阳性重组质粒为阳性。

图5 检测方法的应用检测结果
3 讨论
SLEV自1932年夏天在美国伊利诺伊州首次暴发流行,1933年夏天在密苏里州的圣路易斯暴发流行病例达到1000人,据已有文献报道,圣路易斯脑炎仅在北美地区流行[8]。人类是目前已知的自然感染该圣路易斯病毒后致病的唯一宿主,感染后可使人类中枢神经系统感染性疾病,严重者甚至死亡,且高龄是病死的高危因素,成人感染病死率10%~25%[9,10]。目前并无圣路易斯病毒感染针对性治疗药物,结合当前世界人民全球性流动可能导致圣路易斯脑炎在国内传播流行,所以,想要更好地做好疫情筛查与控制工作,就必须要创建早起快速诊断体系。圣路易斯脑炎病毒作为可感染人类且致病的病原,运用荧光定量PCR检测方法进行检测具有实现快速检测的特点,本次成功完成RF-PCR检测法的设计与优化,为这种病毒的监测与检测提供了更为快速、特异与灵敏的方法。使用本方法对采集的66份蚊虫样品和5份加入SLEV病毒核酸重组质粒的蚊虫样本进行检测,在66份蚊虫样本中未检测出圣路易斯脑炎病毒的阳性,混合有SLEV病毒核酸样品中检测出圣路易斯脑炎病毒的阳性结果,说明本研究方法在临床样品检测上结果准确,阳性检出率为100%。
本研究运用生物学软件反复对比分析圣路易斯脑炎病毒的基因序列,在确定以其保守片段NS5基因作为靶标后,设计引物和荧光探针,使用合成重组质粒样品,按照正交试验方法对反应体系进行了优化,成功开发了SLEV病毒的RF-PCR检测技术。通过本次所提供的检测方法对圣路易斯脑炎病毒质粒标准品进行敏感性检测,结果显示,最低可检测到浓度为6.61×102copies·mL-1。特异性试验表明,建立的方法对于黄病毒属的其它病原不存在非特异性扩增情况,完全可以针对圣路易斯脑炎病毒的鉴别检测。重复性测试表明,该方法检测的变异系数小于1.5%,检测方法稳定性良好。
综上所述,本研究建立的圣路易斯脑炎病毒实时荧光定量RT-PCR检测方法能够运用于对圣路易斯脑炎病毒的检测,该方法可以为圣路易斯脑炎病毒的流行病学调查和传染病监测提供一种技术基础,便于医院、疾控和相关检测机构更好地应对疾病和疫情的诊断和监测。
