13C标记法测定猪血液、大肠组织和大肠内容物中挥发性脂肪酸含量
2021-10-21吕良康赵胜军
张 博,杨 俊,冯 志,李 强,吕良康,任 莹,2,赵胜军,2*
(1.武汉轻工大学动物营养与饲料科学湖北省重点实验室,湖北武汉 430023;2.动物营养与饲料安全湖北省协同创新中心,湖北武汉 430023)
适宜含量和比例的挥发性脂肪酸(VFA)构成是保证肠道正常和稳定的前提之一[1]。有研究表明,大肠微生物发酵产生的VFA 可维持体液和电解质平衡,为宿主提供能量[2]。其中,乙酸可穿过血脑屏障,通过其稳态调节食欲[3-4];乙酸和丙酸可以直接激活G 蛋白偶联受体[5];丁酸是肠道细胞的关键能量来源,还能促进胃排空以及维持肠道黏膜的屏障作用,也可以抑制组蛋白去乙酰化酶的活性,降低结肠癌和结肠炎的风险[6-8]。
猪大肠发酵产生的一部分VFA 在肠道被吸收,供机体利用,未被吸收利用的则随着大肠内容物以粪便形式排出体外。因此,测定猪大肠VFA 的产生量首先要了解VFA 在体内的去向。Douglas 等[9]利用同位素示踪技术研究结肠微生物发酵产生的VFA 产量与全身VFA 通量的关系,结果表明[2H]-VFA 和[13C]-VFA 可用于测量机体VFA 通量,且方法简单精准。Markantonatos 等[10]研究发现,使用[13C]-VFA 作为示踪剂可准确获得稳态条件下荷斯坦母牛瘤胃的VFA 代谢信息。故基于VFA 在猪大肠吸收和利用的重要性,本试验推测可利用 [13C]-VFA 稳定性同位素灌注法,跟踪猪大肠内产生的VFA 的去向,获得猪体内的VFA 代谢信息。目前有关猪血液、大肠组织和大肠内容物中[13C]-VFA 的测定方法未见报道。因此,本试验旨在采用气相色谱-质谱联用法对猪血液、大肠组织和大肠内容物中[13C]-VFA 含量进行分析研究,并对该方法进行精准性验证,为该方法广泛应用于研究大肠VFA 利用提供理论依据。
1 材料与方法
1.1 试剂材料 同位素对照品乙酸(1-13C)、丙酸(1-13C)、丁酸(1-13C)标准品为广州谱恩科学仪器有限公司产品;乙酸、丙酸、丁酸标准品为阿拉丁化学试剂有限公司产品;超纯水为武汉轻工大学动物营养与饲料科学湖北省重点实验室自制。
用超纯水与乙酸、丙酸、丁酸、乙酸(1-13C)、丙酸(1-13C)和丁酸(1-13C)配制相同浓度为1 mg/mL的混合标准品溶液,作为储备液。然后经超纯水稀释得到100 μg/mL 的混合标准品溶液,作为中间储备液。
1.2 仪器与设备 气相色谱-质谱联用仪(Agilent 7890B-5977B,美国),配备有电子轰击(EI)电离源和四级杆质量分析仪,配有7693A 和7650A 进样器,G1701FA 工作站;万分之一天平(Ohaus AR2140,美国);KQ5200 超声波清洗器(昆山舒美超声仪器有限公司);优普超纯水机(西安优普仪器设备有限公司)。
1.3 上机条件 Agilent DB-FFAP 色谱柱(30 m×0.25 mm×0.25 μm),载气:高纯氦气(He),纯度>99.999%;升温程序条件:初始温度50℃,保持1 min,以10℃/min升至200℃;进样口温度:250℃;流速:1.0 mL/min;进样量1 µL;分流比2:1;电离方式:EI;电子能量:-70 eV;电子倍增器电压:0.954 kV;离子源温度:230℃;四级杆:150℃;传输线温度:280℃;扫描方式:全扫描;扫描范围:33~200 m/z。
1.4 试验方法
1.4.1 样品采集 选取1 头30 kg 左右体况良好的生长猪,预试3 d 玉米-豆粕型基础日粮后,对其手术安装回肠末端“T”型瘘管。待其恢复正常采食后,前期以24 mL/h 的速度灌注5 min,后期以5.7 mL/h 的速度从“T”型瘘管处灌注3 种[13C]-VFA(乙酸、丙酸、丁酸),灌注持续至5 h。灌注结束后采集血液,装入预先加了数滴肝素(300 IU/mL)的离心管中,立即将离心管置于冰瓶中送至实验室离心,离心后分装于1 mL 小管中,密封并于-20℃保存。采血后按畜类屠宰要求屠宰,采集大肠的盲肠、结肠、直肠3 段完整肠道以及内容物并称重,置于-80℃冰箱保存备用。3 段肠道按质量比取样,内容物混匀取样,待检测。
1.4.2 样品前处理 将血浆样品在4℃下融解,充分混匀,取500 μL 于EP 管中,加入2 mL 超纯水进行稀释,在常温条件下利用超声波清洗机超声30 min 进行混均,并经过0.22 µm 的有机系微孔滤膜过滤后保存,待检测。按质量比精密称取-80℃冻存的3 段大肠肠道组织样品共0.5 g 于研钵中,加入液氮进行研磨,研磨粉碎后置于烧杯中,加入超纯水溶解并稀释至25 倍,利用超声波清洗机超声30 min 进行混匀,混匀后8 000 r/min 离心30 min,取上清液经过0.22 µm 的有机系微孔滤膜过滤后保存,待检测。精密称取解冻过后的-80℃冻存大肠混合内容物共0.5 g 于烧杯中,加入超纯水溶解并稀释至400 倍,利用超声波清洗机超声30 min 进行混匀,8 000 r/min 离心30 min,取上清液经过0.22 µm 的有机系微孔滤膜过滤后保存,待检测。
1.5 线性回归方程、线性范围及检出限 以1.1 中6 种挥发性脂肪酸的浓度为100 µg/mL 的混合标准品溶液作为中间储备液,用超纯水逐步稀释得到1、2、5、10、15、20、25、30、40、50、80、100 µg/mL 的标准品溶液,用作标准曲线的制备。上机前以0.22 µm 的有机系微孔滤膜过滤,按照1.3 中上机条件进行分析。以溶液浓度为横坐标,峰面积为纵坐标作图,得线性回归方程。选择目标物3 倍信噪比的浓度为其检出限。
1.6 方法的精密度、准确度和回收率考察 配制10、30、50 µg/mL 3 个浓度梯度的6 种对照品VFA 各4 份,每天配制1 批,持续做3 d,分别在日内和日间按1.3中上机条件上机检测,每个浓度重复测定4 次,按照其峰面积代入线性方程计算相应浓度,计算其日内和日间变异系数,考察所建立方法的精密性;以血液、大肠组织和肠道内容物为供试品,平行取样3 份,按1.4.2 进行样品处理后,按照1.3 中上机条件测定,考察所建立方法的重复性;以10、30、50 µg/mL 3 种浓度的标准曲线点为供试品,上机前以0.22 µm 的有机系微孔滤膜过滤,按照1.3 中上机条件测定,重复测定4 次,考察所建方法样品回收率。
2 结果与分析
2.1 标准曲线、线性范围及检出限考察 由表1 可知,乙酸、丙酸、丁酸含量分别在1~100、5~100、10~100 µg/mL 线性关系良好;同位素标记的乙酸、丙酸、丁酸含量分别在10~100、10~100、10~100 µg/mL线性关系良好,6 种VFA 相关系数R2最小值为0.9904,检出限分别为0.15~1.18 µg/mL。

表1 不同标准VFA 的标准曲线、线性范围、相关系数以及检出限
2.2 方法的精密度与重复性 由表2 可知,低中高3 种浓度的6 种VFA 日内精密度在0.06%~9.6%,6 种VFA日间精密度在2.21%~8.18%,且各目标物保留时间不超过0.5%,符合方法学要求。方法的重复性考察结果表明,血液样品中6 种VFA 浓度的相对标准偏差(RSD)在1.72%~3.95%;大肠组织中6 种VFA 浓度的RSD在2.69%~7.38%;大肠内容物中6 种VFA 浓度的RSD在0.88%~3.53%;且3 种样品6 种VFA 的保留时间的RSD 均不超过0.5%。
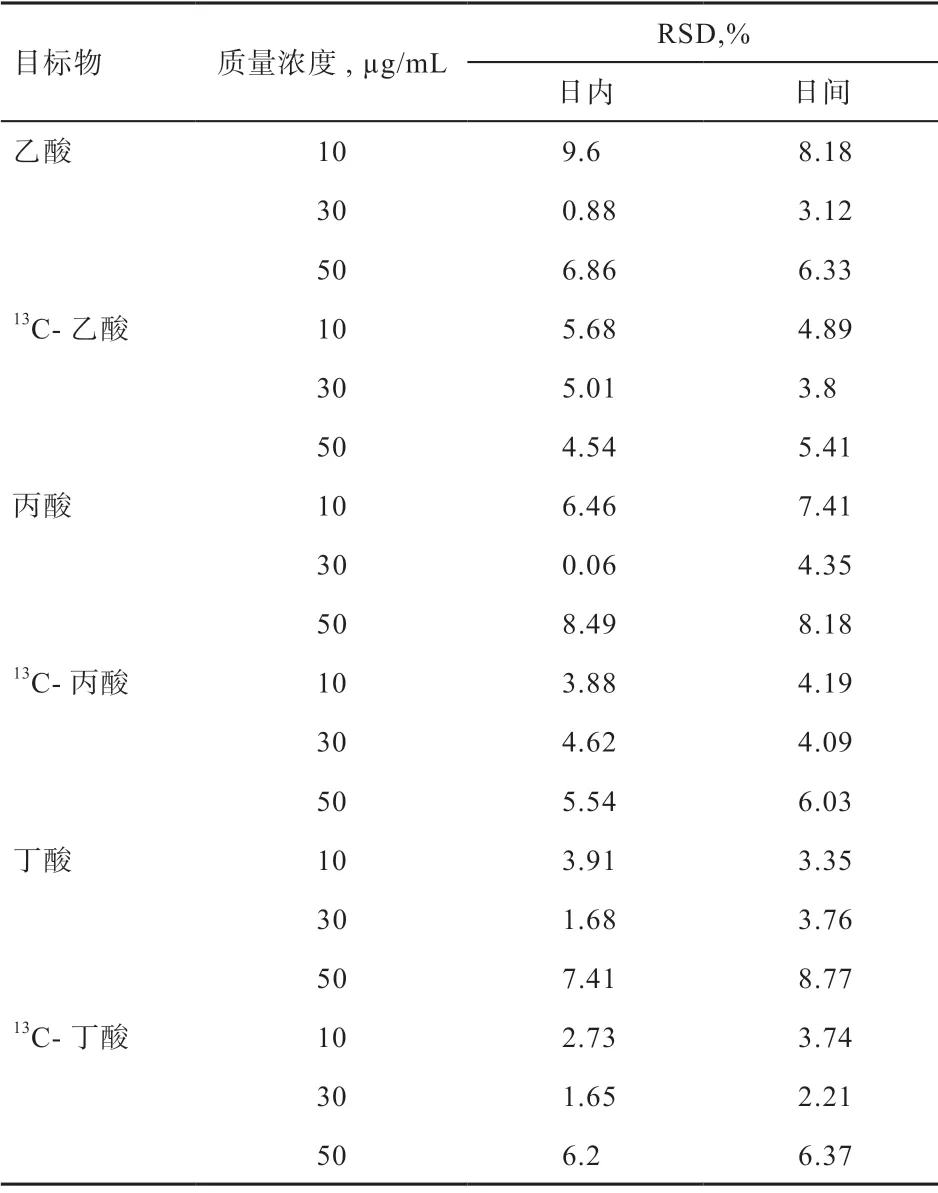
表2 GC-MS 测定[12C]-VFA 和[13C]-VFA 的精密度
2.3 方法的回收率 方法的回收率考察结果如表3 所示,对于非同位素挥发性脂肪酸,乙酸的回收率在90.76%~104.17%,丙酸回收率在70.42%~97.88%,丁酸的回收率在71.75%~119.00%;对于同位素标记的VFA,乙酸回收率在92.88%~126.36%,丙酸回收率在89.15%~110.20%,丁酸回收率在73.23%~114.68%。

表3 6 种VFA 的回收率
2.4 血液、大肠组织和肠道内容物中6 种VFA 含量的测定 将血液、大肠组织和肠道内容物样品经1.4.2 处理后,按1.3 条件上机进行检测。检测得出3 种样品色谱图如图1、2、3 所示。找出6 种VFA 对应的色谱峰,根据特征离子定量积分得到相应的峰面积,根据标曲计算出相应的VFA 含量如表4。

表4 血液、大肠组织和肠道内容物中6 种VFA 含量

图1 血液样品中VFA 色谱图

图2 大肠组织样品中VFA 色谱图

图3 肠道内容物中VFA 色谱图
3 讨 论
短链脂肪酸(SCFAs)是结肠腔中的重要有机酸,可为结肠提供能量支持[11]。肠道中的SCFAs 主要是由大肠中未吸收的膳食碳水化合物经厌氧微生物发酵产生的[12];产生的SCFAs 大部分被盲肠和结肠快速吸收,只有5%~10% 存在于粪便、血液和尿液中[13]。进入肠上皮细胞和肌肉组织的VFA 被转化成酮体以及CO2用于供能。研究表明,VFA 可为猪生长需要提供5%~25%的能量[14]。人们通常采用气相色谱和液相色谱与各种检测器(如折射率、紫外线、火焰离子化、质谱等)相结合的方法测定VFA 含量,这些测定方法多用于尿液、血液、粪便和结肠内容物等样品中,在动物肠道组织样中的应用较少[15-19]。液相色谱通常用于检测液体样品中VFA 含量,气相色谱更常用于测定肠道内容物等固体样品中VFA 含量。由于乙酸、丙酸、丁酸等SCFAs 对紫外和折射率检测器的信号响应通常很弱,因此本研究利用[13C]-VFA 作为示踪剂,准确地跟踪VFA 在机体内的转运去路。通过测定[13C]-VFA 各去向的相对量,从而有效地获取猪大肠中VFA 的代谢利用信息。本试验中各目标物在检测范围内线性关系良好,6 种VFA检出限在线性范围最高为100 µg/mL,而当浓度高于该上限值时,测定结果依然满足其标准曲线,因此,今后可对其线性范围进行进一步拓展与优化;且本试验单个样品测定时间只需要16 min,快速简便,并且可用于测定肠道组织中VFA 含量。但是根据试验测定结果可看出,[13C]-VFA 占总VFA 的比值均在5%以上,说明试验中[13C]-VFA 的灌注量偏高,有可能对机体正常代谢活动产生影响。因此,为减少同位素灌注过量带来的试验误差,在今后对VFA 进行定量研究时,可以适当降低[13C]-VFA 的灌注量。
4 结 论
本试验采用气相色谱-质谱联用技术建立了一种用于猪血液、大肠组织和大肠内容物中[13C]-VFA 和[12C]-VFA 含量的测定方法,6 种VFA 浓度的日间与日内RSD 均小于10%,且保留时间不超过0.5%。,6种VFA 线性方程相关系数均在0.99 以上,检出限在0.15~1.18 µg/mL,加标回收率在70.42%~126.36%。该方法可操作性强、简单快速,可用于准确测定猪血液、大肠组织和大肠内容物中[13C]-VFA 与[12C]-VFA 含量,为广泛应用于研究大肠VFA 利用与动向提供理论依据。
