黔北麻羊TGFβ2基因克隆、表达及生物信息学分析
2021-10-21周志楠
张 艳,敖 叶,洪 磊,周志楠,陈 祥*
(1.贵州大学高原山地动物遗传育种与繁殖教育部重点实验室,贵州省动物遗传育种与繁殖重点实验室,贵州贵阳 550025;2.贵州大学动物科学学院,贵州贵阳 550025)
转化生长因子β2 基因(Transforming Growth Factor Beta 2,TGFβ2)是TGF-β超家族成员之一,具有多种生物学效应,在哺乳动物卵巢颗粒细胞增殖、分化、卵泡发育和繁殖等方面发挥重要作用[1]。TGF-β信号广泛参与到尼罗罗非鱼的性腺发育中,尤其是对于卵母细胞的生长发育具有重要作用[2]。研究发现,TGFβ2基因不仅参与调节雌性绵羊性腺及卵巢卵泡细胞的生长发育[3],还有助于鸡排卵后卵泡的退化[4];TGFβ2基因还可作为南方黄牛肌肉生长发育有利的候选基因[5]。张增荣等[6]在鸡的不同组织及不同生长发育阶段均检测到了TGFβ2基因的表达,表明TGFβ2基因广泛参与了鸡各个阶段的生长发育,说明TGFβ2基因是影响鸡肌肉生长发育的重要候选基因。综上,TGFβ2基因不仅参与机体正常生长发育,还可能影响着动物的生殖发育,与哺乳动物繁殖性能有关。
黔北麻羊体格较大,体质结实,四肢粗壮,属肉用型品种;具有抗病性强、耐粗饲等特点;被毛分为深褐色及浅褐色2 种,是贵州地方三大山羊品种之一[7-9]。本实验以黔北麻羊为研究对象,采用T-克隆技术获得黔北麻羊TGFβ2基因编码区序列,生物信息学方法分析其蛋白结构功能;RT-qPCR 技术分析黔北麻羊TGFβ2基因在各性腺轴组织中的表达特征,初步探究黔北麻羊TGFβ2基因在性腺轴组织的表达水平和蛋白结构功能,为探析其高繁殖潜力的分子调控机理提供基础数据。
1 材料与方法
1.1 实验材料 本研究实验动物由贵州省习水县富兴牧业有限公司提供,选取成年3 岁黔北麻羊母羊6 只,屠宰后分别采集黔北麻羊母羊的下丘脑、垂体、子宫、输卵管和卵巢5 个性腺轴组织,羊只屠宰方法及其注意事项参考贵州省地方标准《羊屠宰操作规程》(DB22/T 2740-2017),采集的组织样品使用锡箔纸包做好防污染处理并标注,置于液氮中运回实验室,移至-80℃冰箱保存备用。
1.2 实验试剂及仪器 TRIzol@Reagent RNA 提取试剂盒、荧光定量试剂Ultra SYBR Mixture、胶回收试剂盒等购自康为世纪生物科技有限公司,cDNA 逆转录试剂盒(Genstar,美国)、液氮、三氯甲烷、0.5%TAE 缓冲液、异丙醇、75%乙醇、西班牙琼脂糖、氨苄青霉素(三水)购自贵州艾瑞特生物有限公司;pMD-19T 克隆载体、DNAMarker600、DNA Marker2000 购自大连宝生物工程有限公司,T4 DNA 连接酶、LB Broth 培养基购自上海生工生物工程技术服务有限公司。紫外可见分光光度计(型号为NANODROP2000)、37℃恒温摇床购自Thermo Fisher 有限公司;电泳仪(DYY-2C 型)、掌上离心机、振荡器购自北京六一仪器厂;PCR 扩增仪(C1000 Touch ™)、实时荧光定量PCR 仪(型号为CFX96 Real-Time System)、凝胶成像系统(Universal Hood II)购自美国BIO-RAD 有限公司。
1.3 实验方法
1.3.1 引物设计与合成 根据NCBI-GenBank 数据库中上传的山羊(Capra hircus)TGFβ2基因的mRNA 外显子拼接序列(登录号:XM_018060159.1),利用Primer Premier 5.0 软件设计实时荧光定量与CDS 区克隆扩增引物,以β-actin为内参基因。引物送至上海生工生物工程技术服务股份有限公司合成。引物详细信息见表1。

表1 引物序列信息
1.3.2 总RNA 提取与cDNA 第一链的合成 采用Trizol法提取组织总RNA,使用超微量分光光度计检测组织RNA 的浓度和纯度,观察光密度比值(OD260/OD280),峰图单一且OD260/OD280比值在1.8~2.0 的组织RNA于-80℃冰箱中保存。RNA 统一定量后使用逆转录试剂盒将RNA 逆转录合成第一链cDNA。
1.3.3 实时荧光定量PCR 与数据分析 以β-actin 为内参基因,运用RT-qPCR 技术对TGFβ2基因在黔北麻羊性腺轴组织的表达水平进行检测。扩增程序:95℃预变性105 s;95℃变性15 s,62.7℃退火15 s,68℃延伸30 s,40 个循环;95℃变性5 s;最后由机器自动设置(基础温度60℃,每5 s 增加0.5℃扩增至95℃)进行熔解曲线收集。扩增体系:2×Ultra SYBR Mixture 5.5 μL,上、下游引物(10 pmol/L)各0.5 μL,cDNA 1 ng/μL,ddH2O补足10 μL。采用2-ΔΔCt法分析TGFβ2基因在黔北麻羊性腺轴5 个组织中的差异表达量,用SPSS 19.0 软件分析黔北麻羊不同组织中的表达水平,P<0.05 表示差异显著,P<0.01 则表示差异极显著。
1.3.4 PCR扩增黔北麻羊TGFβ2基因CDS 区 以cDNA 第一链为模板,RT-PCR 扩增黔北麻羊TGFβ2基因的CDS 区。TGFβ2基因CDS 区PCR 扩增条件:95 ℃预 变 性3 min;95 ℃变 性45 s,59 ℃退火45 s,72℃延伸1 min,35 个循环;72℃终延伸5 min,4℃保存,PCR 扩增体系为20 μL:cDNA 2 ng/μL,上、下游引物(10 pmol/L)各1.5 μL,2× Es Taq MasterMix10 μL,H2O 补足20 μL。并对PCR 产物进行1%的琼脂糖凝胶电泳检测。
1.3.5 目的基因TGFβ2的克隆 按照北京康为世纪有限公司胶回收试剂盒说明书进行回收,并检测胶回收产物浓度与纯度;将胶回收产物与pMD-19T 载体进行连接反应(金属浴16℃,12 h),涂板转至大肠杆菌感受态细胞DH5α;37℃恒温箱过夜培养;并挑取平板上的白斑放入10 mL 含氨苄青霉素的LB 液体培养基中,37℃、200 r/min 摇12~16 h;待菌液浑浊后立即进行菌液PCR 反应;1%琼脂糖凝胶电泳检测菌液PCR 产物;筛选目的条带正确的阳性菌液送至(上海)生工生物股份有限公司进行测序。
1.3.6 黔北麻羊TGFβ2基因生物信息学分析 测序结果通过DNAStar 软件比对正确后,使用MegAlign 软件进行同源性分析;在线软件ExPASy(https://web.expasy.org/protparam/)分析蛋白质理化性质;ProtScal 程序(https://web.expasy.org/protscale/)分析蛋白质疏水性;SOPMA(http://npsapbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白质二级结构、SWISS-MODEL(www.swissmodel.expasy.org)预测蛋白质三级结构;PSORT II Preadict(https://psort.hgc.jp/form2.html)亚细胞定位分析;SignalP4.1Sever(http://www.cbs.dtu.dk/services/SignalP-4.1)进行氨基酸信号肽预测;MEGA6.0 软件构建不同物种中的系统进化树。
2 结果与分析
2.1 PCR 扩增黔北麻羊TGFβ2基因TGFβ2基因荧光定量引物与CDS 区克隆引物扩增结果见图1(A、B),PCR 扩增产物均与预测片段大小一致,且条带清晰、单一无二聚体等非特异性片段扩增,可用于下一步实验。

图1 凝胶电泳检测黔北麻羊TGFβ2 基因的PCR 扩增
2.2 黔北麻羊TGFβ2基因T 克隆载体的鉴定 黔北麻羊TGFβ2基因相比于NCBI 中山羊TGFβ2基因的CDS区序列吻合度高达99.85%,共发生2 处突变,均是位于终止密码子的突变,突变位点位置为第1 327 位碱基由T 突变为G,第1 329 位碱基由A 突变为G,但均为同义突变,不会引起氨基酸序列的改变,菌液PCR及测序验证证实TGFβ2基因编码序列已成功克隆至pMD-19T 载体中,说明pMD-19T-TGFβ2亚克隆载体构建成功(图2、3)。

图2 黔北麻羊TGFβ2 基因菌液PCR 电泳检测图
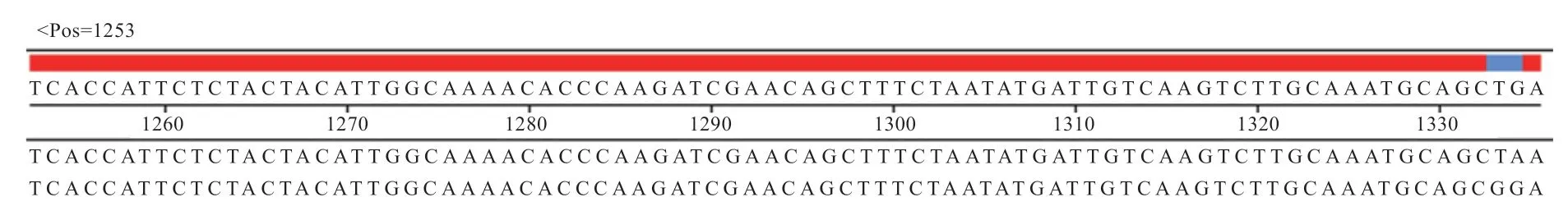
图3 黔北麻羊TGFβ2 基因部分克隆与NCBI 上传序列对比结果
2.3TGFβ2基因在黔北麻羊不同组织中的表达分析 由图4 可知,TGFβ2基因在黔北麻羊子宫、输卵管、垂体、下丘脑、卵巢5 个组织中均有表达,子宫组织表达量极显著高于输卵管和下丘脑组织,显著高于垂体和下丘脑组织。输卵管、垂体、下丘脑及卵巢4 个组织间均未达到差异显著水平。
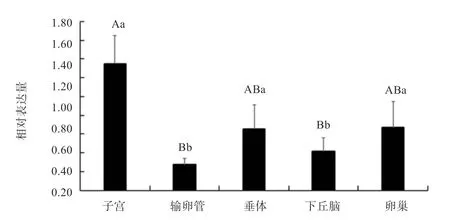
图4 TGFβ2 基因在黔北麻羊不同组织中的表达
2.4 黔北麻羊TGFβ2基因CDS 区生物信息学分析
2.4.1 黔北麻羊TGFβ2 蛋白质理化性质分析 黔北麻羊TGFβ2基因CDS 区包含1 329 bp,共编码442 个氨基酸,分子式C2245H3535N615O662S25,原子总数7 082,编码的蛋白分子量50.53 kD,理论等电点8.74;该蛋白中丝氨酸(Ser)含量最多,占氨基酸总量的10.0%,色氨酰胺(Trp)含量最少,占氨基酸总量的1.1%。该蛋白的不稳定指数为53.17(不稳定指数>53.0 时为不稳定蛋白),为相对不稳定蛋白。由图5 可见,TGFβ2 蛋白第8 位丙氨酸的疏水性最强,为2.856,第326 位精氨酸的亲水性最强,为-3.622,负值氨基酸数量多于正值氨基酸,证实该蛋白为亲水性蛋白,多肽链整体表现为亲水性。
2.4.2 黔北麻羊TGFβ2 蛋白高级结构分析与预测 结果显示,TGFβ2 蛋白质二级结构中无规则卷曲所占比例最大,为50.45%,其次是α-螺旋,为32.58%,延伸链占比为14.93%,β转角仅占比2.04%。
2.4.3 黔北麻羊TGFβ2 蛋白亚细胞定位分析 细胞定位分析结果表明,该蛋白可能位于真核生物中,约44.4%位于细胞壁;33.3%位于核散斑(是一种模式核细胞);11.1%位于线粒体;11.1%位于细胞骨架。推测其在细胞膜发挥作用的可能性最大,在内质网及细胞核中的可能性最小,猜测其对细胞的跨膜运输有一定影响。
2.4.4 黔北麻羊TGFβ2 蛋白信号肽预测 由图6 可知,TGFβ2 蛋白具有信号肽,为分泌蛋白,且序列的信号肽剪切位点在第20 号与第22 号氨基酸之间。成熟肽始于第24 位氨基酸。

图6 黔北麻羊TGFβ2 蛋白质磷酸化位点预测
2.4.5 黔北麻羊TGFβ2 蛋白氨基酸同源性分析以及系统进化树的构建 选取绵羊、牛、猪、马、褐家鼠、鸡、狗、黑猩猩及人9 个物种与黔北麻羊TGFβ2基因编码的氨基酸序列进行同源性分析,结果显示黔北麻羊TGFβ2编码氨基酸序列与绵羊、褐家鼠、黑猩猩、人、牛、猪、鸡、狗及马的同源性分别为99.8%、94.3%、98.2%、98.2%、93.2%、92.1%、83.5%、65.8%、66.1%(图7)。由此可见,黔北麻羊TGFβ2基因编码核苷酸序列除在狗和马中的相似性较低外,其余7 个物种与黔北麻羊的同源相似性均相对较高,绵羊与黔北麻羊的相似性最高,与狗的相似性最低。同时,采用MEGA6.0 软件构建不同物种TGFβ2基因编码氨基酸的系统发育进化树,证实黔北麻羊与绵羊的亲缘关系最近,与狗和马等非反刍动物的亲缘关系最远;对比的9 个物种亲缘关系依次为黔北麻羊>绵羊>牛>褐家鼠>猪>鸡>黑猩猩>人>狗>马(图8)。

图7 黔北麻羊TGFβ2 编码氨基酸序列同源性分析

图8 黔北麻羊TGFβ2 编码氨基酸序列遗传进化树
3 讨 论
转化生长因子β(TGFβ)超家族在胚胎发育、器官形成、维持内环境稳态等过程中起着重要的调节作用,尤其在卵巢形成和卵泡发育过程中扮演着不可替代的角色,既可通过TGFβ/smad 通路又可通过非smad 通路调节卵巢细胞增殖、分化、凋亡或激素合成[10]。同时以自分泌或旁分泌的方式刺激或抑制细胞的增殖和分化[11-13],该家族对动物生殖生理调控发挥着重要作用。本实验成功克隆了黔北麻羊TGFβ2基因编码序列并与NCBI 中GenBank 数据库中的登录序列进行比对后,发现黔北麻羊TGFβ2基因编码序列与山羊TGFβ2基因编码序列匹配度达到99.85%,而终止密码子的突变并未导致氨基酸的突变。信号肽位点预测发现黔北麻羊TGFβ2 蛋白具有信号肽,信号肽剪切位点在第21~23号氨基酸之间。经氨基酸同源性比较、系统发育进化树分析发现,黔北麻羊与绒山羊[14]TGFβ2基因CDS 区编码氨基酸序列与绵羊、牛等哺乳动物的同源性相对较高,在绵羊[15]中TGFβ2基因CDS 区编码氨基酸序列与山羊、牛等哺乳动物的同源性相对较高;说明TGFβ2基因CDS 区编码氨基酸序列中山羊、绵羊和牛彼此之间的同源性非常接近,均符合物种进化规律。理化性质、疏水性分析与亚细胞定位发现黔北麻羊TGFβ2 蛋白可能是一种位于细胞质基质(细胞质55.5%)的不稳定亲水性蛋白,而在绵羊[15]中TGFβ2 蛋白主要于细胞外基质中发挥其生理功能,可能存在种间差异。黔北麻羊TGFβ2 蛋白质高级结构主要由无规则卷曲与α-螺旋构成,这与绵羊[15]和二花脸猪[16]TGFβ2 蛋白均主要由α-螺旋和不规则卷曲组成的结果相一致。
本实验RT-qPCR 结果得出,TGFβ2基因mRNA 在各组织中均有不同程度的表达,这与TGFβ2基因在鹅[17]及二花脸猪[16]的卵巢及子宫织织中均有表达的结果相一致,但却与鹅在卵巢的表达丰度较高、子宫中的表达丰度较低的结果相反,或是不同物种之间存在的差异所导致。TGFβ2基因是具有多种功能的细胞生长因子,能调节形态发生[18]、发育、分化[19]等生命活动,如在大鼠的卵巢组织中,TGFβ2基因就发挥着重要功能,它能通过控制卵泡变性或生长(或两者)来影响卵泡的发育[20];在小鼠胚胎移植前,Jovanovic 等[21]使用外源激素过度刺激处理后,极大影响了TGFβ2基因在子宫中的表达,还可能破坏植入胚胎所建立的妊娠内环境,为防止子宫出现抵制外排胚胎的现象,TGFβ2基因可能在小鼠建立适宜妊娠环境中扮演着重要角色。Chabot等[22]发现TGFβ2基因在子宫液中第10~15 天表达逐渐递增,且在第15 天的表达显著高于第10 天,该基因在后备母猪及妊娠母猪子宫液中高表达,推测其可能有利于猪的子宫建立妊娠及维持妊娠;而本实验中TGFβ2基因在子宫组织的表达最高。综上所述,TGFβ2基因发挥的作用可能是维持母畜正常的妊娠环境而保障能有较高的活产仔数,通过在子宫中的最高表达来调控动物的繁殖性能。Hatzirodos 等[23]研究发现,TGFβ2基因在牛妊娠早期的表达很低,在妊娠中期增加,并在妊娠晚期保持在较高水平,说明该基因可能对维持牛胎儿的生长发育有一定影响。此外,在杂交长白种小母猪卵巢组织中发现TGFβ2基因在卵泡发育的大、中、小至卵泡成熟阶段均有表达,伴随着卵泡的阶段性生长,各级卵泡中TGFβ2基因表达均增加且达到了差异极显著性水平[24],说明该基因作用于卵巢并有助于卵泡细胞的生长和分化。本研究发现,TGFβ2基因在黔北麻羊卵巢组织较高表达,TGFβ2基因可能作用于黔北麻羊卵巢并一定程度上有助于提高其繁殖性能。总之,TGFβ2基因可能作用于黔北麻羊子宫及卵巢组织,通过组织中的较高表达来影响其繁殖性状,具体调控机制仍待进一步探究。
4 结 论
本研究成功克隆出黔北麻羊TGFβ2基因的CDS 区序列,通过RT-qPCR 技术检测了TGFβ2基因在黔北麻羊性腺组织中的差异表达情况,其表达量依次为子宫>卵巢>垂体>下丘脑>输卵管;生物信息学分析显示,TGFβ2 蛋白位于细胞质基质,是一种具有信号肽位点的相对不稳定的亲水性分泌蛋白,其高级结构主要由α-螺旋与无规则卷曲构成。本研究结果为进一步探究TGFβ2基因对黔北麻羊繁殖性能的调控机制提供了基础。
