椰子水多糖的结构和体外生物学活性分析
2021-10-20张玉锋郭玉如温远芬宋菲张有林
张玉锋 ,郭玉如,温远芬,宋菲,张有林*
1. 中国热带农业科学院椰子研究所,国家重要热带作物工程技术中心(椰子研发部),海南省椰子深加工工程技术研究中心(文昌 571339);2. 陕西师范大学食品工程与营养科学学院(西安 710119);3. 山西师范大学食品科学学院(临汾 041004)
椰子(Cocos nuciferaL.)因其在食品、能源、化工、建材等领域的广泛应用,被热区人民称为“生命之树”[1]。尤其是近来年,随着椰子及其产品在预防和治疗帕金森氏症、心血管疾病、糖尿病和高血压等疾病方面研究报道的增多[2],世界范围内的椰子产品需求也逐年增长。这也就意味着越来越多的副产物,如椰子水、椰壳、椰蓉的大量产生。据不完全统计,海南省作为我国椰子主产区,年加工椰子超25亿个,椰子水年产量超62.5万 t[3]。这些椰子水除了少量用于发酵“纳塔”外,大部分被丢弃到土壤或海洋中,不仅浪费资源,也存在很大的环境污染风险。
研究表明,椰子水富含糖、维生素和矿物质,营养价值较高,是一种天然电解质饮料[4-5]。同时,椰子水还被证实具有降血压、降血脂、心脏保护、降血糖和肝保护等功效[6-7],但是关于椰子水发挥功效的具体物质基础尚不清楚。此外,植物多糖因来源广泛、活性突出等特点成为近年来食品和医药领域的研究热点[8-10]。关于椰子水多糖结构及功能活性相关的研究尚未见诸报道。因此,试验以椰子水为原料,提取制备多糖,分析其结构特征,并评价其体外生物学活性,为椰子水在功能性食品和新药资源领域的高值化利用提供数据支持,促进海南椰子产业发展。
1 材料与方法
1.1 材料与设备
新鲜成熟椰子水(文昌东郊椰子加工厂);岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、果糖、半乳糖醛酸(均为色谱级,纯度>98%,美国Sigma公司);DMEM高糖培养基(含10% FBS、1%青链霉素)、二甲双胍、胰蛋白酶、葡萄糖测定试剂盒(北京索莱宝生物科技有限公司);过氧化氢、碳酸钠、三氯乙酸、无水乙醇、硫酸、1, 1-二苯基-2-三硝基苯肼(DPPH)等(均为分析纯)。
UV-1600型紫外可见分光光度计[翱艺仪器(上海)有限公司];DAWN HELEOS-II 18角度激光光散射仪(美国怀雅特公司);Nicolet 67傅里叶红外光谱仪(美国赛默飞世尔公司);ICS-3000离子色谱仪(美国戴安公司)。
1.2 试验方法
1.2.1 椰子水多糖的制备
采集后2 h内的新鲜椰子水用4层纱布过滤,滤液在4 000 r/min离心10 min除杂,上清液于45 ℃真空浓缩至原体积的1/10;向浓缩液中加入等体积5%三氯乙酸溶液,于4 ℃静置24 h;按4 000 r/min离心20 min取上清液,加入4倍体积的95%乙醇于4 ℃沉淀24 h;按4 000 r/min离心15 min取沉淀真空冷冻干燥,得到椰子水多糖,密封于-20 ℃保存,备用。
1.2.2 椰子水多糖的化学组成分析
椰子水多糖的主要化学成分包括中性糖、糖醛酸、蛋白质和总酚,它们的含量分别用蒽酮-硫酸法[11]、咔唑-硫酸法[12]、考马斯亮蓝法[13]和福林酚法[11]测定,分别以葡萄糖、半乳糖醛酸、牛血清蛋白和没食子酸(GAE)为对照做标准曲线。
1.2.3 椰子水多糖的单糖组成
取10 mg样品于水解管中,加入4.0 mL 4 mol/L三氟乙酸,充氮1 min排出管内空气,旋紧螺旋盖,于120 ℃水解2 h,待冷却后氮气吹干水解液,除去过量的三氟乙酸,加超纯水定容至10 mL。稀释20倍后用0.2 μm滤膜过滤后,取20 μL滤液分析单糖组成。
色谱条件:流动相A为水,流动相B为250.0 mmol/L氢氧化钠,流动相C为1.0 mol/L乙酸钠;流速0.5 mL/min;进样体积10 μL;柱温35 ℃。
洗脱条件:0~20 min,94% A和6% B;20~20.1 min,89% A,6% B和5% C;20.1~35 min,74% A,6% B和20% C;35.1~45 min,20% A和80% B;45.1~55 min,94% A和6% B。
1.2.4 椰子水多糖的相对分子质量测定
配制1 mg/mL的样品溶液,过0.22 μm滤膜后,用测定多糖的相对分子质量。
色谱条件:流动相0.1 mol/L氯化钠,流速0.5 mL/min,上样量200 μL,柱温25 ℃。
1.2.5 傅里叶红外光谱(FIIR)分析
将样品粉末与KBr混匀,压成薄片,波数范围为4 000~400 cm−1。
1.2.6 椰子水多糖的体外抗氧化活性测定
DPPH、ABTS和羟自由基清除能力分别参考李春阳等[14]、Re[15]和莫开菊等[16]的方法测定,以抗坏血酸(VC)为阳性对照。亚铁离子螯合能力参考Torresfuentes等[17]的方法测定,并以乙二胺四乙酸二钠(EDTA-2Na)为阳性对照。
1.2.7 椰子水多糖对HepG2细胞活力及葡萄糖消耗的影响
参考王梦雅等[18]的方法测定,并稍作修改。复苏后的HepG2细胞用含有5%胎牛血清的DMEM高糖培养基于37 ℃、5%的CO2培养箱培养,每隔3 d用0.25%胰酶消化传代。传代3次后取对数生长期细胞进行试验。
1.2.7.1 细胞活力抑制率测定
取对数期细胞于96孔板,调整细胞密度为1×105个/孔,设置终浓度2,20和50 μg/mL的多糖样品组、不加样品的正常对照组和二甲双胍组(终浓度1×10-6moL/L,约0.17 μg/mL),于37 ℃、5%的CO2培养箱培养24 h。弃上清液,每孔加入20 μL质量浓度5 mg/mL的MTT溶液,于培养箱中继续培养4 h。弃上清液,每孔加入150 μL二甲基亚砜(DMSO),用枪头吹吸均匀,15 min后测定570 nm处的吸光度。

1.2.7.2 葡萄糖消耗试验
取对数期细胞于96孔板,调整细胞密度为1×105个/孔,设置浓度2,20和50 μg/mL的多糖样品组;不加样品的DEME培养液为正常对照组;二甲双胍组(终浓度1×10-6moL/L,约0.17 μg/mL)为阳性对照组。在37 ℃、5%的CO2培养箱培养24 h后,按试剂盒说明书测定上清液中的葡萄糖含量。

1.3 数据分析
数据分析和图表制作采用Office 2007和Origin 8.5软件,部分数据以“平均值±标准偏差”表示。
2 结果与分析
2.1 椰子水多糖的化学组成
化学成分结果显示,椰子水多糖的中性糖含量达66.43%±1.78%,蛋白质仅0.31%,说明多糖是提取样品的最主要成分。糖醛酸含量为21.50%±0.75%,略低于枇杷叶多糖(糖醛酸含量28.82%~39.09%),表明椰子水多糖中也可能存在果胶样酸性多糖[19]。另外,经过除蛋白、乙醇沉淀和冷冻干燥等过程后,多糖中还结合有部分酚类物质(4.61 mg GAE/g),说明椰子水多糖中可能存在少量的多糖-多酚共轭物[19]。

表1 椰子水多糖的化学组成
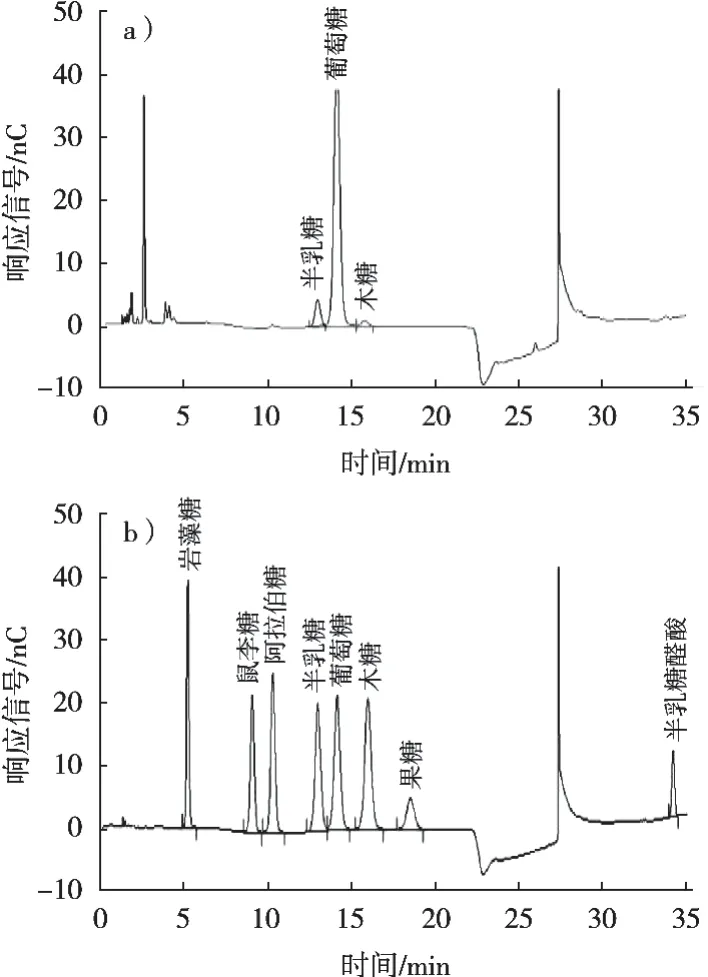
图1 椰子水多糖的单糖组成色谱图
进一步利用离子色谱仪分析单糖组成后发现,椰子水多糖是一种杂多糖,主要由半乳糖、葡萄糖和木糖3种单糖组成,摩尔比为1.00∶10.30∶0.27。其中,葡萄糖为最主要单糖,1 mg/mL多糖水解液中的含量达194.40 μg/mL,其次为半乳糖(18.88 μg/mL)和阿拉伯糖(4.28 μg/mL)。未鉴定出半乳糖醛酸,推测椰子水多糖中可能含有其他糖醛酸组分,但仍需进一步验证。
2.2 椰子水多糖的相对分子质量
高效凝胶渗透色谱显示,椰子水多糖相对分子质量分布集中在主峰3(光散射检测器下为2个色谱峰、示差信号中未完全分开)。但光散射信号显示椰子水多糖由3个洗脱峰组成,而峰1和峰2在示差检测器中几乎检测不出,可能为含量极少的高分子量聚集体[20](图2)。因此,为探究多糖与活性的构效关系,可分离纯化多糖纯品。
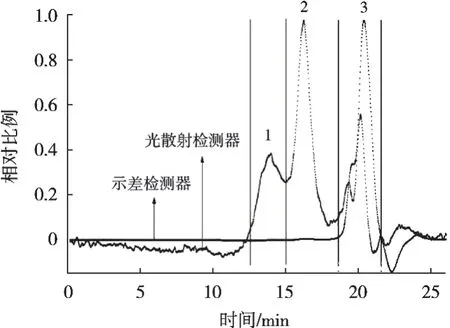
图2 椰子水多糖的高效凝胶渗透色谱图
利用ASTRA5.3.4软件计算椰子水多糖洗脱峰3的参数,如表2所示,重均分子质量(MW)和数均分子质量(Mn)分别为1.96×103g/moL和5.32×102g/moL,表明椰子水多糖为小分子聚合物。就多分散系数(Mw/Mn)来讲,Mw/Mn值等于1时说明其相对分子质量分布均匀;比值越大,则相对分子质量分布越宽[21]。也即椰子水多糖的相对分子质量分布较宽(Mw/Mn=3.68),这与高效凝胶渗透色谱中光散射检测器的测定结果相吻合。

表2 椰子水多糖的分子参数
2.3 椰子水多糖的红外光谱分析
红外光谱显示,椰子水多糖在3 200~3 400,2 800~3 000,1 400~1 600和800~1 200 cm-1有特征吸收峰。其中,3 288.52 cm-1代表O—H伸缩振动,2 898.91 cm-1代表C—H伸缩振动,而这2处吸收峰多为酸性多糖的特征吸收[22];1 396.41 cm-1处的弱吸收进一步证明羰基的存在[23],这与多糖中含有糖醛酸的结果相吻合。1 577.72 cm-1代表N—H的弯曲振动和[22],说明多糖中含有蛋白质组分。1 000~1 200 cm-1的强吸收,说明有吡喃糖的存在,尤其是921.94 cm-1处可归纳为β-吡喃结构,829.36 cm-1则表示α-糖苷键的连接方式[24]。

图3 椰子水多糖的红外光谱
2.4 椰子水多糖的体外抗氧化活性
DPPH自由基是为数不多的稳定自由基之一,可直接反映抗氧化剂的供氢能力[25]。由图4可知,椰子水多糖对DPPH清除能力在低浓度范围(0~0.25 mg/mL)内随浓度增加而增大,0.25 mg/mL时的清除率达67.72%,与5 μg/mL时VC的清除效果相当(72.70%);但继续增加多糖浓度(0.25~0.5 mg/mL),其清除能力则无明显增加趋势,可能是椰子水多糖中供氢基团含量较低的缘故。
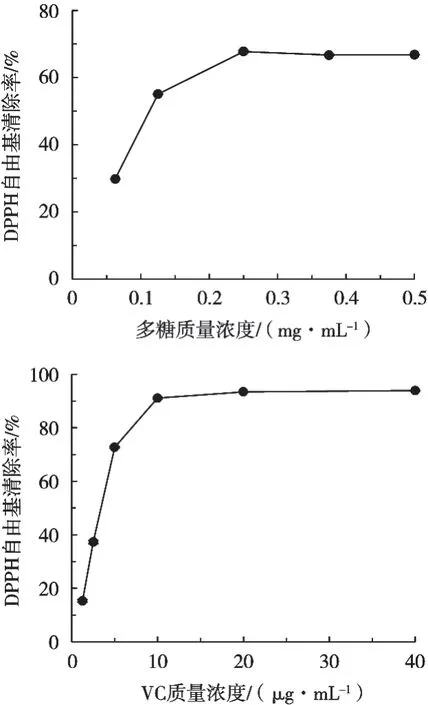
图4 椰子水多糖和维生素C对DPPH自由基的清除活性
羟自由基是已知的生物体内活性和毒性最强的活性氧之一,它可以攻击脂类、蛋白质和核酸等几乎所有的生物大分子,诱发氧化损伤[24-25]。椰子水多糖对羟自由基的清除能力呈剂量效应,7.5 mg/mL时清除率达95.13%(图5),略优于Xu等[24]制备的黑醋栗多糖(对羟自由基的半清除浓度IC50为1.16 mg/mL),但仍弱于阳性对照VC(0.35 mg/mL时清除率达99.45%)。

图5 椰子水多糖和维生素C对羟自由基的清除活性
椰子水多糖和VC对ABTS自由基的清除能力均呈线性关系(图6),拟合优度(R2)均大于0.99。进一步计算可得到椰子水多糖对ABTS自由基清除的IC50为2.10 mg/mL,显著低于VC(IC50为13.89 μg/mL)(p<0.05),但高于Liu等[26]通过冷冻和热风干燥制备的香菇酸性多糖(IC50分别为3.66 mg/mL和3.18 mg/mL)。这可能与椰子水多糖中含有较高的糖醛酸或多酚类物质有关[27]。
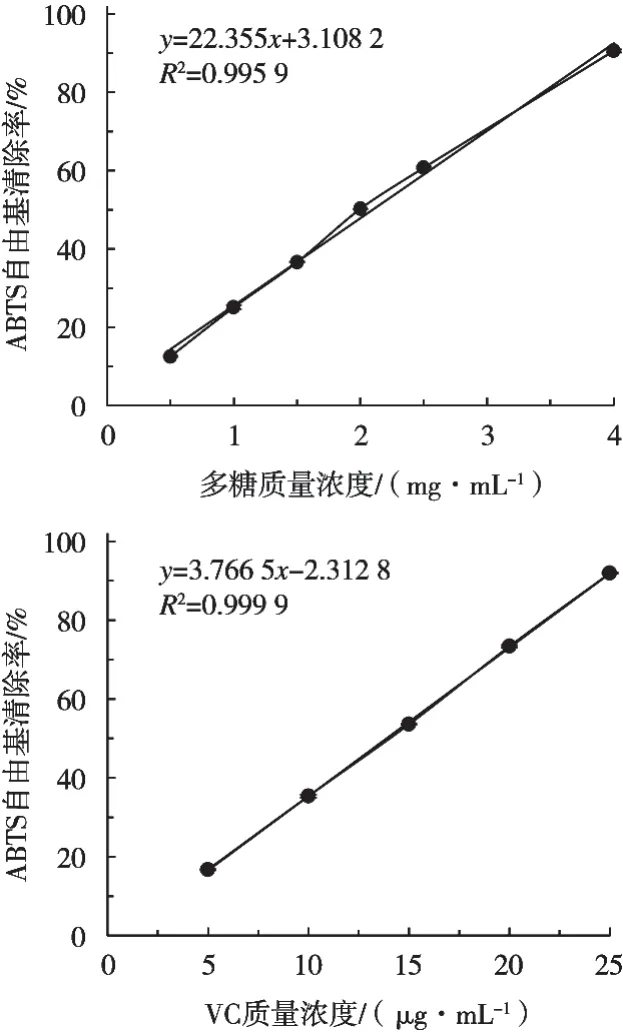
图6 椰子水多糖和维生素C对ABTS自由基的清除活性
亚铁离子参与生物体内的多个氧化还原反应,如催化H2O2通过哈珀-维斯(Haber Weiss)反应生成毒性更强的羟自由基,进一步导致机体损伤。因此,螯合金属离子也是反映物质抗氧化能力的指标之一。椰子水多糖对亚铁离子的螯合能力在测试浓度范围内大致呈对数函数关系(R2=0.950 3),10 mg/mL时螯合率达89.74%。EDTA的螯合能力则表现为幂函数关系(R2=0.950 4),0.04 mg/mL时螯合率达94.93%。

图7 椰子水多糖和EDTA对亚铁离子的螯合能力
2.5 椰子水多糖对HepG2细胞活力及葡萄糖消耗的影响

图8 椰子水多糖对HepG2葡萄糖消耗能力的影响
糖尿病作为一种慢性多发性疾病成为全球关注的公共卫生问题,寻求安全高效的降糖资源成为食品和医药界的研究热点之一。为探究椰子水多糖的降糖潜力,探究其对正常HepG2细胞活力和葡萄糖消耗作用的影响。结果发现,在测试浓度(2,20和50 μg/mL)下,椰子水多糖对HepG2细胞活力均无抑制作用(结果未显示);并具有微弱的葡萄糖吸收促进作用,20 μg/mL时消耗率增加4.81%,低于0.17 μg/mL二甲双胍的促吸收效果。
3 结论
试验以椰子加工副产物为原料,制备椰子水多糖,并探究其化学组成、结构特征、体外抗氧化以及其对HepG2细胞活力和葡萄糖消耗率的影响。结果表明,椰子水多糖中含有大量的糖醛酸(21.50%),是一种含有β-吡喃环结构的酸性杂多糖。多糖分子的重均分子质量为1.96×103g/moL,含有葡萄糖、半乳糖和木糖3种单糖。该多糖具有一定的体外抗氧化活性,0.25 mg/mL时其对DPPH自由基的清除率达67.72%;2.5 mg/mL时其对ABTS和羟自由基的清除率分别为60.72%和61.38%。椰子水多糖还能螯合亚铁离子,5 mg/mL时的螯合率达71.37%。对HepG2消耗葡萄糖也有些许促进作用,20 μg/mL时消耗率增加4.81%。研究结果为椰子水的深加工利用提供思路和借鉴。
