冷鲜猪肉贮藏过程中细菌群落结构演替规律分析
2021-10-19王新惠孙劲松潘攀刘力嘉
王新惠,孙劲松,赵 芮,潘攀,丁 悦,刘力嘉,刘 洋
(成都大学 肉类加工四川省重点实验室 成都610106)
我国是世界最大的猪肉生产国和消费国[1],主要是以热鲜肉销售为主,冷鲜肉和其它肉制品为辅的销售模式,而在欧美和其他发达国家和地区,90%以上的猪肉均以冷鲜肉的形式出售。随着经济发展和人们对生活品质的提高,冷鲜肉将迎来巨大的市场潜力[2]。
由于冷鲜肉相较于冷冻肉的贮藏温度高,细菌易滋生,因此极易腐败变质。家庭常用保鲜袋保存冷鲜猪肉的保质期一般不超过5 d[3],而市售猪肉一般未经包装直接置于冷柜中,保质期可能更短。研究表明微生物是造成冷鲜肉腐败的主要原因,并且引起不同动物肉腐败的微生物可能不同,如假单胞菌属(Pseudomonasspp.)和肠杆菌科细菌等在腐败的冷藏禽类中较常见[4]。Mills 等[5]在腐败的羊羔肉中发现大量的腐败希瓦菌(Shewanella putrefaciens)、热死环丝菌(Brochothrix thermosphacta)和梭菌属(Clostridiumspp.)等。对于猪肉,不同部位的腐败猪肉样品中的菌落组成大致相同,而不同菌属之间增长趋势不尽相同,此外,热死环丝菌属在不同的样本中含量差异较大[6]。此前对微生物进行检测,研究微生物的主要方法有传统分离培养法、变性、温度梯度凝胶电泳(DGGE/TGGE)等[7]。这些方法存在各种局限性,如传统方法无法分离、培养样品中所有的微生物,而变性、温度梯度凝胶电泳的分辨率较低等[8]。如今出现的高通量测序技术(或称第2 代测序技术)是一种高效,结果可靠的分析方法,并已广泛应用于环境、医学和食品等各种领域[9-10]。目前对冷鲜肉腐败过程中细菌的群落演替规律,以及腐败微生物与腐败物质之间的相关性未有深入的研究,其中冷鲜肉的腐败问题是近几年的研究热点。
本研究采用16S rDNA 高通量测序方法,以非密封包装的冷鲜肉为研究对象,对冷鲜肉腐败过程中的细菌进行测序分析,以期锚定特定腐败菌,分析腐败菌与表征腐败的指标之间的相关性,探究冷鲜肉腐败过程中细菌群落结构的演替过程。以期为冷鲜肉的微生物腐败机理研究和保鲜技术的开发提供理论依据。
1 材料与方法
1.1 材料的准备
猪肉购自成都市十陵镇久贸综合市场。采购当天屠宰的猪腹部的五花肉,将其切成大小相近肥瘦相间的肉片,置于4 ℃冰箱贮藏。每日取样1次,用液氮瞬间冷冻后,置于超低温冰箱-85 ℃保存,共取样10 次样品编号D1 至D10 待测,每次取3 个重复样品,结果取平均。
1.2 主要试剂和仪器
容声冰箱BCD-221WD16NP;超低温冰箱AP-60-395LA,艾普仪器设备有限公司;DNA 提取试剂盒E.Z.N.ATM Mag -bind Soil,美国OMEGA 公司;Applied BiosystemsRGene AmpRPCR System 9700 型PCR 仪,卓越联合生物科技有限公司;乙醇、液氮,新金山化工有限公司;Testo 205 型肉类pH 计,维欣仪奥科技发展有限公司。
1.3 TVB-N 和pH 值的测定
根据食品安全国家标准GB 5009.228-2016中挥发性盐基氮(TVB-N)的测定方法,测定猪肉中挥发性盐基氮含量,每个时间点测3 次作为重复。猪肉的pH 值由肉类pH 计直接测定,每个样品测3 个不同位点作为重复。
1.4 DNA 的提取和PCR 扩增及测序
参考Wang 等[11]的方法,使用E.Z.N.ATM Mag-bind Soil 试剂盒提取总DNA 后,然后使用0.8%琼脂糖凝胶电泳检验DNA 的浓度。细菌16S rDNA V4 区域扩增引物:515F(5’-GT GYCAGCMGCCGCGGTAA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)[12]。PCR 扩增体系:每一个25 μL 的体系包括1×PCR buffer 2.5 μL、1.5 mmol/L MgCl22.5μL、0.4 μmol/L dNTPs 14.75 μL、正向和反向引物各1.5 μL,0.25 μL KODPlus-Neo 酶(TOYOBO)和2 μL 模板。PCR 程序包括起始94 ℃1 min,然后30 个循环(变性94 ℃20 s,退火54 ℃30 s 和延伸72 ℃30 s),最后72℃5 min。每个样本进行3 个PCR 技术重复。PCR产物与1/6 体积的6×Loading buffer 混合,使用2%琼脂糖凝胶电泳检测。PCR 产物经过纯化和定量后,使用Hiseq 2500 平台PE250 模式测序及生物信息学分析。
1.5 数据的处理
将序列进行处理得到有效数据Clean Reads后,以Usearch 软件为基础,利用UPARSE 算法在97%的一致性水平上进行OTU 聚类[13],利用UCLUST 分类法和SILVA 数据库进行注释分析[14]。使用R 语言中Vegan 包计算Alpha 指数[15],进行Alpha 多样性分析。其中,Chao1 和ACE 指数表征细菌菌群的丰富度,值越大表示丰度越高。Shannon 和Simpson 指数用来表征细菌的多样性,Shannon 指数越高代表多样性越高。在本研究中Simpson 表示“1-Simpson's index”,其值与细菌多样性呈正相关;Coverage 表示细菌群落的覆盖率,其值越接近1 说明样本中测序深度的覆盖率越好。群落组成分析使用R 语言进行各种数据转换,使用ggplot2 包作图[16]。
2 结果和讨论
2.1 贮藏过程中腐败指标变化
对贮藏过程中的冷鲜肉的挥发性盐基氮含量和pH 值进行测定,结果如表1所示。可以从表1中看出,冷鲜肉的挥发性盐基氮含量随着贮藏时间的增加而增加,但是贮藏的第8 天时,冷鲜肉的挥发性盐基氮含量有所下降,可能是因为易产生挥发性盐基氮的细菌如假单胞菌属的含量减小所致。挥发性盐基氮是评价肉类新鲜度的重要指标[17],是微生物和内源酶作用于肉中,从而导致蛋白质分解产生氨和胺类等产物[18],根据GB 2707-2016 国家限量标准规定新鲜肉挥发性盐基氮含量≤15 mg/100 g,可以从下表中看出,在贮藏的第4 天时,冷鲜肉中挥发性盐基氮的含量已超过了国家标准。
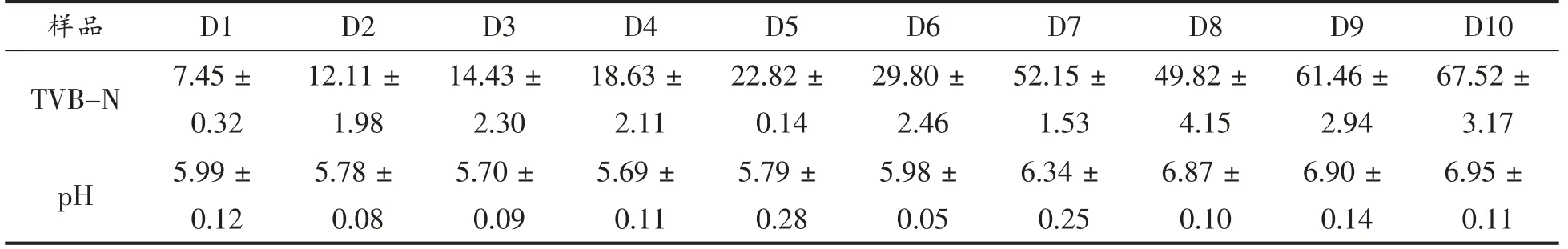
表1 样品的pH 值和TVB-N 含量Table 1 pH value and TVB-N content of samples
贮藏过程中,冷鲜肉的pH 值随着时间先降低后增加,在贮藏的第4 天时,冷鲜肉的pH 值降到最低值5.69。冷鲜肉的pH 值下降主要源于被屠宰后的肌肉糖酵解产生乳酸和微生物酸性代谢产物的积累[19],使猪肉中酸性物质含量增加所致。而Greaser 等[20]发现pH 值下降的速率和糖酵解酶相关,而在低温的环境下,酶活下降。在第5 天后,冷鲜肉中蛋白质水解酶分解了细胞骨架蛋白和结构蛋白,导致产生游离氨基酸,从而使冷鲜肉的pH 值上升。
2.2 Alpha 多样性分析
冷鲜肉贮藏过程中细菌丰度指数Chao 1 指数和ACE 指数如表2所示,可以从表中看出,细菌丰度指数随着时间呈现“三级台阶” 的减小趋势。第1 阶段是在贮藏的前3 天(D1~D3),在这阶段,冷鲜肉中细菌丰度有所上升,并且在D3 时,细菌的丰度达到最大值,Chao 1 指数和ACE 指数分别为1 605.84 和1 644.84;第2 阶段在贮藏的D4~D6 天,细菌的丰度较第一阶段有所下降;第3阶段是在贮藏的D7~D10 天,最后阶段时,细菌的丰度最低,在贮藏的第10 天时,冷鲜肉中的细菌菌群丰度达到最低。可见,冷鲜肉贮藏过程中,细菌菌群的丰度随时间的增加而减小,主要是因为贮藏环境的温度过低,抑制了大部分细菌的生长代谢,使增殖受到抑制。
对冷鲜肉贮藏过程中细菌菌群多样性进行分析,从表2 中可以看出,多样性指数Shannon 指数和Simpson 指数的变化和细菌菌群丰度指数的变化相似,也分为3 个阶段。在贮藏的第3 天时,细菌菌群多样性指数达到最大值,Shannon 指数和Simpson 指数分别为5.41 和0.98。
从表2 中可以看出,冷鲜肉中的细菌菌群的多样性和丰度整体趋势均随贮藏时间的增加而降低,主要原因是大量微生物无法适应环境从而生长受到抑制。Alpha 指数的波动情况可以反映猪肉在贮藏过程中细菌群落的丰度和多样性并不是简单递增或递减,而是一个不断变化的过程。
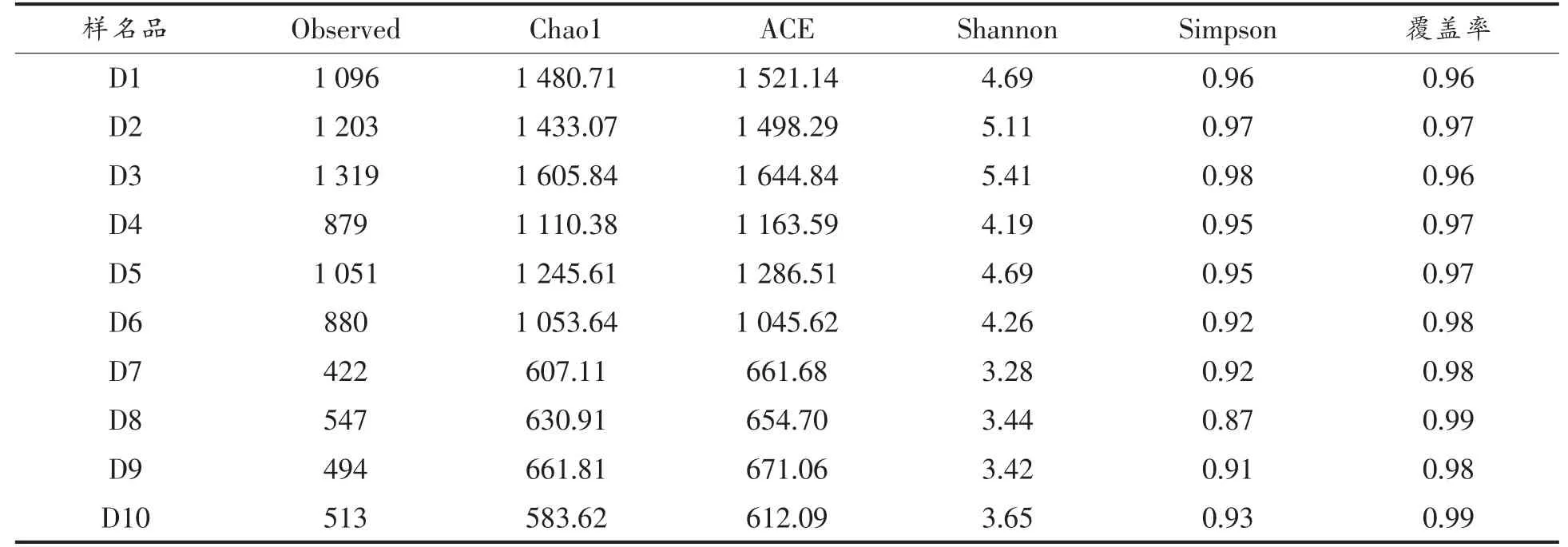
表2 样品的Alpha 多样性指数Table 2 Alpha diversity index of samples
2.3 细菌的群落结构分析
2.3.1 门水平上的细菌群落结构分析 对所有样本进行16S rDNA 测序,共鉴定出门、纲、目、科、属、种共6 个水平的细菌群落结构,本研究主要从门、目和属的水平分析细菌群落结构,共检测出37 个门,181 个目,575 个属。
如图1所示,在门水平上对冷鲜肉贮藏过程中细菌群落结构变化进行分析,主要有变形菌门(Proteobacteria),厚壁菌门(Firmicutes),拟杆菌门(Bacteroidetes),酸杆菌门(Acidobacteria),放线菌门(Actinobacteria)。其中变形菌门在冷鲜肉贮藏过程中属于优势菌门,它在整个贮藏期的平均相对丰度占比为72.17%,在D7 占比达到最大值为93.12%。其次,厚壁菌门在冷鲜肉贮藏过程中也有较大占比,在D5、D6 和D8 中厚壁菌门的占比分别达到了25.97%,27.14%和40.28%。此外,拟杆菌门在贮藏期前3 天的占比较大,占比分别为8.31%,12.67%,15.26%,随后逐渐减少,在贮藏第10 天时占比为1.70%。
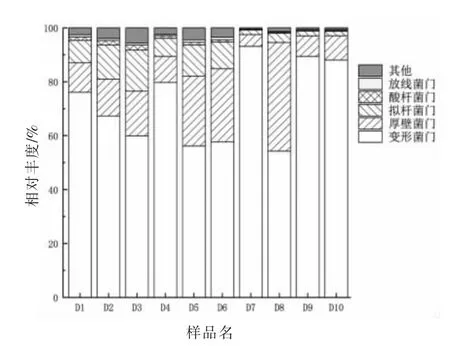
图1 门水平上的细菌群落结构Fig.1 The bacterial community structure at phylum level
就整个贮藏期而言,冷鲜肉中细菌群落结构变化情况较为复杂。在贮藏前3 天,变形菌门占比减少,而厚壁菌门和拟杆菌门占比增多。第4天变形菌门突然增多,其它细菌含量相对减少,直到第7 天拟杆菌门基本被抑制。而厚壁菌门在样本中占比在D8 中出现一次较大的“反弹”,随后在贮藏的最后2 天被变形菌门抑制。除这3 种菌门之外,其它菌门各自的平均占比不足1%。
2.3.2 目水平上的细菌群落结构分析 样本中细菌在目水平上的群落结构如图2所示,在贮藏过程中,假单胞菌目(Pseudomonadales)的平均相对丰度最高,丰度均值达40.19%,在D7 时在样本中占比最高为59.47%,在D8 时在样本中占比最低为22.82%。其次是肠杆菌目(Enterobacteriales),丰度均值为28.44%,最低为4.65%(样品D6),最高为61.06%(样品D9)。其它平均相对丰度超过1%的菌目及其平均丰度分别是芽孢杆菌目(Bacillales)8.58%,梭菌目(Clostridiales)5.85%,拟杆菌目(Bacteroidales)4.92%,鞘氨醇菌目(Chitinophagales)1.97%,乳杆菌目(Lactobacillales)1.84%,β-变形菌目(Betaproteobacteriales)1.04%。
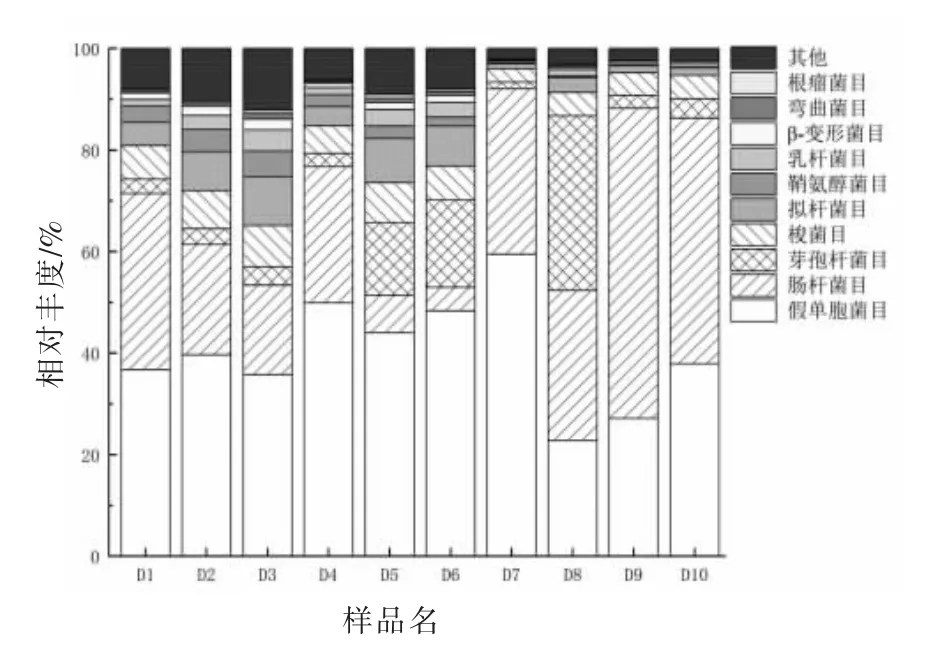
图2 目水平上的细菌群落结构Fig.2 The bacterial community structure at order level
假单胞菌目作为优势菌目,相对丰度在贮藏期间整体趋势为先增加,后减少;其次是肠杆菌目,在贮藏前期和后期的样本中丰度较高,而在贮藏中期的样本中(D5、D6)丰度较少;此外芽孢杆菌目大量存在于贮藏中、后期的样品中,如:D5、D6 和D8。
2.3.3 属水平上的细菌群落结构分析 如图3所示,在属水平上对细菌菌群进行分析,各个样品中平均相对丰度前10 的菌属和它们的平均相对丰度分别是:假单胞菌属(Pseudomonasspp.)24.77%、不动杆菌属(Acinetobacterspp.)12.09%、泛菌属(Pantoeaspp.)11.56%、环丝菌属(Brochothrixspp.)7.59%、拉乌尔菌属(Raoultellaspp.)7.53%、沙雷氏菌属(Serratiaspp.)3.89%、嗜冷杆菌属(Psychrobacterspp.)3.31%、肠杆菌属(Enterobacterspp.)2.31%、乳杆菌属(Lactobacillusspp.)1.66%和柠檬酸杆菌属(Citrobacterspp.)1.45%,这10 种菌属丰度之和占所有被检测菌属丰度的62.63%(D3)到92.10%(D7)。假单胞菌属、不动杆菌属、泛菌属是整个贮藏过程中样品中丰度较高的3 种菌属。在贮藏过程中,假单胞菌属是优势菌属,其丰度在前期和后期都维持在25%左右,但在第4 天和第7 天出现较大的增加,并且在第7 天达到最大占比44.43%。不动杆菌属在贮藏中期的样本中(如D5、D6)含量较多,但在其它时间段,在细菌中占比较少。泛菌属在贮藏中期(样本D5、D5)含量较少,但是在贮藏初期和贮藏最后2 d 的含量较多。假单胞菌属被认为是食品中最常见的与腐败相关的菌属,它在肉类、水果甚至饮料中均大量存在[21]。不动杆菌属中大部分细菌为致病菌,是食品致病菌中常见的菌属之一,在动物类食品中经常被发现[22-23]。有研究表明泛菌属主要分布在土壤,人类的血液甚至粪便中[24],研究学者发现在被污染和变质的猪肉中也被检测出有大量泛菌属细菌。
就整个贮藏过程而言,前3 天主要的细菌菌属为假单胞菌属和泛菌属,其间假单胞菌属含量较稳定,泛菌属的含量在逐渐减少。贮藏的第5 至6 天,优势菌属变成了不动杆菌属,其次为假单胞菌属和环丝菌属。在贮藏的最后2 d,主要优势菌衍变成了假单胞菌属、泛菌属和拉乌尔菌属。
2.4 属水平上的细菌丰度相关性分析
冷鲜肉贮藏过程中细菌受到各种外部因素和内部因素共同影响,以至于出现波动变化的情况,但细菌间的相对变化存在着相关性。通过细菌间丰度的相关性分析,可以更好地发现其变化的规律。在属水平上基于细菌丰度变化的相关性分析如表3所示:假单胞菌属与肠杆菌属存在强相关性(r=0.92),与沙雷氏菌属存在较强的相关性(r=0.79);不动杆菌属与泛菌属(r=-0.68)、拉乌尔菌属(r=-0.68)、沙雷氏菌属(r=-0.66)和柠檬酸杆菌属(r=-0.63)存在负相关性;泛菌属的丰度与拉乌尔菌属(r=0.99)和柠檬酸杆菌属(r=0.98)存在强相关性,和乳杆菌属存在负相关性(r=-0.69);环丝菌属与其它菌属的相关性较弱;拉乌尔菌属与柠檬酸杆菌属具有强相关性(r=0.99),与乳杆菌属(r=-0.76)和嗜冷杆菌属(r=-0.76)呈负相关;沙雷氏菌属与乳杆菌属(r=-0.63)呈负相关;嗜冷杆菌属与柠檬酸杆菌属呈负相关(r=-0.74);乳杆菌属与柠檬酸杆菌属呈负相关(r=-0.72)。
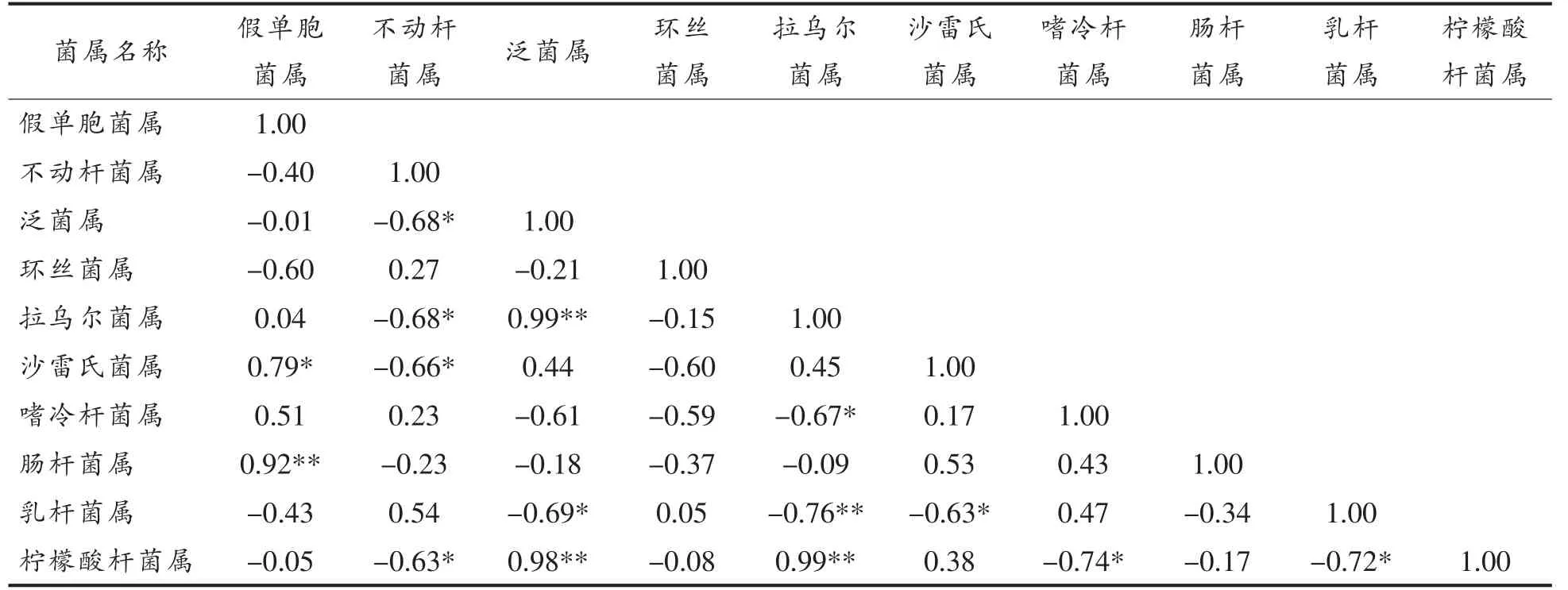
表3 各菌属间丰度的相关性Table 3 The correlation of abundance at genus level
由相关性可以推断腐败的优势菌属之间的变化情况,腐败过程的主要优势菌属假单胞菌属与肠杆菌属、沙雷氏菌属的丰度变化情况相似;不动杆菌属与泛菌属、拉乌尔菌属、沙雷氏菌属和柠檬酸杆菌属丰度变化情况相反;泛菌属和拉乌尔菌属、柠檬酸杆菌属的变化情况相似。各菌属之间存在着较复杂的相关性,在整个细菌群落的动态变化过程中,正相关的菌属可能对环境的竞争力相似,两种菌之间可能存在互生关系,如假单胞菌属与肠杆菌属;负相关的菌属之间可能存在着竞争关系,如不动杆菌属与泛菌属。
2.5 细菌丰度与理化性质之间的相关性
高通量测序技术不能直接实现微生物绝对定量(Absolute abundance)的分析,但是我们可以利用相对丰度反映某种细菌在样品环境中的优势程度[25]。如表4所示,通过分析平均相对丰度前10的菌属和pH 值与挥发性盐基氮含量的相关性,发现泛菌属,拉乌尔菌属和柠檬酸杆菌属的丰度与pH 值呈较强的相关性,乳杆菌属与pH 值具有较强的负相关性;拉乌尔菌属和柠檬酸杆菌属与TVB-N 含量具有较强相关性,乳杆菌属与TVB-N含量具有较强的负相关性,说明拉乌尔菌属和柠檬酸杆菌属可能与TVB-N 的产生有较大的关系。泛菌属、拉乌尔菌属和柠檬酸杆菌属与pH 值相关性高,说明这些菌属对蛋白质的分解和碱性物质的生成可能存在较大的关联。含量较高的菌属尤其是假单胞菌属的相对丰度与pH 值、TVB-N含量的相关性不强。但在一些研究中存在不同的结论,王真真等[26]利用分离培养的方式测定猪肉腐败过程中微生物数量的变化,分析微生物指标与腐败指标的相关性,发现腐败微生物数量和TVB-N、pH 值以及几种生物胺含量之间存在强相关性。这样的差异是由于本研究是讨论猪肉样品中细菌的相对丰度与腐败指标变化情况的相关性,以样品中全部细菌为研究对象,探究在腐败过程中细菌群落的演替规律。假单胞菌属和不动杆菌属的相对丰度与腐败指标不存在相关性,说明腐败物质的含量不是单独由某种或某几种丰度较高的细菌决定的,如肖香[27]的研究中指出中间耶尔森菌(Yersinia intermedia)、清酒乳杆菌(Lactobacillus sakei)、屎肠球菌(Enterococcus faecium)等细菌都具有较强的蛋白质分解能力。
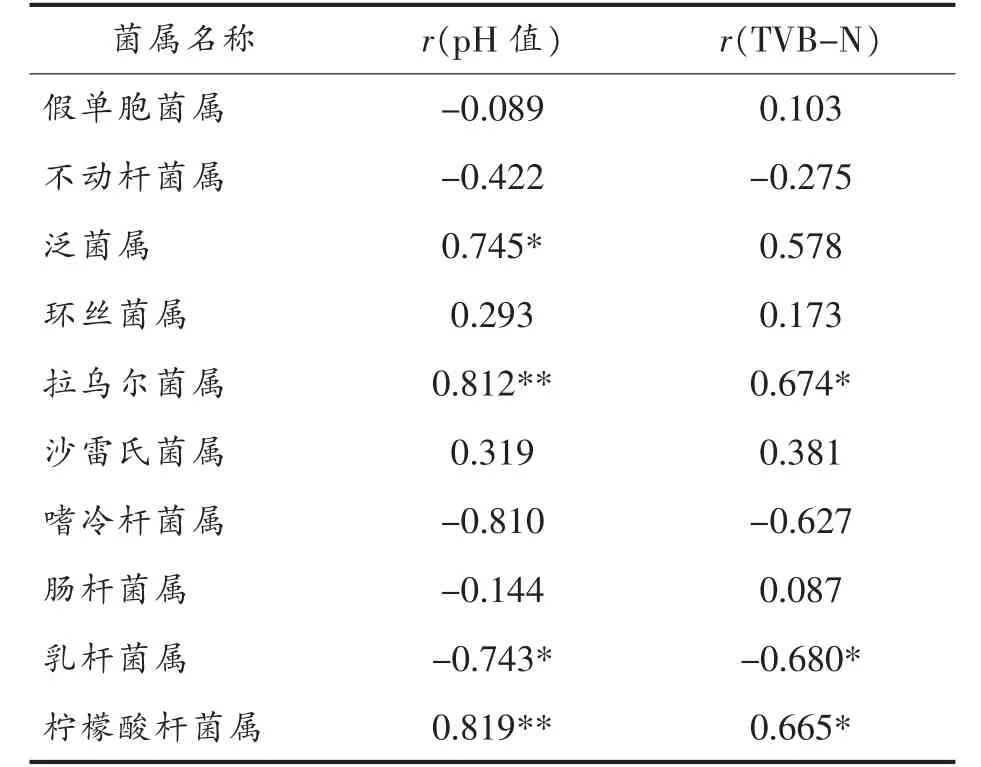
表4 菌属丰度与pH 值和TVB-N 含量的相关性Table 4 Correlation between abundances of genus,pH and TVB-N
3 结论
本研究通过高通量测序技术对冷鲜肉贮藏过程中的细菌群落结构分析,共鉴定出37 个门,181个目,575 个属。通过对细菌群落Alpha 多样性的分析,发现冷鲜肉在贮藏前期的菌群丰度和多样性都高于贮藏中期和后期,并且在10 d 的贮藏过程中,多样性指数和丰度指数基本上都呈“三级台阶”式的下降趋势。
对冷鲜肉贮藏过程中细菌群落结构进行分析,发现在门水平上,优势菌门为变形菌门、厚壁菌门和拟杆菌门,其中变形菌门相对丰度最高,平均值达到72.17%,其含量在整个贮藏过程中都处于较高的水平,厚壁菌门主要出现在贮藏的中期,拟杆菌门主要出现在贮藏的前期;在目水平上,假单胞菌目的丰度最高,平均值达40.19%。假单胞菌目的相对丰度在贮藏期间呈现先增加后减小的趋势。其次是肠杆菌目,平均丰度为28.44%,它主要在贮藏前期和后期的样本中占比较大;在属水平上,平均丰度前3 的菌属分别为假单胞菌属、不动杆菌属和泛菌属,贮藏前期的优势菌属为假单胞菌属和泛菌属,中期优势菌属为不动杆菌属、假单胞菌属和环丝菌属,后期优势菌属为假单胞菌属、泛菌属和拉乌尔菌属。就整个贮藏过程而言,假单胞菌属为腐败的最优势菌属,通过菌属丰度之间的相关性,发现假单胞菌属与肠杆菌属、沙雷氏菌属的丰度变化情况相似。通过对菌属的丰度和样品TVB-N 含量和pH 值的相关性分析,发现拉乌尔菌属和柠檬酸杆菌属与TVB-N 的含量存在较强的相关性,泛菌属、拉乌尔菌属和柠檬酸杆菌属的丰度与pH 值呈较强的相关性,但腐败过程中主要优势菌属假单胞菌属和不动杆菌属的相对丰度与腐败指标的相关性不强,说明腐败指标不是由某一种或某几种优势菌属单独决定,而受到多种细菌的共同影响。
