运动调控高盐膳食果蝇运动能力和生命周期的机制
——基于Salt与Foxo基因过表达
2021-10-19文登台后文其郗增辉翟帅帅
文登台,后文其,郗增辉,翟帅帅
(鲁东大学体育学院,山东烟台 264025)
适量用盐(主要为NaCl)能改善人体生理功能,如维持神经、肌肉的正常兴奋性等[1]。但长期过量摄入食用盐将诱发高血压、胃癌、糖尿病、心力衰竭等多种重大慢性疾病,并使死亡率增加[2-3]。世界卫生组织推荐每天食用盐的摄入量应不多于5 g,而我国居民每天食用盐摄入量高达13.5 g,是世界卫生组织推荐量的2.5倍多。动物实验研究[4]发现,高盐膳食能抑制大鼠骨骼肌血管的生成,导致骨骼肌收缩功能障碍,其主要机制与骨骼肌的氧化应激增加有关。运动锻炼是全世界公认的、能有效促进健康的方式之一,能预防或减轻许多慢性疾病并提高生存率[5]。有研究[6]发现,运动锻炼能促进人体骨骼肌血管生成,提高骨骼肌的抗氧化能力,从而增强骨骼肌的收缩功能。但长期运动训练与高盐摄入共存时,前者能否有效对抗后者诱发的寿命缩短和运动能力降低,这一问题仍有待明确,相关的分子机制也需进一步阐明。
果蝇是遗传学研究的经典模式生物,在果蝇中发现的许多信号分子通路及基因功能与哺乳动物及人具有同源性[7],且其与哺乳动物一样对运动和营养具有保守性,因此,果蝇逐渐被运用于运动与肥胖、运动与衰老、运动与心肌病的分子机制研究[8-11]。果蝇盐(Salt)基因与人类溶质载体家族5成员12(Solute Carrier Family 5 member 12,SLC5A12)基因属同源基因,两者在功能上具有保守性,能编码钠-溶质同向转运体。研究[12-13]表明:果蝇高盐膳食后寿命缩短,其主要机制与高盐诱发果蝇Salt基因表达上调有关;果蝇Salt基因过表达也能造成寿命缩短,这与高盐膳食效应类似;Salt基因敲减能增加高盐膳食果蝇的存活率。因此,研究提示,Salt基因是调控盐耐受性的关键基因,但其在运动抵抗高盐中发挥的作用仍不清楚。
本文首先对野生型果蝇进行运动训练和高盐膳食干预,通过检测果蝇运动能力、寿命和骨骼肌超氧化物歧化酶(Superoxide Dismutase,SOD)活力水平、丙二醛(Malondialdehyde,MDA)水平、活性氧(Reactive Oxygen Species,ROS)水平、Salt基因及叉头转录因子O(transcription factor of the forkhead box class O,Foxo)基因表达情况,初步分析运动抵抗高盐应激诱发果蝇运动能力和寿命损害的分子机制;然后,通过上游激活序列(Upstream Active Sequence,UAS)/半乳糖调节上游启动子元件(galactose-regulated upstream promoter element,Gal4)系统构建Salt基因、Foxo基因过表达模型,进一步研究Salt基因与Foxo/SOD通路在运动抵抗高盐应激中的作用,旨在为高盐摄入群体的运动健身提供理论依据。
1 材料与方法
1.1 果蝇品系
野生型w1118(品系号:3605)、arm-Gal4(品系号:39249)、Salt-UAS-过表达型(品系号:58888)和Foxo-UAS-过表达型(品系号:9575)4种品系果蝇均来自伯明顿果蝇品系中心(Bloomington Drosophila Stock Center)。将含UAS和Gal4序列不同品系的果蝇杂交,构建UAS/Gal4系统,对目的基因进行表达调控[14]。所有果蝇放置在恒温25℃、恒湿50%、12 h昼夜循环的环境下培养。
1.2 杂交及分组
将雄性野生型w1118、Salt-UAS-过表达型(基因型:w*;TI{TI}miR-1014KOSaltmiR-1014-KO)、Foxo-UAS-过表达型(基因型:y1w*;P{UAS-Foxo.P}2)果蝇分别与雌性arm-Gal4果蝇杂交,收集的F1代羽化12 h内的雄蝇分别是基因正常表达(arm-Gal4>w1118)、Salt过表达(arm-Gal4>Salt-UAS-过表达)和Foxo过表达(arm-Gal4>Foxo-UAS-过表达)果蝇(图1)。其中:arm-Gal4>w1118果蝇分为对照组、高盐组、运动组和高盐运动组;arm-Gal4>Salt-UAS-过表达果蝇分为Salt组和Salt+运动组;arm-Gal4>Foxo-UAS-过表达果蝇分为Foxo组和Foxo+高盐组。共8组,每组350只果蝇,共2 800只。

图1 果蝇杂交及分组示意Figure 1 Diagram of Drosophila hybridization and grouping
1.3 运动训练方案
利用果蝇逆重力攀爬特性,使其在运动平台(自主研发,专利号:ZL201920960000.4)上进行攀爬运动训练。试管固定于试管夹上并与地面垂直,此时果蝇做垂直于地面的攀爬运动,当果蝇爬到试管顶部时,试管自动翻转180°,果蝇又回到试管底部,继续攀爬运动训练(图2),攀爬时的负重等于果蝇体质量。运动组果蝇均放到运动装置上,每管20只,果蝇每次翻转至试管底部后,给予10 s做向上攀爬运动,试管长约8 cm,每天运动1.5 h,每周连续运动干预5 d,休息2 d,持续运动干预2周,在第2周龄末检测各指标。通过观察果蝇攀爬过程中能否跟上翻转速度,以及是否保持逆重力攀爬和趋光特性来判断是否产生运动疲劳。由于逆重力攀爬是果蝇自发的运动,且运动持续时间达到1.5 h才产生疲劳现象,因此,国内外学者将其定义为果蝇耐力运动[10-11]。
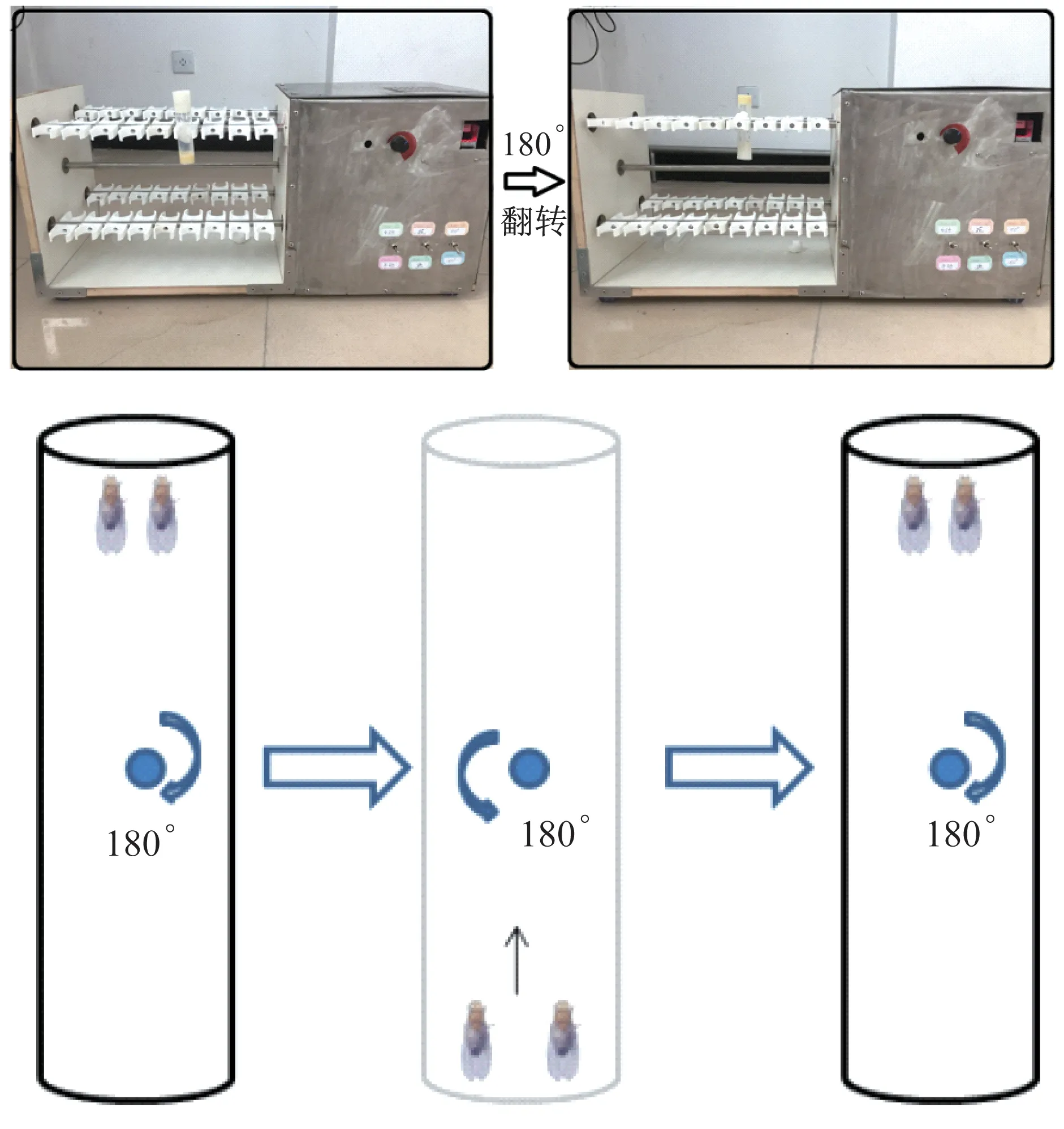
图2 果蝇运动平台和攀爬训练示意Figure 2 Schematic diagram of Drosophila exercise platform and climbing training
1.4 正常膳食和高盐膳食配制
(1)正常膳食:在锅中加入水、黄豆粉、酵母粉、玉米粉搅匀,并在加热过程中加入琼脂,直至溶液沸腾。沸腾后停止加热,冷却过程中加入蔗糖和麦芽糖,待蔗糖和麦芽糖充分溶解后,加入防腐剂丙酸和对羟基苯,充分搅拌后立即分装于洁净的培养管中,每管培养基厚度约为0.5 cm。
(2)高盐膳食:在正常食物配制过程中加入2%的食用盐(99%NaCl),充分溶解。
(3)膳食方案:从第2天龄开始,将高盐组果蝇从正常食物中转移至高盐食物中饲养,直至果蝇死亡。对于正常膳食果蝇和高盐膳食果蝇,每天早晚向试管壁加入0.2 mL纯净水,供其饮用(图3),相对于前人研究[12]中只喂食高盐膳食而未提供饮用水,本实验的膳食条件为温和的高盐膳食。

图3 高盐膳食果蝇正在饮水Figure 3 Drosophila on a high-salt diet are drinking water
1.5 各指标检测方法
1.5.1 酶联免疫吸附试验(Enzyme Linked Immunosorent Assay,ELISA)检测果蝇SOD活力水平、MDA水平和ROS水平
每管取10只果蝇骨骼肌置于500μL磷酸盐缓冲液中,用于检测SOD活力水平、MDA水平和ROS水平,重复3次,共需30只果蝇。ELISA检测步骤如下:用细胞破碎仪使果蝇骨骼肌细胞破裂,将匀浆液于4℃、2 504g离心15 min,取上清备用。于各标准品孔加不同浓度的标准品50μL;样本孔中加入待测样本50μL,设3个复孔;空白孔不加。除空白孔外,于标准品孔和样本孔中,每孔加入辣根过氧化物酶标记的检测抗体100μL,用封板膜封住反应孔,37℃水浴锅或恒温箱孵育60 min。弃去液体,于吸水纸上拍干;每孔加满洗涤液(350μL)静置1 min,甩去洗涤液,于吸水纸上拍干,如此重复洗板5次。然后每孔加入底物A、B各50μL,37℃避光孵育15 min。每孔加入终止液50μL,15 min内在450 nm波长处测定各孔的光密度值。以所测标准品的光密度值为横坐标,浓度值为纵坐标,在坐标纸上或用相关软件绘制标准曲线,并得到直线回归方程,然后将样品的光密度值代入方程,计算出样品的浓度。
1.5.2 实时荧光定量聚合酶链反应(quantitative Re⁃al-Time Polymerase Chain Reaction,qRT-PCR)检测基因信使核糖核酸(messenger Ribose Nu⁃cleic Acid,mRNA)表达情况
每管取10只果蝇骨骼肌,加入1 mL的TRIzol试剂提取总RNA,取2μL RNA进行反转录获得互补DNA。以核糖体蛋白L32(Ribosomal Protein L32,Rp49)基因为内参照,利用美国Bio-Rad公司产96孔荧光定量实时PCR仪、日本TaKaRa公司产RR820A SYBR®PCR试剂盒进行PCR扩增。使用Premiers 5.0软件设计引物序列,并经NCBI BLAST基因库检索验证,与其他基因无高度同源性。然后由生工生物工程(上海)股份有限公司合成引物并纯化,引物序列如下:Salt上游引物5′-TTAATCGCAGGCGCGTCAGTG-3′,下游引物5′-GGACGAGACCACCGTGTTAATCAG-3′;Foxo上游引物5′-AACAACAGCAGCATCAGCAG-3′,下游引物5′-CTGAACCCGAGCATTCAGAT-3′;Rp49上 游 引 物5′-CTAAGCTGTCGCACAAATGG-3′,下游引物5′-AACTTCTTG AA TCCGGTGGG-3′。PCR反应体系:2×SYBR®Premix Ex Taq™试剂15μL、上 游 引 物(10μmol/L)0.5μL、下 游 引 物(10μmol/L)0.5μL、参比染料0.6μL、cDNA模板5μL、双蒸水8.4μL;总体系30μL,每个样本分3个复孔,每孔10μL。PCR反应条件:95℃30 s,95℃5 s、60℃30 s循环40次。每组重复3次,共需30只果蝇。PCR扩增后用2%的琼脂糖凝胶电泳鉴定,并计算各组基因的mRNA相对表达量及过表达率。
1.5.3 电子显微镜观察骨骼肌超微结构
将果蝇麻醉,去掉翅膀、头部及腹部,将胸部放入固定液(含2.5%戊二醛的磷酸盐缓冲液)固定至少2 h,用0.1 mol/L磷酸漂洗液漂洗3次,每次10~15 min。然后用1%锇酸固定液固定1~2 h,用0.1 mol/L磷酸漂洗液漂洗3次,每次10~15 min。用50%丙酮10~15 min、70%丙酮10~15 min、90%丙酮10~15 min、100%丙酮15~20 min(中途更换1次)进行梯度脱水。用纯丙酮+包埋液(体积比为1∶1)37℃12 h或纯包埋液37℃10~12 h进行浸泡和包埋。37℃烘箱内过夜或60℃烘箱内12~24 h固化。采用超薄切片机切片,层厚50~100 nm;用3%醋酸铀及硝酸铅进行双染色。使用HT-7700透射电子显微镜观察并拍照。
1.5.4 运动能力检测
每组取100只果蝇,每管20只果蝇,用NVGS400摄像机拍摄果蝇震落至培养管底部后负趋地性爬行的行为学特征,以果蝇攀爬高度评定果蝇运动能力,即将全部果蝇个体震落至试管底部后,测量出第2 s时所有果蝇的攀爬高度。
1.5.5 生命周期统计
每组取200只果蝇,每天18︰00—19︰00观察和记录果蝇死亡数,直到各组果蝇全部死亡为止,绘制果蝇存活曲线。全部果蝇寿命的算术平均数为果蝇的平均寿命,平均寿命延长率=(实验组平均寿命-对照组平均寿命)/对照组平均寿命×100%。统计各组果蝇平均寿命和平均寿命延长率。
1.6 统计学方法
应用SPSS 17.0软件和GraphPad Prism 8软件分别进行统计学分析和制图。数据以平均数±标准差形式表示,若方差齐则用参数检验的独立样本t检验进行组间比较,若方差不齐则用t’检验进行组间比较。果蝇存活率的比较采用非参数log-rank检验。检验水准(α)为0.05。
2 结果
2.1 果蝇Salt基因mRNA及抗氧化指标的检测结果
高盐组果蝇Salt基因的mRNA表达水平高于对照组(P<0.01),相对过表达率约为142.00%;运动组果蝇Salt基因的mRNA表达水平与对照组相比无显著性差异(P>0.05);高盐运动组果蝇Salt基因的mRNA表达水平低于高盐组(P<0.05),相对过表达率约为-11.16%;Salt组果蝇Salt基因的mRNA表达水平高于对照组(P<0.01),相对过表达率约为55.00%;Salt+运动组果蝇Salt基因的mRNA表达水平与Salt组相比无显著性差异(P>0.05);Foxo组果蝇Salt基因的mRNA表达水平与对照组相比无显著性差异(P>0.05);Foxo+高盐组果蝇Salt基因的mRNA表达水平低于高盐组(P<0.05),相对过表达率约为-13.63%。见表1。
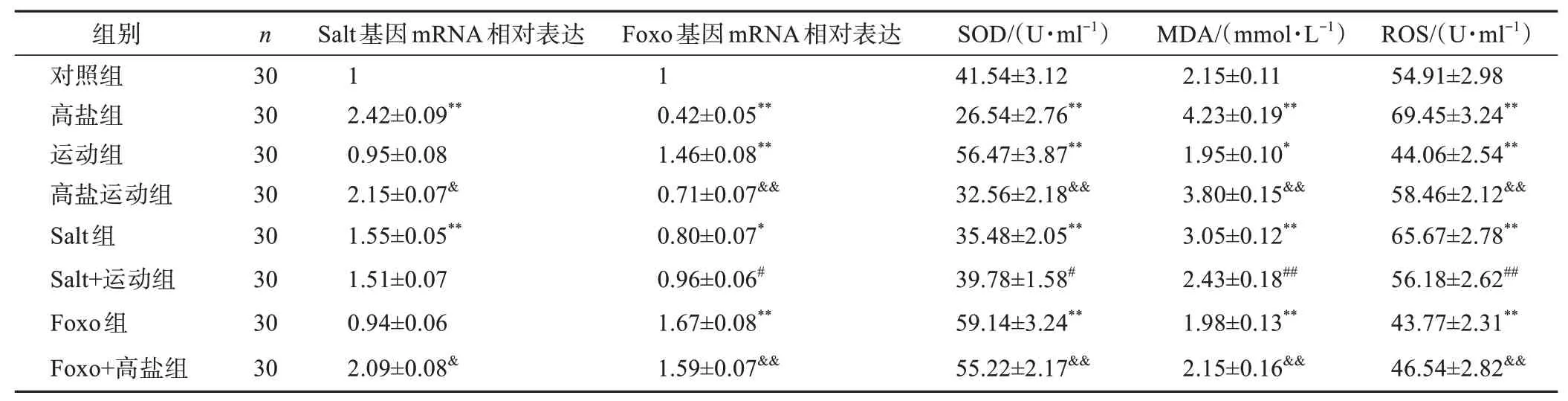
表1 Salt基因表达及氧化应激各指标检测结果(xˉ±s)Table 1 Salt gene expression and oxidative stress index detection results(xˉ±s)
高盐组果蝇Foxo基因的mRNA表达水平低于对照组(P<0.01),相对过表达率约为-58.00%;运动组果蝇Foxo基因的mRNA表达水平高于对照组(P<0.01),相对过表达率约为46.00%;高盐运动组果蝇Foxo基因的mRNA表达水平高于高盐组(P<0.01),相对过表达率约为69.05%;Salt组果蝇Foxo基因的mRNA表达水平低于对照组(P<0.05),相对过表达率约为-18.00%;Salt+运动组果蝇Foxo基因的mRNA表达水平高于Salt组(P<0.05),相对过表达率约为20.00%;Foxo组果蝇Foxo基因的mRNA表达水平高于对照组(P<0.01),相对过表达率约为67.00%;Foxo+高盐组果蝇Foxo基因的mRNA表达水平高于高盐组(P<0.01),相对过表达率约为278.00%。见表1。
高盐组果蝇SOD活力水平低于对照组(P<0.01),MDA和ROS水平均高于对照组(P<0.01);运动组果蝇SOD活力水平高于对照组(P<0.01),MDA和ROS水平均低于对照组(P<0.05、P<0.01);高盐运动组果蝇SOD活力水平高于高盐组(P<0.01),MDA和ROS水平均低于高盐组(P<0.01);Salt组果蝇SOD活力水平低于对照组(P<0.01),MDA和ROS水平均高于对照组(P<0.01);Salt+运动组果蝇SOD活力水平高于Salt组(P<0.05),MDA和ROS水平均低于Salt组(P<0.01);Foxo组果蝇SOD活力水平高于对照组(P<0.01),MDA和ROS水平均低于对照组(P<0.01);Foxo+高盐组果蝇SOD活力水平高于高盐组(P<0.01),MDA和ROS水平均低于高盐组(P<0.01)。见表1。
2.2 果蝇运动能力检测结果
对照组果蝇2 s攀爬高度大于高盐组[P<0.01,图4(a)],高盐组果蝇胸腔骨骼肌电子显微镜图像显示骨骼肌中肌原纤维遭受较严重的破坏(图5)。运动组果蝇2 s攀爬高度大于对照组[P<0.05,图4(b)],果蝇骨骼肌中肌原纤维与对照组相比破坏减少(图5)。高盐运动组果蝇2 s攀爬高度大于高盐组[P<0.01,图4(c)],果蝇骨骼肌中肌原纤维遭受的破坏明显少于高盐组(图5)。对照组果蝇2 s攀爬高度与Salt组果蝇相比无显著性差异[P>0.05,图4(d)],但Salt组果蝇骨骼肌中肌原纤维遭受的破坏比对照组严重(图5)。Salt+运动组果蝇2 s攀爬高度大于Salt组[P<0.05,图4(e)],骨骼肌中肌原纤维破坏与Salt组相比较少(图5)。Foxo组果蝇2 s攀爬高度大于对照组[P<0.01,图4(f)],骨骼肌中肌原纤维破坏与对照组相比较少(图5)。Foxo+高盐组果蝇2 s攀爬高度大于高盐组[P<0.01,图4(g)],骨骼肌中肌原纤维破坏与高盐组相比明显减少(图5)。
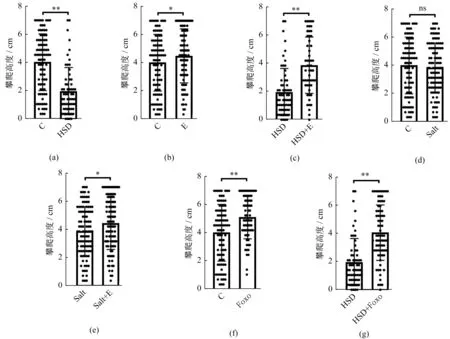
图4 各组果蝇1周龄末2 s攀爬高度的比较Figure 4 Climbing height comparision of 1-week-old Drosophila in 2 secends

图5 各组果蝇骨骼肌透射电子显微镜图像结果Figure 5 Results of obvious transmission electron microscope image of Drosophila skeletal muscle
2.3 果蝇生命周期检测结果
对照组果蝇的存活率高于高盐组(P<0.01),对照组果蝇的平均寿命约为59 d,高盐组果蝇的平均寿命约为47 d,高盐组寿命缩短率为20.34%。高盐运动组果蝇的存活率高于高盐组(P<0.05),高盐运动组果蝇的平均寿命约为53 d,高盐组果蝇的平均寿命约为47 d,高盐运动组寿命延长率为12.77%。运动组果蝇的存活率高于对照组(P<0.05),运动组果蝇的平均寿命约为65 d,对照组果蝇的平均寿命约为59 d,运动组寿命延长率为10.17%。对照组果蝇的存活率高于Salt组(P<0.01),对照组果蝇的平均寿命约为59 d,Salt组果蝇的平均寿命约为45 d,Salt组寿命缩短率为23.73%。Salt+运动组果蝇的存活率高于Salt组(P<0.05),Salt+运动组果蝇的平均寿命约为52 d,Salt组果蝇的平均寿命约为45 d,Salt+运动组寿命延长率为15.56%。Foxo组果蝇的存活率高于对照组(P<0.05),Foxo组果蝇的平均寿命约为64 d,对照组果蝇的平均寿命约为59 d,Foxo组寿命延长率约为8.47%。Foxo+高盐组果蝇的存活率高于高盐组(P<0.01),Foxo+高盐组果蝇的平均寿命约为59 d,高盐组果蝇的平均寿命约为47 d,Foxo+高盐组寿命延长率为25.53%。见图6。

图6 果蝇存活率和平均寿命比较Figure 6 Comparison of survival results and mean lifespan in Drosophila
3 讨论
3.1 耐力运动对高盐膳食果蝇运动能力和寿命的影响
研究[15]表明,在哺乳动物中,高盐膳食能减弱机体组织器官(如肾脏、心脏和大脑等)的抗氧化功能,增强氧化应激及损伤,从而诱发疾病。此外,高盐膳食能通过抑制血管紧张素Ⅱ和增强氧化应激损害骨骼肌功能[4]。相反,运动训练能促进骨骼肌血液循环和提高抗氧化能力,从而提高骨骼肌收缩能力[6]。但运动锻炼能否抵抗高盐膳食对骨骼的损害,其分子机制如何,国内外鲜有相关报道。
本文通过给予果蝇高盐膳食和运动训练干预发现,高盐膳食能明显降低果蝇快速攀爬能力,并破坏骨骼肌的正常结构。此外,本文结果还显示,高盐膳食不仅能诱发果蝇Salt基因表达上调,也减弱了机体的抗氧化能力,增加脂毒性物质MDA,提升ROS水平;但通过运动训练干预,高盐膳食果蝇的快速攀爬能力明显提升,寿命得到显著延长,Salt基因表达明显下降,机体抗氧化能力明显提高。这一结果提示,运动训练能明显改善高盐膳食对果蝇运动能力和寿命的不利影响,其分子机制与Salt基因表达改善和机体抗氧化能力提高有关。Salt基因编码的钠-溶质同向转运体是溶质转运家族的成员,参与机体对盐分失调的应答[16]。研究[17-18]证实,盐敏感性与氧化应激反应增强、超氧阴离子产生增加密切相关,高盐摄入能激活肾素-血管紧张素-醛固酮系统,造成ROS产生增多,导致氧化应激增强,其主要机制与高盐摄入增加还原型烟酰胺腺嘌呤二核苷酸磷酸(Nicotinamide Adenine Dinucleotide Phosphate,NADPH)氧化酶的活性使体内超氧阴离子生成增多有关。在进行有氧耐力锻炼的过程中,机体会逐渐出现缺氧现象,氧自由基逐渐产生,运动疲劳随之而来。运动后,机体通过一系列反应来纠正内环境稳态破坏的状态,包括不断合成抗氧化因子SOD、过氧化氢酶(Catalase,CAT)和谷胱甘肽(GSH)等,以及清除氧自由基和减少脂毒性损伤等。因此,运动锻炼和适当休息能使机体不断经历“氧化应激-自由基清除-一时性超量恢复-氧化应激”这一循环过程。这种长期有规律的刺激导致机体抗氧化因子随着每次的“一时性-适应性增强”逐渐转变为“持久性增强”,包括使SOD活力水平升高及Foxo基因表达增加等[19-20]。因此,有规律的、适宜的运动锻炼能提高机体的抗氧化能力,减少组织器官(包括骨骼肌、心脏和大脑等)的氧化损伤。
在果蝇中,氧化应激增加是导致果蝇运动能力减弱、死亡率增加及衰老加快的主要原因[21]。研究[22]报道,果蝇进行飞行训练后寿命显著缩短,其主要原因是果蝇的飞行属于高强度运动,运动过程中产生大量氧自由基,这使氧化应激超出果蝇承受和恢复的极限。相反,果蝇规律的攀爬运动已被国内外学者证实能延长果蝇寿命,提高心脏功能和运动能力[23]。此外,果蝇规律的攀爬运动能减少高脂膳食带来的脂质堆积,减少脂毒性损伤,降低脂毒性心肌病的发生风险,并延长生命周期[8]。其机制与规律运动提高果蝇SOD活力水平、增强Foxo基因表达、减少MDA和ROS有关。因此,耐力运动能通过增强高盐膳食果蝇的抗氧化能力和下调Salt基因表达来改善其运动能力和存活率,并有效保护其骨骼肌和肌原纤维的完整性。尽管如此,本文结果还显示,运动锻炼并不能完全逆转高盐膳食对果蝇寿命的损害,其主要机制与该组果蝇的氧化应激和Salt基因表达未恢复到正常饮食果蝇水平有关,这说明高盐膳食对寿命的危害大于运动的延长寿命效益。此外,在正常饮食的果蝇中,运动并不能明显下调Salt基因表达,提示Salt基因可能不参与耐力运动对高盐膳食果蝇影响的机制调节。
3.2 耐力运动对Salt基因过表达果蝇运动能力和寿命的影响
果蝇Salt基因与人类SLC5A12基因属同源基因,编码钠-溶质同向转运体,果蝇Salt基因表达上调能使钠-溶质同向转运体表达增加,这将造成过多钠离子被肠道吸收,果蝇血液、淋巴和细胞质中钠离子浓度增加,内环境稳态破坏,因此,Salt基因过表达果蝇在正常饮食情况下寿命也会缩短[12,16]。关于人类SLC5A12基因是否与人体盐耐受性有关,国内外研究[21-23]仍较少。本文结果显示,果蝇Salt基因过表达对其寿命的影响与既往研究结果类似,Salt基因过表达能缩短果蝇寿命。此外,本文还发现,果蝇Salt基因过表达能削弱其运动耐受性,这可能与Salt基因过表达果蝇的骨骼肌遭受损伤有关。与果蝇高盐膳食结果类似,果蝇Salt基因过表达能显著下调Foxo基因表达,减少SOD的活力,使毒性产物MDA和ROS增加。研究[6]表明,在果蝇Salt基因敲减的情况下,高盐膳食不能显著缩短果蝇的寿命。因此,推测果蝇Salt基因过表达导致其盐耐受性降低,机体内钠离子代谢紊乱,钠离子超载造成果蝇机体抗氧化能力降低,氧自由基攻击骨骼肌致使运动能力减弱,同时,氧自由基也会攻击其他组织和器官导致果蝇寿命缩短[24]。
研究[25]表明,耐力运动对哺乳动物和果蝇的运动能力和寿命产生良好效应,其机制与抗氧化能力增强密切相关,在不同的遗传背景下,运动训练可能对运动能力和寿命造成不利影响。为进一步证实抗氧化性是否为耐力运动增强盐耐受性的主要原因,本文利用UAS/arm-Gal4系统通过杂交使果蝇Salt基因遗传性地全身过表达,发现耐力运动同样对遗传性Salt基因全身过表达果蝇的攀爬能力和寿命有明显提升效果。与耐力运动对高盐膳食果蝇的影响不同的是,Salt基因全身过表达果蝇在耐力运动干预后,Salt基因表达并未发生明显改变,而抗氧化能力显著增加。这一结果提示,耐力运动能改善Salt基因全身过表达对果蝇运动能力和寿命造成的不利影响,其机制与果蝇机体抗氧化能力增强有关,与Salt基因及钠-溶质同向转运体活性无关。与果蝇不同的是,人类在运动过程中,通过汗腺的排泄,机体的钠离子含量将减少,这能否改善高盐膳食对人类的危害,有待进一步研究证实。
3.3 Foxo过表达对高盐膳食果蝇运动能力和寿命的影响
为进一步证实机体抗氧化能力是改善高盐膳食对果蝇运动能力和寿命危害的重要因素,本文同样利用UAS/arm-Gal4系统通过杂交使目标基因Foxo成功地全身过表达。Foxo是一个重要的转录调节因子,在细胞的凋亡、应激、DNA损伤/修复及糖脂代谢调节中起着重要作用。Foxo亚家族具有高度保守的磷酸化位点,这些位点是蛋白激酶B(protein kinase B,Akt/PKB)激酶的磷酸化靶位点,Foxo活性受翻译后修饰(包括磷酸化和乙酰化)调节[26-27]。
研究[28]表明,Foxo对SOD转录合成有上游调节作用,而SOD是清除氧自由基的重要蛋白酶,因此,Foxo与氧化应激密切相关。研究[29-30]证实,果蝇Foxo过表达或激活能使其寿命显著延长,本文结果与既往研究结果类似。此外,本文还发现,果蝇Foxo过表达能增强果蝇的快速攀爬能力,这可能与Foxo过表达使SOD活力增加,导致果蝇机体抗氧化能力增强、毒性产物MDA减少有关。在运动过程中产生的大量氧自由基是导致运动疲劳的重要原因,而Foxo过表达能提高机体(包括骨骼肌)的抗氧化能力,这能减少氧化应激对骨骼肌的损害,并使其运动能力得以增强[19-20]。
此外,本文结果还显示,Foxo过表达能显著减少高盐膳食对果蝇的损害,如Foxo过表达能显著延长高盐膳食果蝇的寿命,增强其运动耐受性和抗氧化能力,减少自由基损伤,并能有效地下调高盐膳食诱发的Salt基因过表达。已有研究[17-18]证实,高盐膳食能增强机体氧化应激,而遗传性地增强果蝇抗氧化能力能增强其高盐耐受性,这提示增强机体的抗氧化能力是抵抗高盐膳食对健康危害的重要手段之一。本文结果显示,无论是Foxo过表达还是耐力运动,都无法使高盐膳食果蝇的寿命、运动能力、抗氧化能力恢复到正常膳食果蝇水平,这可能与高盐膳食可能还损害果蝇其他重要脏器和组织内环境稳态系统(如渗透压平衡等)有关,但有待进一步证实。
4 结论
Foxo/SOD通路活性增强和Salt基因表达下调是耐力运动后高盐膳食果蝇的运动能力提升和寿命延长的重要分子机制;果蝇Salt基因过表达对Foxo/SOD通路活性有下游调节作用,并能降低运动能力和缩短生命周期;耐力运动能通过提高Foxo/SOD通路活性,减缓Salt基因过表达诱发的果蝇运动能力下降和寿命衰减。
作者贡献声明:
文登台:提出论文主题,设计论文框架,撰写论文,实验取材;
后文其:果蝇杂交及收集,核实数据;
郗增辉:果蝇运动训练,修改论文;
翟帅帅:审核、统计数据。
