BMP2/Smads通路介导富血小板纤维蛋白对人牙髓干细胞成骨分化的作用研究*
2021-10-17朱青青王佳琼
孙 琛 朱青青 王佳琼 张 雪
2000年Gronthos[1]等最先从人牙髓组织中分离培养出牙髓干细胞,从此关于牙齿发育、损伤修复及再生机制方面的认知程度进一步加深,并上升到细胞层面。在这一背景下,牙髓干细胞等牙源性干细胞用于体内外组织重建势在必行,这是因为人牙髓干细胞有自我更新、多向分化等潜能,有助于牙髓-牙本质复合体形成[2,3]。富血小板纤维蛋白(platelet-rich fibrin,PRF)中的生长因子可诱导多种细胞增殖、分化[4]。体外研究发现,PRF 能够诱导兔半月板细胞增殖,促进细胞外基质合成[5]。已有研究指出PRF 在牙周和软组织修复中起重要作用,但PRF 对人牙髓干细胞成骨分化作用报道少见[6]。本旨在分析PRF 对牙髓干细胞成骨分化的作用及机理,为牙髓干细胞和PRF 的应用提供理论依据。
1.材料与方法
1.1 材料
1.1.1 细胞、血液来源 收集本院20岁左右年轻志愿者,因正畸拔除的健康完整恒牙10 颗,并提取牙髓干细胞,纯化扩增。志愿者均为无吸烟、饮酒史的健康男性,各取静脉血4mL。本研究已经医院伦理学委员会审批。
1.1.2 主要药物与试剂α-MEM 培养基、胎牛血清、胰酶(武汉普诺赛生物公司),反转录试剂盒、荧光定量PCR 试剂盒(日本TaKaRa 公司),鼠抗人CD29-PE、CD90-PE、STRO-1-APC单克隆抗体、兔抗人骨形态发生蛋白-2(Bone morphogenetic protein 2,BMP-2)、Smad1、Smad5、p-Smad1/5、Runt 相关转录因子2(Runt-related tranion factor 2,RUNX2)多克隆抗体、辣根过氧化物酶标记的二抗(日本TaKaRa),BMP 抑制剂LDN-212854、BMP 激活剂山金车内酯C(美国MedChemExpress),碱性磷酸酶(Alkaline Phosphatase,ALP)试剂盒(上海晶抗生物公司)。
1.2 方法
1.2.1 牙髓干细胞培养 用改良组织块-消化联合法培养牙髓干细胞,步骤:取出牙髓,PBS 冲洗2 遍,切成小块,加0.25%胰蛋白酶消化0.5h,离心弃上清,细胞重悬后继续培养。细胞汇合率为80%时传代。
1.2.2 PRF 的制备 按照Li 等[4]的方法制备PRF。取静脉血,1500r/min离心10min(离心半径8cm),分离血浆和血细胞之间白色PRF 凝块,排出多余液体,用2片无菌玻璃片挤压使PRF 凝块形成膜状,渗出液1500r/min 离心10min(离心半径8cm),获得无血细胞的渗出液,用无菌过滤器过滤,储存于-80℃冰箱中待用。
1.2.3 流式细胞仪检测牙髓干细胞表面抗原标记物 取传代培养至第3 代的牙髓干细胞,制成单细胞悬液,PBS 重悬细胞,加鼠抗人CD29-PE、CD90-PE、STRO-1-APC,兔抗鼠IgG-APC 为阴性对照,4℃避光孵育1h,重悬细胞,上流式细胞仪检测。
1.2.4 分组及处理 牙髓干细胞随机分为对照组、PRF 组、激活剂组和抑制剂组。对照组牙髓干细胞用含10%胎牛血清的双抗α-MEM 培养基培养;PRF 组在10%胎牛血清的双抗α-MEM 培养基中加入-80 ℃保存的PRF,使PRF 体积分数为50%;激活剂组和抑制剂组在PRF 组培养基基础上分别加入山金车内酯C(终浓度为10μM)和LDN-212854(终浓度为5nM)。
1.2.5 碱性磷酸酶(Alkaline Phosphatase,ALP)活性检测 取对数生长期的牙髓干细胞,对照组、PRF 组、激活剂组和抑制剂组加入对应的培养基,培养7d、14d 后,加Triton X-100,4℃过夜,细胞完全裂解后加ALP 底物混合液孵育0.5h,0.5mol/L NaOH 终止反应,用酶标仪测定490nm处光密度(A)值。
1.2.6 RT-qPCR 检测人牙髓干细胞成骨分化 标 志 物 胶 原 蛋 白I(collagen-I,COL-I)、RUNX2、骨钙素(osteocalcin,OCN)表达 提取细胞总RNA,按照反转录试剂盒说明书反转为cDNA,进行荧光定量PCR,2-△△CT法计算目的基因的相对表达量。引物序列见表1。

表1 引物序列表
1.2.7 茜素红染色和半定量检测 取对数期的牙髓干细胞,转接到6孔板(1×106个/mL),细胞贴壁后,继续培养至第14d,固定15min,茜素红染液染色,倒置显微镜下观察。半定量检测:晾干固定好的细胞,加1mL茜素红萃取液,在波长562nm外测定A值。
1.2.8 Western-Blot 检 测BMP2、Smad1、Smad5、p-Smad1/5、RUNX2蛋白相对表达水平
取对数期的牙髓干细胞培养14d,收集细胞,提取总蛋白,加入SDS-loading buffer,100℃水浴变性,进行SDS-PAGE 凝胶电泳,转膜,室温封闭2h,一抗孵育过夜,二抗(1∶4000 稀释)室温封闭1h,曝光显影,计算目的蛋白相对表达量。
1.3 统计学分析 SPSS 24.0 统计学软件分析,计量资料用(±s)表示,符合正态分布,方差齐,多样本计量资料比较采用单因素方差分析,两两样本比较采用LSD-t 检验。P<0.05 为差异有统计学意义。
2.结果
2.1 人牙髓干细胞的表型鉴定 CD29、STRO-1、CD90阳性细胞呈阳性表达,见图1。

图1 牙髓干细胞鉴定
2.2 人牙髓干细胞ALP活性检测PRF组、激活剂组、抑制剂组牙髓干细胞培养7d、14d ALP活性高于对照组(P<0.05);激活剂组牙髓干细胞培养7d、14d ALP活性高于PRF组,抑制剂组牙髓干细胞培养7d、14d ALP活性低于PRF组(P<0.05);抑制剂组牙髓干细胞培养7d、14d ALP 活性低于激活剂组(P<0.05);且随着培养时间增加,对照组、PRF组、激活剂组、抑制剂组ALP活性也在升高(P<0.05)。见表2。
表2 牙髓干细胞ALP活性(±s,n=5)
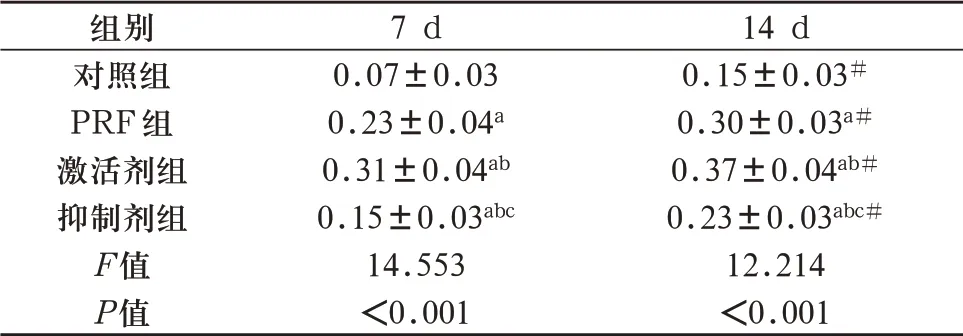
表2 牙髓干细胞ALP活性(±s,n=5)
注:与对照组比较,aP<0.05;与PRF组比较,bP<0.05;与激活剂组比较,cP<0.05。与培养7d比较,#P<0.05。
组别对照组PRF组激活剂组抑制剂组F值P值7 d 0.07±0.03 0.23±0.04a0.31±0.04ab0.15±0.03abc14.553<0.001 14 d 0.15±0.03#0.30±0.03a#0.37±0.04ab#0.23±0.03abc#12.214<0.001
2.3 人牙髓干细胞COL-Ⅰ、RUNX2、OCN mRNA 表达 PRF 组、激活剂组、抑制剂组COL-Ⅰ、RUNX2、OCN mRNA 表达高于对照组(P<0.05);激 活 剂 组COL-Ⅰ、RUNX2、OCN mRNA 表达高于PRF 组,抑制剂组COL-Ⅰ、RUNX2、OCN mRNA 表 达 低 于PRF 组(P<0.05);抑制剂组COL-Ⅰ、RUNX2、OCN mRNA表达高于激活剂组(P<0.05)。见表3。
表3 人牙髓干细胞COL-Ⅰ、RUNX2、OCNmRNA表达水平(±s,n=5)
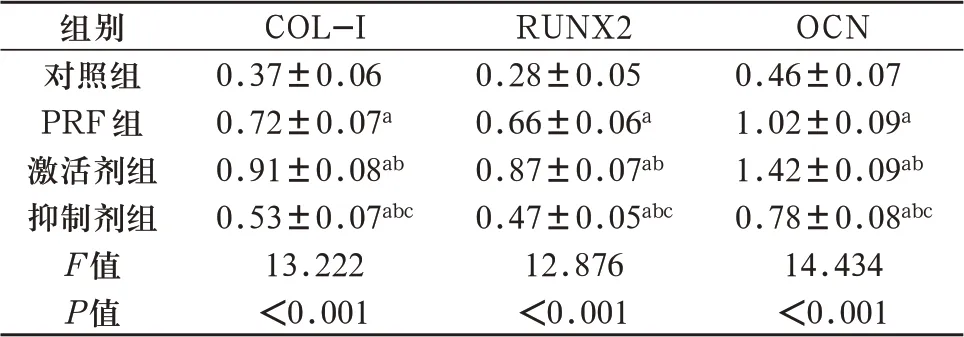
表3 人牙髓干细胞COL-Ⅰ、RUNX2、OCNmRNA表达水平(±s,n=5)
注:与对照组比较,aP<0.05;与PRF组比较,bP<0.05;与激活剂组比较,cP<0.05。
组别对照组PRF组激活剂组抑制剂组F值P值COL-I 0.37±0.06 0.72±0.07a0.91±0.08ab0.53±0.07abc13.222<0.001 RUNX2 0.28±0.05 0.66±0.06a0.87±0.07ab0.47±0.05abc12.876<0.001 OCN 0.46±0.07 1.02±0.09a1.42±0.09ab0.78±0.08abc14.434<0.001
2.4 各组茜素红染色半定量分析结果与红色矿化结节数目比较 与对照组比较,PRF组、激活剂组和抑制剂组红色矿化结节数目增多(P<0.05);与PRF 组比较,激活剂组红色矿化结节数目增多(P<0.05),抑制剂组红色矿化结节数目减少(P<0.05);与激活剂组比较,抑制剂组红色矿化结节数目减少(P<0.05)。见图2。
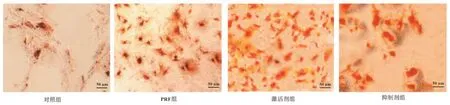
图2 各组矿化结节形成情况比较(茜素红×100)
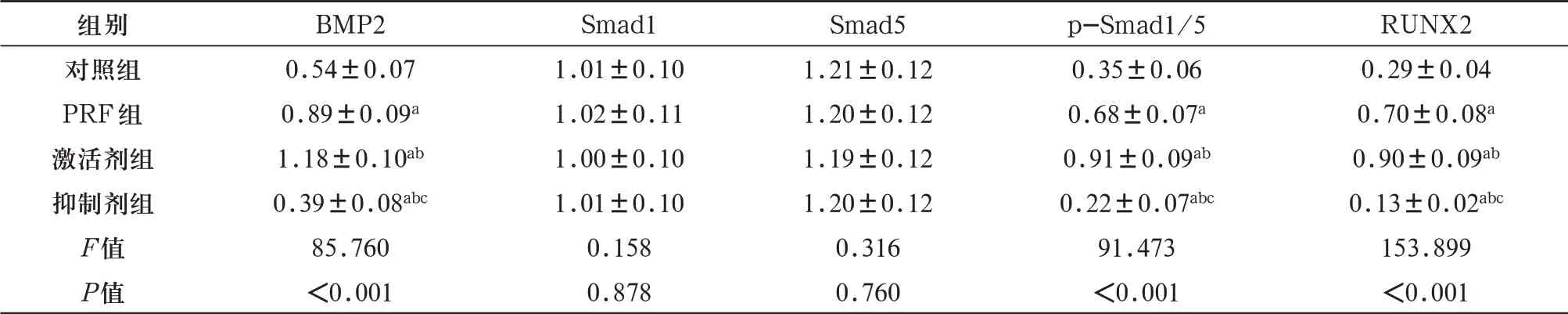
2.5 各组BMP2、Smad1、Smad5、p-Smad1/5、RUNX2 蛋白相对表达水平PRF 组、激活剂组和抑制剂组BMP2、p-Smad1/5、RUNX2 蛋白相对表达量高于对照组,且抑制剂组 表4 茜素红染色半定量分析结果与红色矿化结节数目(±s,n=5) 表4 茜素红染色半定量分析结果与红色矿化结节数目(±s,n=5) 注:与对照组比较,aP<0.05;与PRF组比较,bP<0.05;与激活剂组比较,cP<0.05。 组别对照组PRF组激活剂组抑制剂组F值P值A值0.28±0.02 0.66±0.06a1.42±0.09ab0.45±0.03abc389.167<0.001数目15±6 40±8a112±10ab27±9abc134.970<0.001 表4 BMP2、Smad 1、Smad5、RUNX2蛋白相对表达水平(±s,n=5) 表4 BMP2、Smad 1、Smad5、RUNX2蛋白相对表达水平(±s,n=5) 注:与对照组比较,aP<0.05;与PRF组比较,bP<0.05;与激活剂组比较,cP<0.05。 组别对照组PRF组激活剂组抑制剂组F值P值BMP2 0.54±0.07 0.89±0.09a1.18±0.10ab0.39±0.08abc85.760<0.001 Smad1 1.01±0.10 1.02±0.11 1.00±0.10 1.01±0.10 0.158 0.878 Smad5 1.21±0.12 1.20±0.12 1.19±0.12 1.20±0.12 0.316 0.760 p-Smad1/5 0.35±0.06 0.68±0.07a0.91±0.09ab0.22±0.07abc91.473<0.001 RUNX2 0.29±0.04 0.70±0.08a0.90±0.09ab0.13±0.02abc153.899<0.001 图3 BMP2、Smad1、Smad5、RUNX2蛋白相对表达水平 Ferrarotti等[7]、Li等[8]、Fuji等[9]研究表明,在一定环境下,牙髓干细胞可凭借类似骨髓基质干细胞的多向分化潜能,分化为骨、肌肉等组织细胞。PRF富含多种与组织修复相关的生长因子,在牙周和软组织修复中也起重要作用,因此研究PRF对牙髓干细胞成骨分化的作用对口腔科学的发展至关重要[10,11]。 CD29、STRO-1、CD90能促进干细胞增殖[12]。本研究中,STRO-1、CD29、CD90阳性表达,表明本研究分离培养的牙髓干细胞符合其表型。ALP反映成骨细胞分化程度,并能促进骨基质矿化形成[13,14]。Matsui等[15]研究表明,干细胞分化程度与ALP活性成正比。有研究发现,使用根尖乳头干细胞内加入PRF后,ALP等成骨标志物表达明显上调[16]。本研究中PRF组与对照组比较,ALP活性明显升高,矿化结节数目增多,提示PRF可诱导成骨细胞分化。黄奕智等[17]发现用PRF处理牙周膜成纤维细胞,对细胞增殖、成骨细胞分化均有诱导作用。COL-Ⅰ、RUNX2、OCN可谓人牙髓干细胞的成骨分化标志物,本研究中,与对照组比较,PRF组人牙髓干细胞COL-Ⅰ、RUNX2、OCN表达明显升高,提示PRF可促进人牙髓干细胞成骨分化。 BMP是调控生长发育过程中扮演重要角色的转化生长因子-β1超家族成员。膜表面的BMP配体结合BMP Ⅰ型和Ⅱ型受体,受体活化后启动Smad依赖型信号通路,诱导RUNX2 在细胞核内高表达[18,19]。本研究结果提示BMPR2 抑制剂可下调BMPR2-pSmad1/5-RUNX2信号通路,诱导去分化软骨肉瘤细胞凋亡[20]。本研究中PRF组相较于对照组BMP2、p-Smad1/5、RUNX2 表达明显升高,但PRF组BMP2、p-Smad1/5、RUNX2表达低于激活剂组又高于抑制剂组,提示PRF是通过激活BMP受体的表达,促进Smad1/5磷酸化,诱导RUNX2表达发挥作用,从而促进牙髓干细胞向成骨分化。 综上所述,PRF 可能通过激活BMP2/Smads信号通路促进人牙髓干细胞成骨分化,为口腔科学临床研究奠定基础。

3.讨论
