骨髓间充质干细胞结合Masquelet技术治疗感染性骨缺损的临床疗效观察
2021-10-16卢承印王朋涛张来福张海龙尹利军谢艳王孝辉
卢承印 王朋涛 张来福 张海龙 尹利军 谢艳 王孝辉
临床上由各种原因引起的感染性骨缺损较为常见,因其治疗相当困难,给病人家庭和社会带来巨大的负担,是临床上需要研究的课题之一[1]。各种治疗方法修复感染性骨缺损时,均需多次手术,且此类病人软组织条件往往较差,敏感抗生素缺乏,预后相对较差。近年来,Masquelet技术治疗感染性骨缺损因其操作简单,抗感染效果好及二期成骨愈合快,逐渐被临床医师青睐,但在治疗过程中也存在移植骨吸收、骨不连等问题[2]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)作为一类非造血干细胞,已有相关研究表明其可以向软骨细胞、成骨细胞、肌细胞等细胞分化,具有较强的成骨潜能,是治疗骨缺损最为理想的种子细胞[3-4]。基于此,我们采用BMSCs结合Masquelet 技术治疗了30例感染性骨缺损病人,本研究回顾性分析这30例病人的临床资料,探讨应用BMSCs结合Masquelet技术治疗感染性骨缺损的临床疗效。
资料与方法
一、纳入标准与排除标准
纳入标准:①病人年龄为20~65岁;②确诊为感染性骨缺损病人;③病人采用BMSCs结合Masquelet技术进行治疗。
排除标准:①患肢存在神经血管损伤或严重短缩畸形;②术前血尿粪常规、肝肾功、凝血等检验结果异常,或合并有较重的内科疾病者;③认知障碍或精神病史者;④随访资料不完整者。
二、一般资料
根据纳入标准与排除标准,2016年6月至2019年1月河南省洛阳正骨医院收治的30例感染性骨缺损病人纳入本研究,其中男21 例,女9 例;年龄为20~65 岁,平均34.5 岁。缺损部位:胫骨干18 例,尺、桡骨干6 例,股骨干5 例,肱骨干1 例。骨缺损长度为3~13 cm,平均7.3 cm。车祸伤23例,机器挤压伤4例,高处坠落伤3 例。24 例存在皮肤缺损或窦道,其中16例在第一阶段手术时行皮瓣修复覆盖创面,其余8例行一期彻底清创,负压封闭引流技术控制感染,待条件许可后行取皮植皮修复创面。术前对伤口分泌物细菌培养结果:金黄色葡萄球菌阳性20例,阴沟杆菌阳性5例,产气杆菌阳性1例,双重细菌感染阳性2例,耐甲氧西林金黄色葡萄球菌阳性2例。所有病人术前均签署知情同意书。
三、治疗方法
(一)BMSCs制备
所有病人于Masquelet 技术二期手术前一天进行骨髓血采集和BMSCs 制备,具体方法为:骨髓血采集由医生负责,通常选取髂前上棘后上方1~2 cm处作为穿刺点,此处骨面较平,容易固定,操作方便、安全。病人取仰卧位,常规消毒皮肤,戴无菌手套、铺消毒洞巾,使用2%利多卡因作局部浸润麻醉直至骨膜,做“品”字形多点麻醉。等待2 min左右,使骨膜得到充分的浸润和麻醉。将骨髓穿刺针固定器固定在适当长度上,当穿刺针接触到骨质后则左右旋转,缓缓钻刺骨质,当感到阻力消失,且穿刺针已固定在骨内时,表示已进入骨髓腔,用50 mL注射器抽吸2~4 mL 肝素钠(上海上药第一生化药业有限公司,中国),来回抽吸几次,润湿注射器内部,将内栓退出1 cm,拔出针芯,接上注射器,用适当力度缓慢抽吸,抽吸过程中,拔出注射器,及时摇晃混匀,避免骨髓血凝固。抽吸完毕后,插入针芯,轻微转动拔出穿刺针,随后将消毒纱布盖在针孔上,稍加按压,用胶布加压固定,术后压迫止血。采集完成后由医生交给组织工程实验人员将血样转运至实验室。采用75%医用酒精擦拭注射器外壁后转移至局部百级的生物安全柜(济南鑫贝西生物技术有限公司,中国)内,将注射器内的抗凝骨髓血转移至50 mL 无菌离心管,以600 g 离心15 min,用移液管小心将含BMSCs 的上层清液转移至新的无菌离心管以200 g 进行二次离心,弃去上清后获得的浓集液置于无菌注射器中,使用一次性自封包装袋包装备用。取0.5 mL 浓集液进行细菌培养,另取0.5 mL 浓集液进行单核细胞数量检测,单核细胞数量即可间接反映BMSCs 数量,一般以(5~10)×105个/L 为佳。随后使用凝血酶冻干粉200 U(湖南一格制药有限公司,中国)与1~2 mL 生理盐水配制成凝血酶溶液,使用5 mL注射器将其吸入注射器内,套上专用注射器堵头,使用一次性自封包装袋包装。由制备人员将凝血酶溶液和BMSCs浓集液交给负责医生。
(二)Masquelet技术手术方法
手术分两个阶段进行。第一阶段:彻底清创,清除骨缺损周围炎性组织及死骨,一期或二期皮瓣覆盖创面,骨缺损区用抗生素骨水泥(万古霉素)填充缺损及骨折断端,外固定架或钢板内固定,负压引流管充分引流。清创后观察创面愈合情况,如出现复发感染,需再次清除,抗生素骨水泥填充,重复上述过程。
第二阶段手术:确定创面无渗出及窦道等感染征象,且连续复查2~3次血常规,C反应蛋白等感染指标正常后,进行第二阶段手术。根据病人骨缺损情况去除或保留固定,沿原切口或皮瓣周边切开,显露形成的诱导膜,在保护诱导膜完整性前提下将骨水泥小心取出,打通髓腔。将凝血酶溶液与BMSCs浓集液在方盘内混合后静置3~5 min 即形成凝胶样BMSCs,在诱导膜腔内填充凝胶样BMSCs 与自体骨或自体骨与人工骨(上海骁博科技发展有限公司,中国)的混合物,一般自体骨与人工骨比例要大于3∶1,在骨断端骨皮质周围充分植骨后,缝合诱导膜,充分引流,冲洗缝合伤口。术后定期复查X线片,观察骨缺损愈合情况,如果复诊时出现骨折愈合不全或不愈合,则再次取髂骨补充植骨,术后常规自体功能康复。
四、疗效评价
记录所有病人骨折愈合时间及治疗过程中并发症发生情况,并于末次随访时使用Johner-Wruhs 评分标准对骨缺损愈合优良率进行评价。优:骨缺损愈合,无神经血管损伤,无畸形,关节活动范围正常,无疼痛,能够恢复正常工作;良:骨缺损愈合,轻度神经血管损伤,轻度畸形,关节活动范围轻度受限,有时疼痛,正常工作轻度受限;可:骨缺损愈合,中度神经血管损伤,肢体畸形,关节活动范围中度受限,经常有局部疼痛,正常工作严重受限;差:骨缺损未愈合,严重神经血管损伤,肢体严重畸形,关节活动范围严重受限,严重局部疼痛,不能正常工作。
结 果
所有病人随访8~25个月,平均15.5个月。其中16 例一期皮瓣均成活。所有病人骨缺损在术后平均8.3(6~15)个月获得临床和影像学愈合。1 例术后感染复发,重复应用诱导膜技术后愈合。1 例术后12个月时复查显示骨折愈合不全,再次取髂骨补充植骨后愈合。末次随访时采用Johner-Wruhs评分标准评定:优27 例,良2 例,可1 例,优良率为96.7%。典型病例见图1。
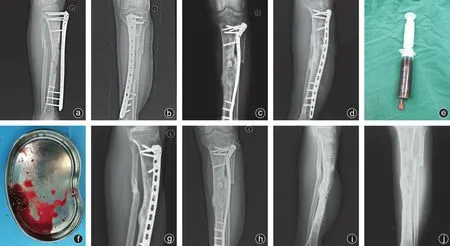
图1 男,32岁,车祸致左胫骨骨折术后感染合并骨缺损 a、b:钢板螺钉固定术后8个月胫腓骨正侧位X线片显示骨折不愈合;c、d:Masquelet技术一期手术,抗生素骨水泥填充术后正侧位X线片;e、f:分离浓缩后果冻样BMSCs标本;g、h:Masquelet技术二期手术,骨水泥取出,BMSCs与自体骨混合植骨术后6个月复查显示骨折愈合良好;i、j:Masquelet技术二期手术后12个月显示骨折愈合,去除钢板内固定
讨 论
2000 年Masquelet 等[5]首次报道采用诱导膜技术治疗35 例4~25 cm 长管状骨骨缺损病人,均取得成功。随后众多学者们开始将此技术应用于修复骨感染、骨肿瘤、创伤等各种原因造成的骨缺损[6-7]。Masquelet技术操作简单、适应范围广、疗效确切,同时具有较强的抗感染能力[8]。与骨移植技术相比,其优势在于不受骨缺损长度限制,适应证更广泛;与Ilizarov 技术相比,其优势在于愈合时间短、并发症少,且病人护理难度相对较低;与带血管蒂骨移植技术相比,其手术不需要显微外科技术,因此手术难度相对较低。随着临床应用增多,许多学者支持诱导膜技术重建骨缺损的临床效果,但同时也报道其存在感染或骨折不愈合的风险[9]。感染或炎症复发常由于创面清创不彻底及围手术期管理不当所致,本组病例回顾分析发现术前根据细菌培养的药敏试验进行围手术期用药,待红细胞沉降率,C反应蛋白等炎性指标接近正常是减少术后感染复发的重要环节。术中彻底清创,切除死骨、无血运骨和硬化骨,放置抗生素骨水泥,采用皮瓣等措施解决创面皮肤覆盖是减少复发的关键环节。术后及时观察及处理创面,同时应用敏感药物是防止复发的重要保证,一旦复发,需重新进行上述过程以确保二期手术成功。本研究严格采用上述步骤,仅1例复发,重复上述过程后治疗成功。
对于感染性骨缺损,感染控制后的另一大难题就是骨缺损的愈合,Masquelet技术的原理是通过第一阶段置入抗生素骨水泥间隔物达到控制感染的目的,同时促使其诱导形成纤维膜,利用诱导膜所富含的生物活性物质环境以及适合骨生长的空间来促进植入骨存活并皮质化从而完成骨缺损的修复[10]。Nau 等[11]在96 只小鼠的对照实验中,发现诱导膜能促进新骨形成,并且加速骨矿物质密度和骨硬度的进展。Yee等[12]也提到诱导膜能够防止移植物再吸收并促进骨质向内生长修复缺损。但Masquelet 技术也存在骨诱导能力有限,骨质塑性相对较慢的问题[13]。如果出现植骨不充分,自体异体骨比例不当等,则容易发生骨折不愈合的情况。因此,国内外专家也一直在寻求缩短治疗周期的方法,或者增强骨的修复质量,帮助病人早日摆脱疾病的困扰,恢复工作和生活。随着人们在干细胞领域研究的不断深入,BMSCs 逐渐开始在骨缺损修复领域被广泛应用[14],自体BMSCs能够在不同的诱导因素下向软骨细胞和成骨细胞转化,具有良好的成骨诱导作用[15]。目前有研究表明,骨形态发生蛋白-2(bone morphogenetic protein 2,BMP-2)、转化生长因子-β2(transforming growth factor-β2,TGF-β2)以及血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)等在促进BMSCs 成骨分化过程中具有协同和诱导作用[16]。而Toth 等[17]通过大鼠实验研究表明Masquelet技术中的诱导膜包含各种生长因子如VEGF,TGF-β和BMP-2。因此,Masquelet 技术也能够更好地诱导BMSCs向成骨细胞转化,从而促进骨缺损愈合。本研究将BMSCs与Masquelet技术相结合,将分离提取的凝胶状的自体BMSCs与自体骨、人工骨结合并填充至诱导膜内,从而在控制感染的前提下,解决骨缺损这一难题,病人骨缺损在术后平均8.3(6~15)个月获得临床和影像学愈合。
笔者认为BMSCs 结合Masquelet 技术治疗感染性骨缺损具有以下优势:①Masquelet技术一期手术能够对感染进行有效控制,形成的诱导膜又能够在二期手术植骨时诱导BMSCs 向成骨细胞转化从而促进骨缺损愈合;②自体BMSCs 取材方便,来源广泛,同时不存在排异反应和伦理问题;③基于BMSCs 的成骨能力,二期植骨时能够一定程度上弥补人工骨诱导骨生成能力有限以及自体骨来源不足的问题,促进骨缺损修复。
本研究存在以下局限性:①由于老年人体内BMSCs 活力及分化成骨细胞能力相对较差,因此本次研究未纳入年龄超过65岁以上病人;②BMSCs技术经济成本相对较高,对于经济状况一般的病人可能无法接受;③本次研究纳入病例数量有限,且因骨缺损部位不同,设置单纯Masquelet技术对照组无法做到基线资料可比,因此对于BMSCs能否促进Masquelet 技术治疗的骨缺损愈合,无法得到具有统计学意义的数据,未来随着样本数量的提升,我们也将对两种方法的疗效进行对照比较,以得出更具临床意义的研究结果;④对于骨髓血采集量的问题,目前临床上尚无统一标准,BMSCs 的浓度对疗效产生的影响仍有待进一步研究;⑤BMSCs 的提取、鉴定以及保存等方面对实验室条件要求较高,基层医院开展该技术受到一定程度的限制。
在治疗过程中,有以下事项需要注意:①实验室提供的生物活性浓集物终产品是无菌的,但是其外包装不能保证运输等过程的无菌,因此不能直接将外包装放在无菌手术台上,需要护士协助医生打开离心管,医生若接触上述外包装表面后,需要更换新手套后,方可继续手术操作。②由于此方法病人需进行包括骨髓血采集在内的多次手术治疗,病人再次感染的风险较高,因此在整个治疗过程中都需要特别注意;③Masquelet 技术二期手术时应当选择合适的固定方式,包括髓内针、钢板内固定等,如骨缺损较大或骨折不稳定者,建议选择外固定架进行固定。
综上所述,我们认为,采用BMSCs 结合Masquelet诱导膜技术治疗感染性骨缺损效果良好,是一种可行的治疗方法。
