含氰废水处理技术进展
2021-10-15晏春华
晏春华
(中国石油化工股份有限公司长岭分公司,湖南岳阳 414012)
含氰废水特指含氰化物的废水。氰化物是一类含碳氮三键(-C≡N)的化合物,氰化物中最普通、常见的物质氰化氢(HCN)是一种带有微苦杏仁味的无色气体或液体。根据与之相连官能团的类别不同,常分为无机氰化物和有机氰化物[1],无机氰化物包括氢氰酸、氰化钾、氰化钠、氯化氰等,有机氰化物一般包括腈类(-C-CN)和异腈(-C-NC)类,如乙腈、丙烯腈和乙胩等。由于氰化物中氰基的剧毒性,因此含氰废水的处理成为工业废水处理领域的重点和难点之一。
1 含氰废水来源及危害
1.1 含氰废水来源及组成
含氰废水主要来源于三种场合,即氰化物生产废水、氰化物利用废水以及其他产品废水。氰化物生产废水主要指生产无机氰化物、有机氰化物产生的废水,如氰化钠生产废水;由于氰根离子(CN-)易与贵金属形成稳定金属氰络合物的特性,氰化物常被应用于电镀、冶金、金属加工等行业[2],因而形成氰化物利用废水,如溶解提取黄金、金属零件加工切削、电镀等产生的含氰废水;其他产品废水主要来源于化工、制药等行业,如农药、医药中间体加工,炼焦、炼钢行业废水、化纤合成、合成氨过程废水等。
由于含氰废水来源不同,因此组成各异。例如,某黄金湿法提取过程中产生的高浓度含氰废水,其总氰化物浓度高达3 340 mg/L,此外还含有大量铜离子,浓度高达1 000 ~ 1 500 mg/L[3];电镀行业常采用高浓度氰化物作为电镀液进行镉、铜和锌的溶解,在漂洗过程中会带出含氰离子以及氰化物络合离子的电镀废水,其中氰化物浓度也高达25 ~ 500 mg/L[2,4];而化工行业产生的含氰废水组成则更为复杂,如在某煤制氢含氰废水中,虽然氰化物浓度为27.5 mg/ L,但同时含有有机胺、无机氨,及其他大分子有机化合物,可生化性极差,处理难度大[5]。
1.2 含氰废水对环境的影响
氰化物对动物的致毒机理主要由于氰根离子的强络合能力[2],例如氰根离子进入人类或动物体内生成HCN后迅速进入血液,与血液中的铁、铜等离子相结合形成稳定的络合物,并进一步抑制细胞色素氧化酶,使之无法吸收血液中的溶解氧,因此导致细胞窒息及死亡。
低浓度的氰化物就会对人类严重的毒害,当空气中氰化氢浓度为0.005 mg/L时,短时间内就会引起人员头痛、心悸等症状;当浓度达到0.1 mg/L以上时,人会在很短时间内死亡。一旦含氰废水进入自然水体,便会对动物及水生生物产生负面影响,例如马一次摄入氰化物的致死量均不足0.5 g,而羊和狗不足0.1 g;当CN-浓度为0.02 ~ 1.0 mg/L时,24 h内便会造成鱼类死亡,因此国家严格限定了渔业水体总氰化物浓度不得超过0.005 mg/L[1]。氰化物对植物的危害同样显著,例如当灌溉水中氰化物浓度为50 mg/L时,小麦和水稻的生长受到显著抑制,且水稻受害更为严重,因此国家对农田灌溉水中氰化物的浓度也作出相应限制。
1.3 含氰废水排放标准
我国现行污水综合排放标准GB 8978—1996中对氰化物的排放浓度进行了限制,要求企业排放废水中氰化物浓度分别为0.5 mg/L(一级标准、二级标准)和1.0 mg/L(三级标准)。针对如电镀、石油炼制、钢铁、制药等特殊行业,国家颁布了相应的行业标准对氰化物的排放进行了要求,如表1所示。

表1 我国各行业不同国家标准中对氰化物的排放要求Tab.1 The emission requirements of cyanide in different national standards of various industries in China
2 含氰废水处理方法
含氰废水的处理主要包括三条途径,分别为氰根回收、氰根转移以及氰根销毁方法,其中氰根回收方法较适合高浓度含氰废水的处理,氰根转移及销毁方法相对适合低浓度含氰废水的处理。
2.1 氰根回收方法
氰根回收方法的目的在于对含氰废水中高浓度CN-的重复利用。对于氰化物浓度超过1 000 mg/L的含氰废水,常采用酸化释放-碱液吸收的方式进行回收,该方法已在采矿、电镀等行业应用多年。
酸化释放-碱液吸收的原理是利用HCN沸点低、易挥发的特性,通过向高浓度含氰废水中加入酸将pH调节至2 ~ 3,温度控制在30 ~ 40 ℃,结合汽提、吹脱等方式使CN-以HCN的形式挥发出来,再通过NaOH溶液进行吸收,生成NaCN。方荣茂[6]研究了酸化法对黄金冶炼厂高浓含氰废水的处理效果,结果表明在酸化pH为2.5,吹脱温度为30 ℃,吹脱气液比为400∶1的条件下,可将总氰化物浓度由1 781 mg/ L降低至82.0 mg/L,去除率>95%,同时还可实现Cu、Zn、Fe等离子的高效同步去除;并通过串联SO2-空气协同氧化工艺,实现氰化物的达标排放,整个工艺对氰的回收率可达80%,具有一定的经济效益。
酸化释放-碱液吸收法虽然对高浓度含氰废水处理效果显著,同时能实现氰的回收利用,但该方法对设备防腐要求高,在吹脱过程中易造成氰化物的泄漏,存在一定的安全风险;而且该工艺对高浓度含氰废水的处理出水不能直接满足排放要求,往往还需串联一步工艺实现氰化物的深度去除。
根据国家以及各行业的环保政策、标准要求,高浓度含氰废水的资源化处理已经成为工业废水处理领域的重要研究方向之一。除了上述提到相对成熟的酸化释放-碱液吸收方法,也有研究提到采用萃取-反萃取、液膜分离等方式进行氰根的回收,但此两种工艺目前尚缺乏规模较大的工业应用案例,仍有待进一步研究。
2.2 氰根转移方法
对于低浓度含氰废水而言,氰化物回收价值并不显著,可通过氰根转移和氰根销毁方法对其进行处理。氰根转移方法是指CN-在处理过程中未发生碳氮化学断键,仍以CN-形式存在,仅发生了相转移(如由水相转移至固相)或浓缩等过程,具体可分为物理转移方法和化学转移方法。
2.2.1 物理法
物理转移方法主要包括吸附法和膜分离法。
2.2.1.1 吸附法
含氰废水的吸附处理常采用为活性炭或改性活性炭作为吸附剂。活性炭具有发达的微孔结构和高比表面积,因此对于去除低浓度含氰废水中的CN-具有良好效果。张玉琴等[7]在研究活性炭吸附处理金矿含氰废水的过程中发现,活性炭对初始总氰化物浓度为389.9 ~ 420.0 mg/L的含氰废水处理效果显著,氰化物去除率达99.8% ~ 99.9%,出水满足排放标准0.5 mg/L,但该研究中活性炭的投加量高达19.7 ~ 26.3 g水/g活性炭,技术经济性较差;牟淑杰[8]通过采用阳离子絮凝剂对活性炭的改性,在12 g/L的活性炭投加量下实现了CN-去除率99%以上(初始CN-浓度为28.7 mg/L),与非改性活性炭相比提升了近30%去除效率;杨明[9]等则发现,通过加入添加剂CaCl2、鼓入空气等方式也可进一步提升活性炭的吸附去除能力,如在活性炭投加量25 g/L、CaCl2投加量0.3 g/L、鼓气量400 L/h的条件下,可将总氰化物浓度由318 mg/L削减至0.4 mg/L,满足排放要求,与不加添加剂、不鼓入空气相比,氰化物去除率提升7.51%。
2.2.1.2 膜分离法
另一种常用的含氰废水物理转移去除方法为膜分离法。膜分离作为重要的分离手段之一,利用其微米、纳米级孔径实现不同组分的分离、纯化或浓缩。徐国伟等[10]利用聚丙烯中空纤维膜构建了CN-的膜吸收体系,即通过具有选择性吸收小分子CN-的分离膜结合膜另一侧的碱液吸收,形成膜两侧CN-的浓度差,促进CN-的扩散和去除。在处理初始CN-质量浓度为1 227.5 mg/L的废水时,80 min可以实现出水CN-浓度<0.5 mg/L,去除率达99.9%。而陈永乐等[11]则采用超滤-反渗透串联工艺对初始氰化物浓度为235 mg/L的镀铬废水进行处理,出水氰化物浓度削减至10 mg/L以下,去除率亦可达95%以上。膜分离处理含氰废水的工艺具有简单、快速、高效等特点,但含氰废水中往往还含有其他多种有机、无机污染物,因此对膜的抗污染性能有很高的要求。
2.2.2 化学法
化学转移方法一般包括络合沉淀法、离子交换法。
2.2.2.1 络合沉淀法
CN-络合能力极强,可以与多种金属离子发生络合反应生成稳定、无毒的金属氰络合物,常采用的金属盐类包括亚铁盐、铜盐。以亚铁盐为例,常采用的盐种类为七水合硫酸亚铁(FeSO4·7H2O),Fe2+会与CN-反应生成不稳定的亚铁沉淀Fe2[Fe (CN)6],并进一步被氧气氧化为稳定的沉淀Fe4[Fe (CN)6]3(普鲁士蓝)。郭雪婷等[3]在处理黄金矿山高浓度含氰废水时,采用硫酸亚铁作为沉淀化学剂,实验结果表明在硫酸亚铁投加量为6.0 g/L的条件下,可以将原水中浓度为850 mg/L的总氰化物降低至45.8 mg/ L,去除率接近95%;硫酸亚铁对于低浓度的氰化物也有一定去除效果[12],研究表明对初始总氰化物浓度为0.95 mg/L的黄金矿山尾矿库淋溶液,在投加0.1 g/ L硫酸亚铁后,30 min可将总氰化物浓度降低至0.2 mg/ L以下。也有研究采用硫酸锌沉淀法去除氰化物,宋永辉等[13]研究了ZnSO4对高铜高铁提金氰化废水的沉淀法去除工艺,结果表明ZnSO4对游离CN-的沉淀率高达99.43%。
沉淀法是一种快速、简单的氰化物去除方法,对高浓度的含氰废水处理效果显著,并且可以通过对生成沉淀的进一步处理实现金属盐类、氰化物的回收。但该方法会消耗大量药剂、产生大量泥渣,易造成二次污染,且产生额外处理处置费用;另一方面,对于高浓度含氰废水的处理,络合沉淀法难以实现氰化物的直接达标处理,因此常作为预处理工艺与其他氰化物去除工艺联合使用。
2.2.2.2 离子交换法
离子交换法是去除废水中离子的常用方法。对于CN-的去除而言,其原理是利用废水与强碱性阴离子交换树脂的吸附,实现废水中CN-、硫氰化物(SCN-)及其他含CN-金属络合阴离子与OH-的交换。巩春龙等[14]使用LSD-263型阴离子交换树脂处理总氰化物浓度为1 394.67 mg/L的高浓度废水,经过三段离子交换处理后(40 mL树脂/400 mL水),出水氰化物质量浓度降低至41.63 mg/L;在处理低浓度含氰废水时,可将初始浓度为243.03 mg/L的总氰化物浓度降低至1.04 mg/L。
离子交换树脂对CN-的饱和吸附量一定程度上决定了含氰废水的处理效果。当树脂吸附CN-饱和后,需对其进行碱液(如NaOH溶液)洗脱再生,同时对再生液中的NaCN及其他金属离子进行回用。离子交换法是快速有效去除CN-的工艺,也可实现资源回收及利用,同时吸附处理之后的出水可进一步循环使用,提升了污水回用比例;然而,离子交换树脂的机械强度、吸附容量以及吸附选择性仍有待进一步加强。
2.3 氰根销毁
氰根销毁方法与氰根转移方法不同,主要指的是CN-离子发生C≡N键断裂,生成无毒或低毒的含N有机物或无机物,实现CN-的去除。处理方法主要包括化学销毁法和生物销毁法,处理对象一般为CN-浓度较低的废水。
2.3.1 化学法
2.3.1.1 碱性氯化法
碱性氯化法又称氯碱氧化法,是一种应用久远、工艺成熟的化学除氰方法。其原理是利用含氯氧化物(如次氯酸钠、二氧化氯、液氯、漂白粉等)的氧化性,在碱性条件下(pH>11)先将含氰化合物氧化、水解为毒性较低的氰酸盐(CNO-),再进一步(pH ≈ 8.5)被氧化为无毒的碳酸氢盐和氮气,其发生的主要化学反应如下:
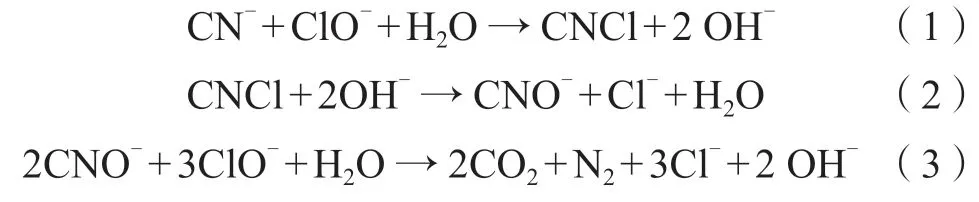
王洋等[15]研究了碱性氯化法对1 250 m3某金矿遗留废水中氰化物的去除效果,在采用二氯异氰尿酸钠(有效氯含量50%)作为氧化剂时,可将废水中氰化物浓度由88.97 mg/L削减至0.368 mg/L,去除率高达99.6%,该研究处理时间共计28 d,投加氧化剂量共计6 t;张忠元[16]采用次氯酸钠作为氧化剂,以碱性氯化法作为二级串联工艺,处理絮凝络合单元的含氰废水出水,结果表明对初始浓度为29.6 ~ 40.5 mg/L的含氰废水处理效果显著,出水氰化物浓度可稳定削减至0.5 mg/L以下。
碱性氯化法设备简单、反应形式多样,处理效率高,可实现氰化物达标排放。但由于该方法需要投加大量含氯氧化物,处理过程中会产生大量余氯,易造成设备腐蚀,因此对设备的材质要求较高。
2.3.1.2 过氧化氢氧化法
过氧化氢法也是常用的氰化物化学氧化方法,在碱性条件下(pH为9.5 ~ 11.0)利用Cu2+或甲醛作为催化剂,可将CN-氧化为CNO-,并进一步水解为和CO32-,其化学反应过程如下:

陈发上[17]等研究了过氧化氢对氰化物的氧化去除效果,结果表明在过氧化氢投加量为2.0 ml/L时(30%过氧化氢),可将含氰尾矿浆液中总氰化物浓度由105.12 mg/L削减至5 mg/L以下;周珉[18]等则发现在铜离子作为催化剂的条件下,可在1 h内将初始浓度为874 mg/L的总氰化物氧化去除至21.0 mg/L。
过氧化氢氧化法对含氰络合物的处理也有一定效果。碱性条件下,当络合物中的CN-被氧化去除后,铁、铜、锌等金属离子会进一步生成氢氧化物沉淀,因此该方法有利于金属离子的同步去除。过氧化氢法是简单快速、副产物安全的化学氧化方法,但常受限于过氧化氢在运输、存储、使用过程中的安全性。
2.3.1.3 高级氧化法
高级氧化技术是利用具有强氧化性自由基的氧化作用,实现目标污染物的氧化降解和去除。对于含氰废水处理而言,常采用的高级氧化技术包括臭氧氧化、臭氧催化氧化、紫外光催化、Fenton氧化等。
臭氧是一种强氧化剂,其氧化电势为2.07 V,可以直接与CN-发生反应生成CNO-,并进一步被氧化为N2和碳酸盐。但由于臭氧直接氧化工艺中臭氧利用率有限,处理深度不足,因此常通过与催化剂的协同,产生其他具有强氧化性的自由基(如羟基自由基·OH),从而实现CN-的深度去除。尚会建[2]通过构建臭氧/活性炭的非均相催化氧化体系,在活性炭用量为10 g/L,臭氧浓度为9.4 mg/L条件下,实现了99.8%的氰化物去除率,同时验证了活性炭与臭氧对除氰的协同效应;李鹏程[19]则通过制备负载CuO、MnO2及MnO2/K2O的γ-Al2O3催化剂,实现了含氰污水中氰化物的高效去除,其中以MnO2为催化剂时,在20 min内的氰化物去除率高达96.64%。
紫外光(UV)催化也是常见的高级氧化技术,其主要通过结合均相、非均相催化剂构建间接光解反应体系,利用生成的自由基实现污染物的高效去除。谭克锋[5]采用UV/NaClO、UV/H2O2工艺处理低浓度含氰废水,结果表明当H2O2投加量为5 mL/L时(30%H2O2),可将CN-降低至1.7 mg/L;薛文平[20]证明了UV/TiO2体系下氰化物的有效去除,结果显示在TiO2投加量为0.25 g/L的条件下,经过150 min UV光照后可将14.81 mg/L氰化物降低至0.5 mg/L以下。除了UV构建的传统均相、非均相光催化反应体系外,也有许多学者开发了新型催化剂用于含氰废水的处理,如ILs-TiO2催化剂[21]、纳米TiO2-SnO2介孔材料[22]等,同时也将光源由UV紫外光拓展至可见光。
Fenton氧化是一种传统的高级氧化技术,通过利用Fenton试剂(过氧化氢、亚铁盐)生成的·OH实现CN-的氧化降解。范文玉[23]在研究高浓度含氰废水的过程中发现,当n(H2O2)∶n(Fe2+)为20时,可将絮凝出水中8 mg/L的CN-进一步去除,实现出水CN-浓度小于0.02 mg/L。
高级氧化技术对于CN-的去除机理基本类似,大多利用体系内产生的·OH与CN-反应,首先生成CNO-,再进一步水解为NH4+或氧化为N2,因此高级氧化技术对于低浓度CN-的销毁去除是相对绿色的处理工艺。也有其他学者研究了多种高级氧化技术串联对含氰废水的处理效果,如UV-臭氧-活性炭联用[24]、UV/Fenton[25],处理效果较单独工艺而言更为显著。高级氧化技术反应速度快,产物无毒害,但由于·OH的无选择性导致废水中氰化物的去除效率不高,因此近年来也有学者研究了其他自由基对含氰废水的处理效果[26]。
2.3.2 微生物法
虽然氰化物是剧毒物质,但有研究表明,存在某些微生物可以利用氰化物作为生长繁殖的碳源和氮源,在代谢过程中将CN-脱毒,转化为二氧化碳、氨或甲酸、甲酰胺等,实现含氰废水的处理。刘强等[27]研究了生物降氰的实验条件,结果表明降氰菌在pH= 7、温度28 ℃、接种量50%、葡萄糖投加量l g/L、牛肉膏投加量1 g/L时,62 h可将100 mg/L的氰化物降低至0.5 mg/L以下。
微生物法也是绿色的除氰工艺,但生化单元停留时间较长,且对工艺控制精度要求较高,氰化物降解菌对污水水质波动的适应性较差,因此较适用于来水稳定的场合。
3 含氰废水处理技术展望
氰根回收、氰根转移和氰根销毁是含氰废水处理的三条主要途径。在针对不同来源含氰废水选择相应的处理技术时,应依据废水水质及处理去向而定。
对于高浓度含氰废水(如氰化物浓度大于1000 mg/L)的处理,应首先考虑氰根回收的可行性,酸化释放-碱液吸收是相对成熟的氰化物回收技术,但处理后废水中的高浓度SO42-以及设备的防腐是需要重点考虑的问题。
对于氰根回收处理后、或它来源的低浓度含氰废水(如氰化物浓度几十 至 几百 mg/L)处理,氰根的再次回收成本过高,因此选择氰根转移和销毁较适宜。由于含氰废水水质复杂,单级的处理工艺往往难以达到深度除氰的目的,因此“转移+销毁”的串联工艺可能为低浓度含氰废水的最优处理方案。转移作为预处理工艺去除低浓度含氰废水中的大量氰化物,销毁作为保障性工艺实现氰化物的深度去除和达标排放。
在众多转移方法中,优选膜分离、离子交换法,其原因一方面在于化学沉淀、活性炭吸附等方法需要投加大量化学试剂和吸附剂,处理过程中不可避免地产生二次污染;另一方面在于,膜分离和离子交换树脂可以通过对膜和树脂的改性,加强其对氰化物去除的选择性。对于氰根销毁工艺的选择,碱性氯化、过氧化氢氧化法去除精度有限,且要实现氰化物达标排放需消耗大量试剂;微生物法驯化周期长,且处理效率易受水质波动;高级氧化法反应快速、去除精度高,且可通过调控反应体系中自由基的种类和组成提高氰化物去除的选择性。因此,对于低浓度含氰废水,采用“膜分离/离子交换+高级氧化”的工艺可以实现其达标、脱毒、无害化处理。
