花楸树热激蛋白SpHSP70-2基因的克隆及表达分析
2021-10-14赵冬雪刘聪聪鲁仪增常金财
赵冬雪,刘聪聪,鲁仪增,常金财,郑 健*
(1.北京农学院 园林学院,北京 102206;2.山东省林木种质中心,山东 济南 250102;3.呼伦贝尔市林业科学研究所,内蒙古 呼伦贝尔 021008)
热激蛋白是一种普遍具有抗逆作用的保护蛋白,是植物生长发育过程中必不可少的一种蛋白质,在植物处于逆境下发挥其重要的调控作用[1]。根据相对分子量,热激蛋白分为HSP100、HSP90、HSP70、HSP60和sHSP等5大家族[2],而HSP70作为分子伴侣在植物中含量最多,所发挥的作用也非常重要,在响应非生物胁迫方面表现最为显著[3]。HSP70被认为是最具保守性的一类热激蛋白家族,在植物遭受非生物胁迫时,不同的HSP70所行使的功能和机制不尽相同,这与HSP70定位于细胞体内的位置有关,如细胞质中的HSP70可以阻止蛋白质聚集,帮助蛋白折叠,维持前体蛋白结构,而线粒体和叶绿体中的HSP70则可以参与前体蛋白的输入和易位[4],另外在内质网中还有一类HSP70家族成员——内质网分子伴侣蛋白(BiP,Binding Protein),该蛋白可以与进入内质网与未折叠的蛋白相互结合,帮助其正确折叠或聚合,同时也参与内质网相关联的蛋白质降解过程[5]。研究发现,细胞质和线粒体中的HSP70基因容易受到高温诱导,而内质网和叶绿体中的HSP70基因相比之下不易受到高温影响[6]。除此之外,HSP70基因参与植物不同发育阶段的调控及在一些代谢过程中起重要的作用[7]。HSP70基因主要受到热激转录因子(Hsf,heat shock transcription factor)调控,Hsf与热激响应元件(HSE,heat shock elements)结合,启动热激蛋白基因表达,这些Hsf将选择性地转录更多的HSP70[8]。大量研究已经证明植物HSP70基因的表达与植物获得的耐热性呈显著正相关性[9],如南瓜(Cucurbitamoschata)热激蛋白CmHSP70-5基因受到高温胁迫的诱导,在一段时间内,温度越高,表达量越高[10];在巴西橡胶树(Heveabrasiliensis)中发现HSP70家族基因,HbHSP70-1和HbHSP70-2在高温胁迫下受到诱导表达,6 h后达到峰值[11]。蜡梅(Chimonanthuspraecox)作为木本植物,与拟南芥(Arabidopsisthaliana)中HSP70基因表达模式相似,CpHSP70-1基因受到高温胁迫表达增强,但其受高温诱导更为显著[12]。对耐热与不耐热的月季品种HSP70表达模式的研究发现,不耐热的月季品种HSP70弱表达或不表达,耐热品种HSP70为强表达,表明该基因在月季品种中能够受到高温诱导并提高其耐热性[13]。由此说明,HSP70与植物耐热性密不可分,热胁迫下,植物通过诱导HSP70基因表达来应对高温带来的不利影响,主动适应不良的热环境。
花楸树(Sorbuspohuashanensis),又名百花花楸,为蔷薇科(Rosaceae)花楸属(Sorbus)落叶小乔木,具有很高的园林观赏价值,但花楸树引种到低海拔地区面临着严峻的夏季高温环境胁迫,影响正常生长及其观赏价值[14]。植物长时间受到高温影响会导致叶色发黄、变褐,严重时产生灼伤,内质网、高尔基体、叶绿体、线粒体等内膜系统也会受到破坏,主要表现为膜透性增强和电解质外渗等[15-16],同时活性氧的大量积累造成细胞内氧化胁迫的出现,最终引起大分子甚至生物体的损伤[17]。早期关于花楸树响应高温胁迫的研究主要集中于生理生化方面,彭松等[18]分析了花楸树应对高温胁迫下的生理响应,证明花楸树受到高温伤害的表现与其他植物基本一致,主要表现在叶绿体超微结构、保护酶系统、细胞膜系统以及光合系统都受到不同程度的破坏,花楸树幼苗主要以热耗散的形式来避免光合系统遭受高温的破坏。刘聪聪等[19]从花楸树中分离出SpHSP70-1基因,并对其功能进行了初探[19]。本研究采用分子生物学技术、生物信息学分析方法,克隆得到花楸树热激蛋白SpHSP70-2基因,并对其编码的蛋白质特性与功能进行预测,然后对其组织特异性表达和在热胁迫下的表达模式进行了分析,以期为今后花楸树响应非生物胁迫研究提供基础。
1 材料与方法
1.1 材料与处理
所采用的花楸树材料种植在北京农学院花楸种质资源圃中。选取其中3个家系,每个家系3株,挑选生长状况良好、长势一致、无病虫害的2年生实生苗,置于人工气候培养箱中,光照强度80%,进行42℃高温胁迫处理,处理时间分别为0、0.25、1、2、6、12、24 h,处理结束后取叶片,液氮冷冻后置于-80℃超低温冰箱中保存备用。家系混合后样品作为1个生物学重复,重复3次。
选取2年生在自然生境下生长的嫁接苗3株,未经高温胁迫处理,分别于2017年3月20日采集其幼叶和茎(1年生枝条的顶部第1和第2节间部分)、3月30日取花蕾、初花(花瓣尚未完全展开)、4月20日起依次取盛花(花瓣完全展开,雌雄蕊成熟)、末花(花瓣褐化,萎蔫)、5月20日取成熟叶和根、10月初取成熟果实,根的材料采自于2年生实生苗,液氮速冻后放入-80℃超低温冰箱中备用。
本试验中的EASYspin Plus多糖多酚复杂植物RNA快速提取试剂盒采购于北京艾德莱生物技术有限公司;反转录试剂盒TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix,切胶回收试剂盒EasyPure Quick Gel Extraction Kit,质粒提取试剂盒EasyPure Plasmid MiniPrep Kit,Trans2K Plus DNA Marker、2×EasyTaq PCR SuperMix、氨苄青霉素(Amp,Ampicillin)(50mg/mL)等生物试剂均采购于北京全式金生物科技有限公司。
所有引物合成和测序均由北京三博志远生物技术有限公司完成。
1.2 总RNA的提取及第一链cDNA的合成
参照刘聪聪等[19]的方法使用EASYspin Plus多糖多酚复杂植物RNA快速提取试剂盒提取花楸树总RNA,经琼脂糖凝胶电泳检测合格后,参照反转录试剂盒TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix的说明进行反转录,合成第一链cDNA。
1.3 SpHSP70-2全长cDNA序列克隆
对花楸树叶片转录组数据进行分析后[20],经NCBI网站BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)工具比对后,获得1条全长序列且与热激蛋白70基因相似的基因,根据基因序列设计克隆引物:上游引物“SpHSP70-2F”、下游引物“SpHSP70-2R”(表1),以花楸树cDNA为模板进行PCR扩增,PCR反应总体系为20 μL,其中包括模板1 μL,2×EasyTaq PCR SuperMix 10 μL,10 μM正向和反向引物各 0.4 μL,ddH2O 8.2 μL。将产物纯化回收后与pEASY®-T1载体连接并测序验证。
1.4 花楸树gDNA提取及SpHSP70-2基因结构分析
以花楸树叶片为材料,采用CTAB法进行gDNA提取。参照上述反应体系,以gDNA为模板、上述克隆引物进行PCR扩增,扩增产物经切胶回收,与pEASY®-T1载体连接并测序验证。比对SpHSP70-2的gDNA序列与cDNA序列,分析其基因结构。
1.5 SpHSP70-2生物信息学分析
利用软件DANMAN 8.0把碱基序列翻译成氨基酸序列,通过ProtParam工具(https://web.expasy.org/protparam)进行理化性质分析。在NCBI protein blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)上对氨基酸序列进行比对,在软件DNAMAN 8.0中绘制蛋白同源性多序列比对图,利用软件MEGA 7构建HSP70的进化树。利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)预测花楸树SpHSP70-2的二级结构;利用ProtScale(https://web.expasy.org/cgi-bin/protscale)在线网站预测蛋白亲疏水性;利用SignalP(http://www.cbs.dtu.dk/services/SignalP-4.1/)预测蛋白信号肽;利用TMpred (https://embnet.vital-it.ch/software/TMPRED_form.htmL)在线网站预测跨膜结构;利用PSORT(https://www.genscript.com/tools/psort)预测其亚细胞定位。
1.6 SpHSP70-2荧光定量表达
以高温胁迫的花楸树叶片以及各组织器官的cDNA为模板,据SpHSP70-2的cDNA全长设计荧光定量引物:上游引物“SpHSP70-2Qf”、下游引物“SpHSP70-2Qr”(表1),以花楸树β-actin基因为内参基因,参照试剂盒TransStart Top Green qPCR SuperMix进行表达分析,每个胁迫点技术重复3次。PCR反应总体系为20 μL,其中包括模板2 μL,2×TransStart Top Green qPCR SuperMix 10 μL,10 μM正向和反向引物各 0.4 μL,ddH2O 7.2 μL。PCR反应程序设置:94℃预变性30 s;94℃变性5 s,58℃退火15 s,72℃延伸10 s,40个循环;定量结果用2-ΔΔCT方法分析[21-22],采用SPSS 15.0软件进行单因素方差分析。
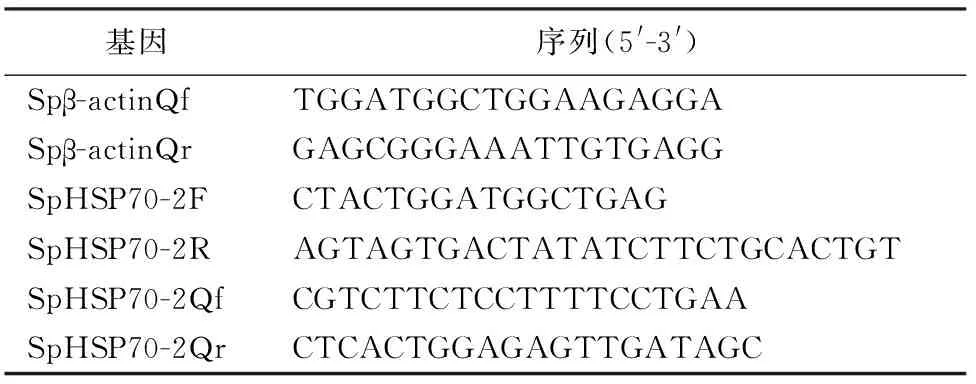
表1 试验中所用的引物Table 1 Primer sequences used in this study
2 结果与分析
2.1 花楸树SpHSP70-2基因克隆、结构与cDNA序列分析
为验证基因序列的准确性,以花楸树叶片cDNA为模板进行PCR扩增反应,经琼脂糖凝胶电泳后,纯化回收产物并连接到pEASY-T1载体上测序,测序结果与转录组测序结果一致,经NCBI ORF Finder分析表明,该序列包括1 704个碱基,编码567个氨基酸,属于热激蛋白70家族基因,故将该基因命名为SpHSP70-2(图1)。以花楸树叶片gDNA为模板,经PCR扩增反应后,纯化回收产物并连接载体后测序,将测序结果与cDNA的ORF序列进行比对,结果显示SpHSP70-2的DNA全长为1 704 bp,无内含子。

采用NCBI和InterPro网站结构域分析,结果表明SpHSP70-2氨基酸序列包含3种结构域(图1A),分别是核苷酸结合位点(NBD,nucleotide binding site),共有26个;底物结合域(SBD,substrate binding domain),共11个;核苷酸互换因子/热激蛋白70互作位点 (putative NEF/HSP70 interaction site),共14个。主要结构域为HSP70蛋白家族的核苷酸结合域,跨度为第29个氨基酸至第405个氨基酸。经InterPro分析得知,SpHSP70-2蛋白在氨基酸415~529处为热激蛋白70肽结合域超家族(Heat shock protein 70 ku,peptide-binding domain superfamily)。
2.2 SpHSP70-2生物信息学分析
2.2.1 蛋白的基本特性 根据所获得的氨基酸序列,采用ProtParam在线软件分析其理化性质,结果表明SpHSP70-2的等电点(PI)为5.41,分子量(WM)为61.01 ku。氨基酸组分中,数量最多的为Leu(54),Val(53),Ala(48),Ser(47)和Gly(42);数量较少的有Phe(15)、His(12)、Tyr(10)、Cys(9)以及Trp(3),正电荷残基(Arg+Lys)总数为48,负电荷残基(Asp+Glu)总数为62,不稳定系数为36.39,属于稳定蛋白。总平均亲水性为0.067,推测该蛋白为疏水性蛋白。亚细胞定位预测结果显示,SpHSP70-2蛋白定位于细胞质中,可信度为89%,推测其可能在细胞质发挥作用。经SOPMA软件二级结构在线分析,SpHSP70-2中:ɑ螺旋包含185个氨基酸残基,延伸链包含132个氨基酸残基,β转角包含41个氨基酸残基,随机卷曲链包含209个氨基酸残基,分别占总氨基酸残数的32.63%、23.28%、7.23%和36.86%。
2.2.2 蛋白亲疏水性预测 利用ProtScale软件预测氨基酸序列的亲疏水性,疏水性氨基酸最大值为+2.822,亲水性氨基酸最小值为-2.356,正值越大代表蛋白质疏水性越强,负值越大代表蛋白质亲水性越强,介于+0.5~-0.5的表示为无明显亲疏水性区域,由此推断SpHSP70-2的亲水性和疏水性氨基酸分布较为均匀,总体上疏水性区域略多于亲水性区域(图2)。
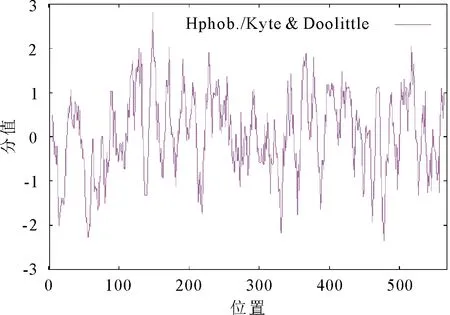
图2 SpHSP70-2蛋白疏水性预测Fig.2 Protein hydrophobicity prediction of SpHSP70-2
2.2.3 蛋白跨膜结构预测及信号肽分析 通过在线软件TMpred (https://embnet.vital-it.ch/software/TMPRED_form.htmL) 对SpHSP70-2蛋白的氨基酸序列进行跨膜结构域的预测,分析可知,SpHSP70-2蛋白可能有11个跨膜螺旋,大部分位于中心区域,由内向外的跨膜螺旋有6个,分别位于:27~43,113~132,227~252,232~258,413~431以及508~535。由外向内的跨膜螺旋有5个,分别位于:27~51,113~133,224~246,359~381,392~410。其中得分最高的两个跨膜螺旋分别位于113~133,由外向内;227~252,由外向内(图3)。使用SignalP软件预测蛋白信号肽,结果显示,Y-MAX为0.106,C-MAX为0.111,S-MAX为0.115,均<阈值0.5,表明该蛋白不属于分泌蛋白。
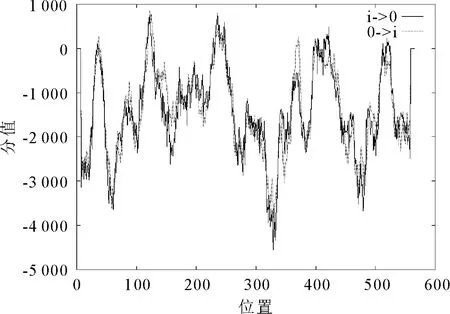
图3 SpHSP70-2蛋白跨膜结构预测Fig.3 Protein transmembrane structure prediction of SpHSP70-2
2.2.4 SpHSP70-2同源性比对 将SpHSP70-2基因编码蛋白氨基酸序列在NCBI blast分别进行同源比对,挑选同源性较高的物种,比较分析发现,SpHSP70-2与苹果(Malusdomestica,MdHSP70,XP_008364887.2,95.65%)和白梨(Pyrus×bretschneideri,PbHSP70,XP_009344090.1,95.13%)的同源性最高,与桃(Prunuspersica,PpHSP70,XP_007225647.1,89.39%)和梅(Prunusmume,PmHSP70,XP_008224540.1,88.87%)的同源性较高,与巨桉(Eucalyptusgrandis,EgHSP70,XP_010024339.1,79.48%)、可可(Theobromacacao,TcHSP70,XP_007034742.2,80.00%)、胡杨(Populuseuphratica,PeHSP70,XP_002311619.1,79.65%)、雷蒙德氏棉(Gossypiumraimondii,GrHSP70,KJB38127.1,78.61%)、枣(Ziziphusjujuba,ZjHSP70,XP_015888210.1,80.52%)的同源性较低(图4)。

图4 花楸树SpHSP70-2蛋白与其他物种的HSP70蛋白同源序列比对Fig.4 Homology sequence alignment of SpHSP70-2 in S.pohuashanensis compared with those of other plants
2.2.5 SpHSP70-2系统发育树的建立 在同源性比对的结果上,利用MEGA 7构建系统发育树,发现SpHSP70-2首先与蔷薇科苹果亚科苹果属的苹果和梨属的白梨的热激蛋白70聚合在一起,再与蔷薇科李属的桃、梅的热激蛋白70聚合,最后再与其他科植物的热激蛋白70聚合(图5)。
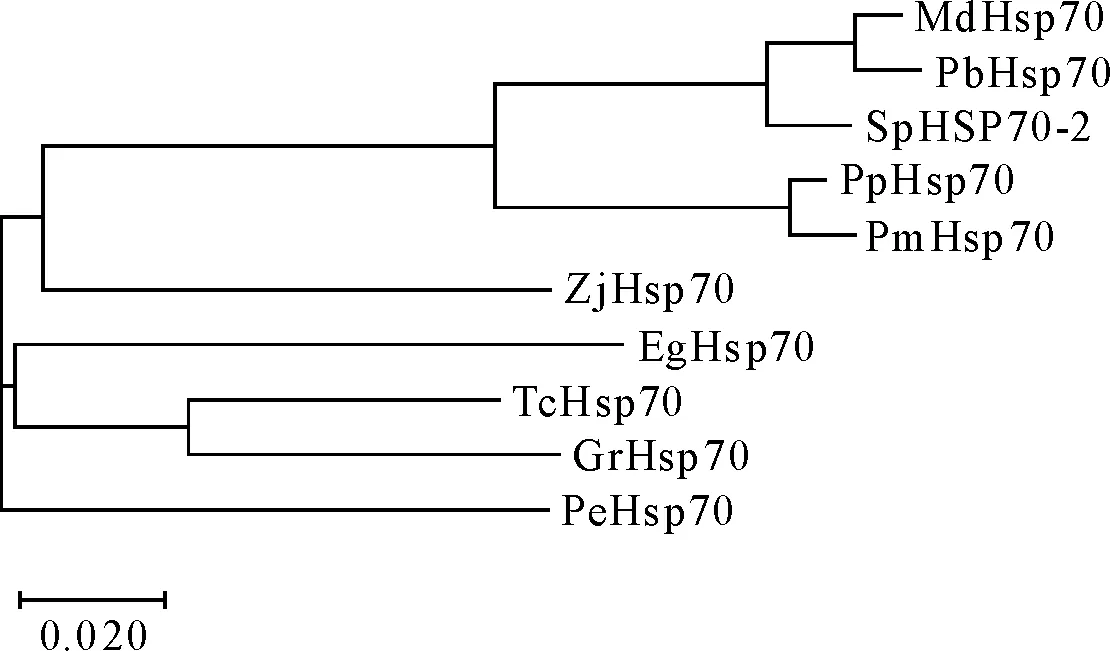
图5 基于氨基酸序列SpHSP70-2编码蛋白与其他植物HSP70蛋白序列进化树Fig.5 Phylogenetic tree analysis of SpHSP70-2 protein in S.pohuashanensis compared with those of other plants based on the amino acid sequence
2.3 SpHSP70-2组织特异性表达及响应高温胁迫表达分析
2.3.1 组织特异性荧光定量表达分析 为探究SpHSP70-2在不同发育时期的器官的表达情况,取其幼叶、成叶、花蕾、初花、盛花、末花、果、茎、根的材料进行qRT-PCR检测。发现SpHSP70-2在花楸树的果实中表达量最高,其次为茎、根,在初花期、盛花期、末花期等花期的表达量较少(图6)。

注:YL:幼叶,ML:成叶,BD:花蕾,IA:初花,MA:盛花,EA:末花,FT:果,SM:茎,RT:根。不同字母表示差异极显著(P<0.05)。下同。图6 SpHSP70-2组织特异性表达模式Fig.6 Relative expression of SpHSP70-2 at different phases and positions
2.3.2 42℃胁迫处理荧光定量表达分析 为探究SpHSP70-2响应热胁迫的表达模式,利用qRT-PCR技术检测高温胁迫处理不同时间下花楸树叶片中SpHSP70-2的表达量,结果表明,SpHSP70-2表达量在0.25 h时,达到对照组的26倍,在胁迫处理1 h后,表达量增至对照组的241倍,2 h时表达量达到极值,即对照组的375倍,随后表达量略缓慢下降,胁迫处理24 h时,表达量降低为对照组的165倍(图7)。

图7 42℃高温胁迫下花楸树叶片中SpHSP70-2表达情况Fig.7 Expression of SpHSP70-2 in S.pohuashanensis leaves under 42℃ high temperature stress
3 结论与讨论
依托花楸树叶片转录组数据,分离得到SpHSP70-2,该基因开放阅读框全长为1 704 bp,编码567个氨基酸,该基因全部由外显子构成。HSP70家族由持续的核苷酸结合结构域(NBD),底物结合结构域(SBD)和大小分别为44、18 ku和10 ku的可变C末端帽组成,C末端帽的可变性有助于帮助SBD结构域结合底物[23]。经蛋白保守结构域分析后,结果表明SpHSP70-2均具有NBD和SBD结构域(图1),这符合HSP70蛋白的特征。研究表明,编码不同细胞结构的HSP70基因含有的内含子数量不同,细胞质中的HSP70基因通常没有或只含有1个内含子,而编码细胞器HSP70的基因具有多个内含子[24],本试验发现SpHSP70-2不含内含子,且存在跨膜区域,无信号肽,是一种稳定的疏水性蛋白,推测其可能编码细胞质HSP70蛋白,与PSORT软件亚细胞定位预测结果一致,其功能可能与植物受到逆境胁迫时调节细胞膜透性、作为分子伴侣参与蛋白的跨膜运输、阻止蛋白聚集、帮助蛋白折叠和维持蛋白质特定空间结构等有关[4]。本试验中同源性分析发现SpHSP70-2与苹果、白梨、桃、梅等同科的植物的HSP70同源性高,大部分同源性达到90%以上,且结构域较为保守的部分集中出现在N端(图4);SpHSP70-2与其他植物同源蛋白的系统发生树结果与同源性分析一致,进一步表明花楸树与同亚科的苹果、梨的亲缘关系更近(图5)。
在花楸树不同器官的不同发育时期检测SpHSP70-2的表达(图6),发现SpHSP70-2在果实中表达量最高,在花楸树的根和茎中,SpHSP70-2有较高表达量,在花楸树的花器官中,SpHSP70-2的表达量最低。通过反义技术在烟草(NicotianatabacumL.)中抑制NtHSP70基因的表达时,采用转基因植株的枝条进行扦插,发现插条的根形成受损,表明NtHSP70在根的形成中起作用[25]。由此推测,SpHSP70-2可能在花楸树根的形成或者功能方面扮演着一定的角色,这与之前在花楸树发现的SpHSP70-1基因的功能有相同之处[19]。蜡梅(Chimonanthuspraecox)的试验结果表明,CpHSP70-1在开花过程中,持续性地高水平在花器官中表达[12];紫花苜蓿(Medicagosativa)的研究也表明MsHSP70在花中的表达量最高[26]。然而我们的结果与之相悖,这可能说明,SpHSP70-2在调节花楸树的生长过程中,并不过多参与花器官的发育,而SpHSP70-2在花蕾中的表达较初花和盛花时期偏高,则可能是该基因参与了花楸树花分生组织的形成过程。关于甜橙HSP70家族基因在不同组织表达量的研究发现,该基因家族在果实中表达水平明显高于愈伤组织、花和叶的表达水平[27]。本研究结果亦是如此,SpHSP70-2在果实中表达水平高于其他组织的表达水平,这可能说明SpHSP70-2更多地参与果实的形成及发育过程当中。巴西橡胶树的研究表明HbHSP70基因在花器官中的表达量很低[11]。研究发现,SpHSP70-2除果实外在叶片中表达过高,在花器官中同样表达量很低,这可能说明,SpHSP70-2在调节花楸树的生长过程中,并不过多参与花器官的发育,也许更多的参与到叶片的发育和功能维护进程中,这也间接说明HSP70的表达与其编码蛋白的定位影响其功能的发挥,即在不同的植物组织器官间存在特异性表达[28]。
本研究中,42℃胁迫处理花楸树1 h,SpHSP70-2在叶片中的表达量骤增至未胁迫时的241倍,2 h时表达量达到极值,而后开始下降(图7)。当植物处于高温环境(37℃~45℃)下,绝大多数植物的HSP70基因都会在0.5~2 h后被大量迅速地诱导表达,在拟南芥中,40℃处理0.5~1 h,多数HSP70基因的表达量达到最大,有20倍之多[29-30]。42℃处理蜡梅1 h,HSP70基因表达量也达到最高,将近10倍[12]。研究结果发现SpHSP70-2在42℃胁迫处理0.25 h后,表达量便已经提高26倍之多,尽管与大部分植物相同,该基因在1 h后其表达量骤增至200倍之多,但是花楸树的SpHSP70-2相比于其他植物的HSP70基因,更加明显地展现出了一种瞬时耐热保护分子机制,说明SpHSP70-2基因的表达更容易受到高温诱导,短时间内SpHSP70-2可以大量表达并且发挥抵抗高温胁迫的功能,这可能与其编码细胞质HSP70蛋白有关,有研究发现,编码细胞质的HSP70基因对于提高植物抗逆性有一定作用,这一理论支持了上述结果[31]。南瓜中HSP70基因在42℃处理3 h后表达量最高,为初始量的1 800倍之多[10];巴西橡胶树HSP70基因在6 h后达到峰值,其中HbHSP70-1基因在0~24 h内呈现先升高再降低的趋势,而HbHSP70-2在0~12 h先升高再降低,在24 h的时候出现回升趋势且超过了6 h的丰度[11]。与试验结果相比,不同植物间出现了HSP70基因达到表达量峰值时间的差异,但是花楸树的SpHSP70-2的表达水平变化的整体趋势与HbHSP70-1存在着相同之处,在2 h达到峰值过后,SpHSP70-2表达量开始下降,造成这一现象的原因可能是由于非生物胁迫,例如高温会造成植物次生胁迫,渗透压胁迫或氧化胁迫,此时结构蛋白、功能蛋白及膜蛋白就会造成损伤,从而信号转导开始,转录因子控制开启胁迫相关基因的表达,如HSP70的大量表达,其编码的热激蛋白发挥功能,胞内蛋白及膜蛋白受到保护,最终细胞动态平衡得以维持[32-33],而温度过高,胁迫时间过长,酶系统使得HSP70表达量不再增加,失去分子伴侣的作用[34],HSP70基因的表达量开始呈下降趋势。尽管与HbHSP70-2表达水平变化的整体趋势不同,但我们认为这是由于物种本身的一种独特的耐热机制所造成的差异,说明HSP70家族在进化的过程中由于自然选择导致了不同物种间HSP70基因功能的差异,尽管花楸树与其他植物的表达模式存在一定的异同,但是我们不能否定SpHSP70-2与花楸树的瞬时耐热保护机制方面存在密切关系,在提高花楸树抵御夏季高温胁迫时发挥一定作用。
