miR-27a靶向KIF3A基因调控LPS刺激牙髓细胞增殖及凋亡的分子机制
2021-10-14陈秋迎陈迅
陈秋迎 陈迅
(泉州市第一医院口腔科,福建 泉州 362000)
牙髓炎是指由细菌及其产物等引发的牙髓组织炎症反应,研究表明牙龈卟啉单胞菌作为革兰阴性厌氧杆菌可促进牙髓及根尖周感染从而诱发牙髓炎〔1,2〕。脂多糖(LPS)可促进牙髓感染根管内炎性因子表达从而参与牙髓炎发生过程〔3,4〕。
目前关于牙髓炎发生机制尚未完全阐明,因而深入探究牙髓炎发生发展机制有助于降低发病率及提高治疗效果。微小RNA(miR)-27a-3p在LPS诱导人牙髓细胞中呈高表达并可能促进炎症反应的发生〔5〕。miR-27a可抑制牙髓干细胞增殖、迁移及分化〔6〕。TargetScan预测显示驱动蛋白2家族蛋白(KIF)3A可能是miR-27a的靶基因,研究表明KIF3A表达量与牙间充质干细胞/前体细胞成骨分化有关〔7〕。本研究通过LPS诱导人牙髓细胞(hDPC),探讨miR-27a对hDPC增殖、凋亡及其分泌炎症细胞因子的影响,分析其与KIF3A的靶向作用关系。
1 材料与方法
1.1材料与试剂 LPS购自欣博生物科技有限公司;Ⅰ型胶原酶、青-链霉素双抗均购自美国Gibco公司;Trizol试剂与Lipofectamine2000购自美国Invitrogen公司;反转录试剂盒与SYBR Green荧光染料均购自瑞士Roche公司;人白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α、IL-8酶联免疫吸附试验(ELISA)试剂盒购自美国Raybiotech公司;兔抗人Toll样受体(TLR)4多克隆抗体、细胞周期蛋白(Cyclin)D1、酶切含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-3抗体均购自美国Sigma公司;anti-miR-27a、anti-miR-con、miR-27a mimics、miR-con、si-KIF3A、si-con均购自上海吉玛制药技术有限公司;四甲基偶氮唑蓝(MTT)与细胞凋亡试剂盒均购自中国碧云天生物技术研究所。
1.2方法
1.2.1hDPC分离 收集泉州市第一医院口腔科门诊因正畸或阻生拔除的健康完整前磨牙与第三恒磨牙,患者20例,其中男11例,女9例,所有患者及家属知情且签署同意书。用无菌磷酸盐缓冲液(PBS)冲洗牙齿,去除表面软组织,取牙髓组织,弃牙根尖2 mm,剪碎组织,加入浓度为3 mg/ml的Ⅰ型胶原酶消化20 min,加入含有20%胎牛血清的RPMI1640培养基终止消化,室温条件下经1 000 r/min转速离心5 min(离心半径10 cm),置于无菌培养瓶内(25 cm2),加入含有20%胎牛血清的RPMI1640培养基,放入37℃恒温培养箱内继续培养16~24 h,待细胞贴壁后换液(3 d/次),细胞汇合率达到80%时进行传代培养,待细胞稳定传代3~5代后,取生长状态良好的hDPC进行后续研究。
1.2.2LPS诱导与实验分组 取生长状态良好的hDPC,0.25%胰蛋白酶消化,制备单细胞悬液(4×103个/ml),接种于24孔板,用终浓度为10 ng/ml的LPS分别处理hDPC 0 h、12 h、24 h、36 h、48 h,筛选适宜时间进行后续研究〔8〕。hDPC随机分成NC组(未经任何处理的hDPC)、LPS组(LPS处理的hDPC)、LPS+anti-miR-con组(细胞转染anti-miR-con后用含有LPS的培养基培养48 h)、LPS+anti-miR-27a组(细胞转染anti-miR-27a后用含LPS的培养基培养48 h)、LPS+pcDNA组(细胞转染pcDNA后用含LPS的培养基培养48 h)、LPS+pcDNA-KIF3A组(细胞转染pcDNA-KIF3A后用含LPS的培养基培养48 h)、LPS+anti-miR-27a+si-con组(细胞转染anti-miR-27a与si-con后用含LPS的培养基培养48 h)、LPS+anti-miR-27a+si-KIF3A组(细胞转染anti-miR-27a与si-KIF3A后用含LPS的培养基培养48 h)。
1.2.3ELISA测定TNF-α、IL-6、IL-8水平 取生长状态良好的hDPC,按照每孔1×105个细胞的密度接种于6孔板,待细胞贴壁生长时弃原培养液,按照1.2.2分组处理后收集细胞上清液,采用ELISA法检测TNF-α、IL-6、IL-8水平,严格按照试剂盒说明书进行操作。
1.2.4实时荧光定量-聚合酶链反应(qRT-PCR)检测细胞中miR-27a、KIF3A mRNA表达水平 收集各组细胞,加入Trizol裂解细胞并提取总RNA,取RNA(1 μg)按照反转录试剂盒合成cDNA,以cDNA为模板进行qRT-PCR反应,采用2-ΔΔCt法计算miR-27a、KIF3A mRNA相对表达量。
1.2.5MTT检测细胞存活率 分别收集转染后各组细胞,0.25%胰酶消化,接种至96孔板(5×103个/孔),每孔加入20 μl MTT试剂,继续培养2 h,分别加入150 μl DMSO,利用酶标仪检测各孔在490 nm处的相对吸光度值(OD)。
1.2.6流式细胞术检测细胞凋亡 收集各组细胞,0.25%胰酶消化,收集细胞(1×105个细胞),加入500 μl结合缓冲液悬浮细胞,按照凋亡检测试剂盒说明书检测细胞凋亡率。
1.2.7双荧光素酶报告基因检测miR-27a的靶基因 构建WT-KIF3A与MUT-KIF3A荧光素酶报告载体,分别将WT-KIF3A、MUT-KIF3A与miR-27a mimics或miR-con共转染至hDPC,置于培养箱继续培养48 h,检测各组双荧光素酶活性。
1.2.8Western印迹检测KIF3A、CyclinD1、酶切Caspase-3、TLR4蛋白表达 取各组对数生长期hDPC加入蛋白裂解液提取蛋白,取30 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,封闭1 h,4℃条件下孵育一抗(1∶1 000)24 h,室温条件下孵育二抗(1∶2 000)2 h,加入电化学(ECL)显影,应用ImageJ软件分析各蛋白条带灰度值。
1.3统计学方法 采用SPSS21.0软件进行t检验、单因素方差分析。
2 结 果
2.1LPS刺激hDPC不同的时间miR-27a和KIF3A的表达 随着LPS处理时间的延长,hDPC中miR-27a表达水平逐渐升高(P<0.05),而KIF3A mRNA及蛋白表达水平逐渐降低(均P<0.05),由于LPS处理时间为48 h时hDPC中miR-27a表达水平相对较高,因而后续研究中LPS处理时间为48 h,见图1、表1。
2.2干扰miR-27a表达抑制LPS对hDPC存活和促进凋亡 与NC组比较,LPS组细胞存活率和CyclinD1水平显著降低,而酶切Caspase-3和细胞凋亡率均显著升高(均P<0.05)。干扰miR-27a表达可升高LPS诱导的hDPC存活率和CyclinD1蛋白水平(P<0.05),降低细胞凋亡率和酶切Caspase-3蛋白水平(P<0.05),见表2、图2、图3。

图1 Western印迹检测牙髓细胞KIF3A蛋白的表达

表1 LPS刺激hDPC不同的时间miR-27a和KIF3A的表达

表2 干扰miR-27a表达对LPS刺激hDPC存活和细胞凋亡的影响

图2 流式细胞术检测hDPC凋亡
2.3干扰miR-27a表达抑制LPS对hDPC TLR4表达和炎症因子的分泌 与NC组比较,LPS组TLR4、TNF-α、IL-6、IL-8水平均显著升高(均P<0.05)。干扰miR-27a表达可降低LPS诱导的hDPC中TLR4蛋白水平和TNF-α、IL-6、IL-8水平(P<0.05),见表3、图4。

1~4:NC组、LPS组、LPS+anti-miR-con组、LPS+anti-miR-27a组,下图同

表3 干扰miR-27a表达对LPS刺激hDPC TLR4表达和炎症因子的分泌的影响

图4 Western印迹检测hDPC TLR4蛋白的表达
2.4miR-27a靶向调控KIF3A基因表达 miR-27a与KIF3A存在互补核苷酸序列,见图5。转染WT-KIF3A的hDPC中,miR-27a组荧光素酶活性(0.68±0.07)显著低于miR-con组(1.00±0.12,t=6.910,P<0.001),转染MUT-KIF3A的hDPC中,miR-27a组荧光素酶活性(1.15±0.13)与miR-con组无显著差异(1.17±0.17,t=0.339,P=0.739)。与miR-con组KIF3A表达水平(0.48±0.06)比较,miR-27a组(0.19±0.04)显著降低(P<0.05);与anti-miR-con组KIF3A表达水平(0.52±0.06)比较,anti-miR-27a组(0.84±0.09)显著升高(P<0.05)。见图6。

图5 miR-27a与KIF3A存在的互补核苷酸序列
2.5过表达KIF3A对LPS刺激hDPC增殖、凋亡和炎症因子分泌的影响 与LPS+pcDNA组相比,LPS+pcDNA-KIF3A组hDPC存活率和CyclinD1蛋白水平显著升高(P<0.05),细胞凋亡率和酶切Caspase-3、TLR4蛋白水平及TNF-α、IL-6、IL-8水平显著降低(P<0.05),见图7、表4。
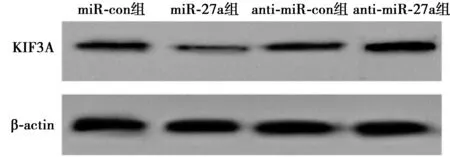
图6 Western印迹检测KIF3A蛋白水平

1~2:LPS+pcDNA组、LPS+pcDNA-KIF3A组

表4 过表达KIF3A对LPS刺激hDPC存活、细胞凋亡和和炎症因子分泌的影响
2.6干扰KIF3A部分逆转转染anti-miR-27a对LPS刺激hDPC存活、细胞凋亡和和炎症因子分泌的作用 相较于LPS+anti-miR-27a+si-con组,LPS+anti-miR-27a+si-KIF3A组hDPC存活率显著降低(P<0.05),细胞凋亡率显著升高(P<0.05),CyclinD1蛋白表达水平显著降低(P<0.05),酶切Caspase-3与TLR4蛋白表达水平显著升高(P<0.05),TNF-α、IL-6、IL-8水平显著升高(P<0.05),见表5、图8。

表5 过表达KIF3A对LPS刺激hDPC存活、细胞凋亡和和炎症因子分泌的影响

1~2:LPS+anti-miR-27a+si-con组、LPS+anti-miR-27a+si-KIF3A组
3 讨 论
miRNA在牙髓组织中异常表达,还可通过调控炎性因子表达从而促进hDPC炎症反应〔9~11〕。miR-27a可参与大鼠膝关节骨性关节炎发生过程,研究表明降低miR-27a表达可抑制骨性关节炎发生发展〔12,13〕。相关报道指出miR-27a在心肌梗死患者外周血心肌细胞中呈高表达,并可促进心肌细胞凋亡〔14〕。本研究结果提示LPS可诱导hDPC炎症反应,干扰miR-27a的表达可抑制LPS诱导的hDPC凋亡。研究表明TLR4可激活细胞内炎症反应或相关信号通路,还可促进TNF-α、IL-6等炎性因子释放,其中IL-6可通过促进黏附分子表达及血管生成从而促进牙髓炎发生,TNF-α、IL-6、IL-8水平升高与牙髓炎发生发展密切相关,并可作为牙髓炎诊断的重要辅助标志物〔15,16〕。本研究结果提示干扰miR-27a的表达可抑制LPS诱导的TLR4、TNF-α、IL-6、IL-8水平升高。KIF3A基因缺失可造成成骨细胞功能障碍及骨量减少等从而促进骨质疏松相关性疾病发生〔17〕。研究表明敲低KIF3A可通过诱导支气管上皮细胞凋亡从而加重哮喘气道炎症,进一步研究发现miR-145-5p可通过抑制KIF3A表达从而促进哮喘发生〔18,19〕。本研究结果提示KIF3A过表达可抑制LPS诱导的hDPC凋亡及炎症反应。本研究证实miR-27a靶向负性调控KIF3A基因表达,干扰miR-27a的表达可通过上调KIF3A表达从而促进LPS诱导的hDPC存活,抑制细胞凋亡及炎症反应。
综上,miR-27a可通过负性调控靶基因KIF3A的表达从而减轻LPS诱导的hDPC损伤,为探讨miRNA参与hDPC炎症反应的调控机制提供新方向。
