乳腺癌化疗患者睡眠障碍变化规律及预测指标研究
2021-10-14陆吾陆箴琦
陆吾,陆箴琦
化疗是乳腺癌治疗的重要方法之一。但由于化疗药物的选择性较差,在杀伤或抑制肿瘤细胞的同时,亦会损害机体正常细胞,引起各种毒副反应,如恶心、呕吐、脱发等[1-2],且化疗患者常伴有疼痛、负性情绪、经济负担等问题[3-5],均会导致睡眠障碍的发生与发展[6]。研究显示,乳腺癌患者化疗期间的睡眠质量较差[7],约65%乳腺癌患者在化疗全过程存在睡眠障碍[8-9],且睡眠障碍水平随时间动态变化[10-12]。研究显示,乳腺癌患者睡眠障碍变化轨迹具有群体异质性[13-14]。探讨患者睡眠障碍的纵向变化趋势、轨迹类别,并识别相关预测指标,能促使医护人员早期识别潜在中、高风险人群,并实施动态监测和个体化管理。鉴于此,本研究基于潜类别增长模型(Latent Class Growth Model, LCGM)识别乳腺癌患者化疗期间睡眠障碍的纵向变化趋势及不同轨迹类别,并分析人口学及疾病相关因素对轨迹类别的预测作用,以期为实现乳腺癌化疗患者精准照护提供参考。
1 对象与方法
1.1对象 2020年6~10月选取复旦大学附属肿瘤医院乳腺外科的乳腺癌化疗患者为研究对象。纳入标准:①病理确诊为原发性乳腺癌;②年龄18~80岁,女性;③准备接受首次辅助化疗或新辅助化疗;④知晓自身疾病诊断和病情;⑤小学以上文化程度,能理解调查内容;⑥预期生存1年以上;⑦知情同意且自愿参加本研究。排除标准:①肿瘤复发或远处转移(转移至其他器官,如肺、肝、脑等;或转移至其他组织,如非区域淋巴结、骨等);②认知障碍;③言语功能障碍,交流困难;④有精神病史或正服用抗精神疾病药物;⑤病情极危重,有生命危险;⑥合并心、脑、肺、肝、肾等重要器官严重疾病;⑦合并严重全身感染、严重贫血或恶病质等并发症;⑧存在可能导致不依从或失访情况。剔除标准:①调查期间化疗联合放疗或内分泌治疗;②调查期间因各种原因终止化疗;③调查期间无法继续完成测评(拒绝测评、病情加重恶化无法完成测评、失联等)。
1.2方法
1.2.1研究工具 ①一般资料调查表:由研究者自行设计,由个人信息(包括年龄、宗教信仰、文化程度、婚姻情况等)及疾病资料(包括既往史、家族史、乳腺癌相关资料及化疗相关资料)两部分组成。②睡眠障碍量表:采用吴傅蕾[15]基于患者报告结局测量信息系统构建的乳腺癌患者报告结局测量系统-化疗期间(Patient-reported Outcomes Measurement System-Breast-Chemotherapy,PROMS-B-C)睡眠障碍量表,测评乳腺癌化疗患者在过去7 d内的睡眠障碍水平,包括睡眠障碍与睡眠相关影响两部分,其Cronbach′s α系数为0.682、0.868。量表共12个条目(睡眠障碍部分4个条目,睡眠相关影响部分8个条目),每个条目均采用1~5分的Likert 5级评分法计算得分。将简表最终测评得分转化为平均分为50,标准差为10的标准化T分数。得分越高,说明症状越严重。
1.2.2资料收集方法 获得复旦大学附属肿瘤医院医学伦理委员会批准及征得护理部、乳腺外科护士长同意门诊招募研究对象。向符合标准的研究对象介绍本研究的目的、意义及填写注意事项等,签署知情同意书。于研究对象首次化疗开始前 (T1)、化疗初期(T2)、化疗中期(T3)、化疗末期(T4)发放问卷自行作答并回收。T1为门诊确定化疗方案并开具化疗药时。考虑到化疗后7 d内毒副反应最为严重[16-17],故T2为第1疗程用药结束后第7天,T3、T4根据化疗周期及疗程确定,如总周期为4、6、8疗程的患者,T3分别为第2、3、4疗程用药结束后第7天,T4为最后1个疗程用药结束后第7天。T1纳入253例,T2、T3、T4分别240例、228例、219例完成问卷填写。34例因不同原因(认为参与本研究对自己疾病并无帮助,填写问卷过于频繁,化疗后反应过重拒绝继续参加研究,未按时填写问卷,联合免疫治疗,后续未行化疗等)退出研究,失访率为13.4%。
1.2.3统计学方法 采用SPSS22.0软件进行重复测量的方差分析、χ2检验和Logistic回归分析。采用Mplus8.0软件构建潜类别增长模型。采用χ2检验识别可能的预测因素,为避免遗漏,以P≤0.10为差异有统计学意义,其余统计检验水准α=0.05。潜类别增长模型的拟合指标包括赤池信息准则(Akaike Information Criterion,AIC)、贝叶斯信息准则(Bayesian Information Criterion,BIC)、样本校正的贝叶斯信息准则(sample size-adjusted BIC,aBIC)、熵(Entropy)、似然比检验(Likelihood Ratio Test,LRT)及基于Bootstrap的似然比检验(Bootstrapped Likelihood Ratio Test,BLRT)。根据“Entropy值更高,AIC、BIC和aBIC值更低者,LRT和BLRT 2个指标P值达到显著水平,模型拟合效果更好”的原理,并结合实际意义及统计指标确定最佳模型。
2 结果
2.1乳腺癌化疗患者睡眠障碍得分情况及纵向变化趋势 乳腺癌化疗患者在T1、T2、T3、T4时的睡眠障碍得分分别为:47.50±8.82、51.38±10.83、50.66±9.90、50.46±9.99。重复测量的方差分析显示:不同时间点睡眠障碍得分比较,差异有统计学意义(F=16.794,P<0.01)。
2.2乳腺癌化疗患者睡眠障碍轨迹类别的识别与确定 使用潜类别增长模型,以患者4个时间点的睡眠障碍得分作为观测指标,设定为时间参数自由估计,依次提取1~5个类别进行模型拟合度分析。研究结果显示,仅四类别模型的LRT值和BLRT值均达到显著水平。同时,随着分类数目的增多,AIC、BIC及aBIC值不断减小,且Entropy值达到最大(见表1)。综合以上信息,最终保留四类别模型。类别1共42例(占19.2%),截距与斜率的均值为39.357(P<0.01)和-0.785(P=0.498),说明患者在T1时基本未表现出睡眠障碍,且患者在整个随访期的平均变化不显著,因此将类别1命名为无睡眠障碍组。类别2共111例(占50.7%),截距与斜率的均值为51.814(P<0.01)和7.539(P<0.01),说明患者在T1时表现出中等水平的睡眠障碍,且患者在整个随访期的平均变化显著,但始终维持在中等水平,将类别2命名为中度睡眠障碍组。类别3共55例(占25.1%),截距与斜率的均值为46.661(P<0.01)和2.855(P<0.05),说明患者在T1时表现出较低水平的睡眠障碍,且患者在整个随访期的平均变化显著,但始终维持在较低水平,将类别3命名为轻度睡眠障碍组。类别4共11例(占5.0%),截距与斜率的均值为64.832(P<0.01)和8.538(P<0.05),说明患者在T1时表现出较高水平的睡眠障碍,且在整个随访期的平均变化显著,但始终维持在较高水平,将类别4命名为重度睡眠障碍组。见图1。
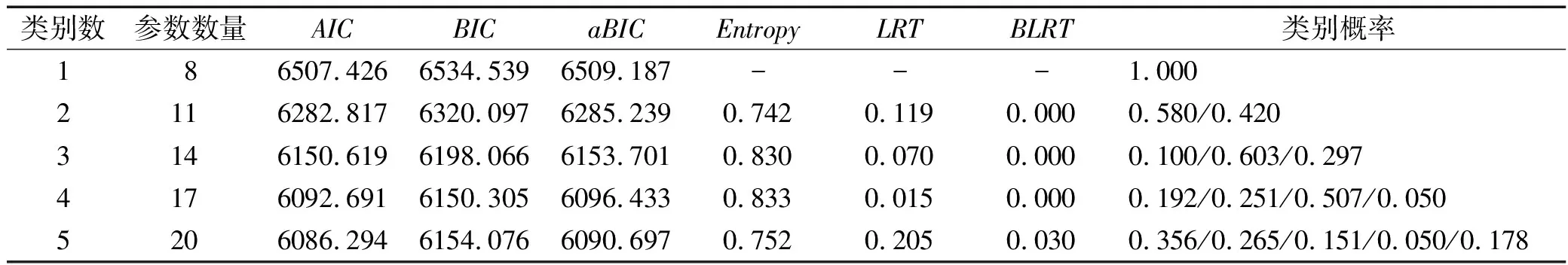
表1 乳腺癌化疗患者睡眠障碍得分的模型拟合结果(n=219)
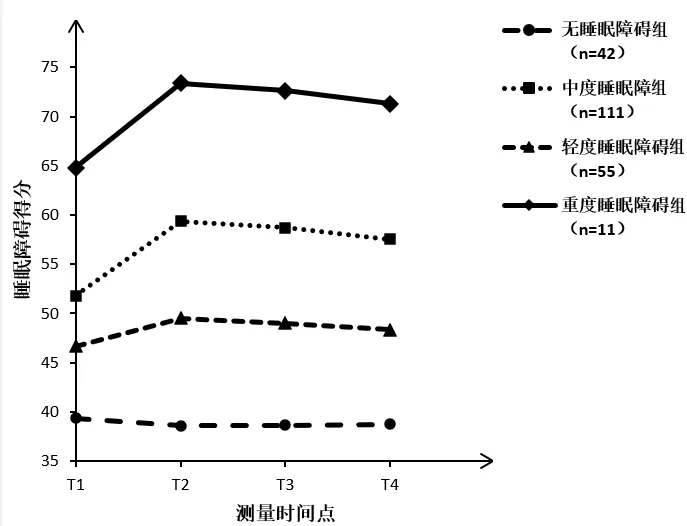
图1 乳腺癌化疗患者睡眠障碍的潜类别增长模型轨迹图
2.3乳腺癌化疗患者睡眠障碍轨迹类别的预测因素分析 为避免统计学效力降低,并结合临床实际意义,将无睡眠障碍组与轻度睡眠障碍组合并为无/轻度睡眠障碍组,中度睡眠障碍组与重度睡眠障碍组合并为中/重度睡眠障碍组。将人口学及疾病相关资料纳入单因素分析(见表2),纳入P≤0.10的变量(居住地、宗教信仰、区域淋巴结转移、化疗疗程、使用靶向药物、参与临床试验)作为轨迹类别预测的自变量,轨迹类别作为因变量进行二元Logistic回归分析,结果区域淋巴结转移(OR=1.475,P=0.042)、使用靶向药物(OR=2.135,P=0.011)及参与临床试验(OR=1.899,P=0.040)对乳腺癌化疗患者的睡眠障碍轨迹类别具有预测作用(见表3)。该二元Logistic回归模型的拟合情况为:Hosmer-Lemeshow检验中的P=0.558;Omnibus检验表明该模型总体具有意义,且R2=0.461;用二元Logistic回归拟合方程预测的正确率为76.5%。
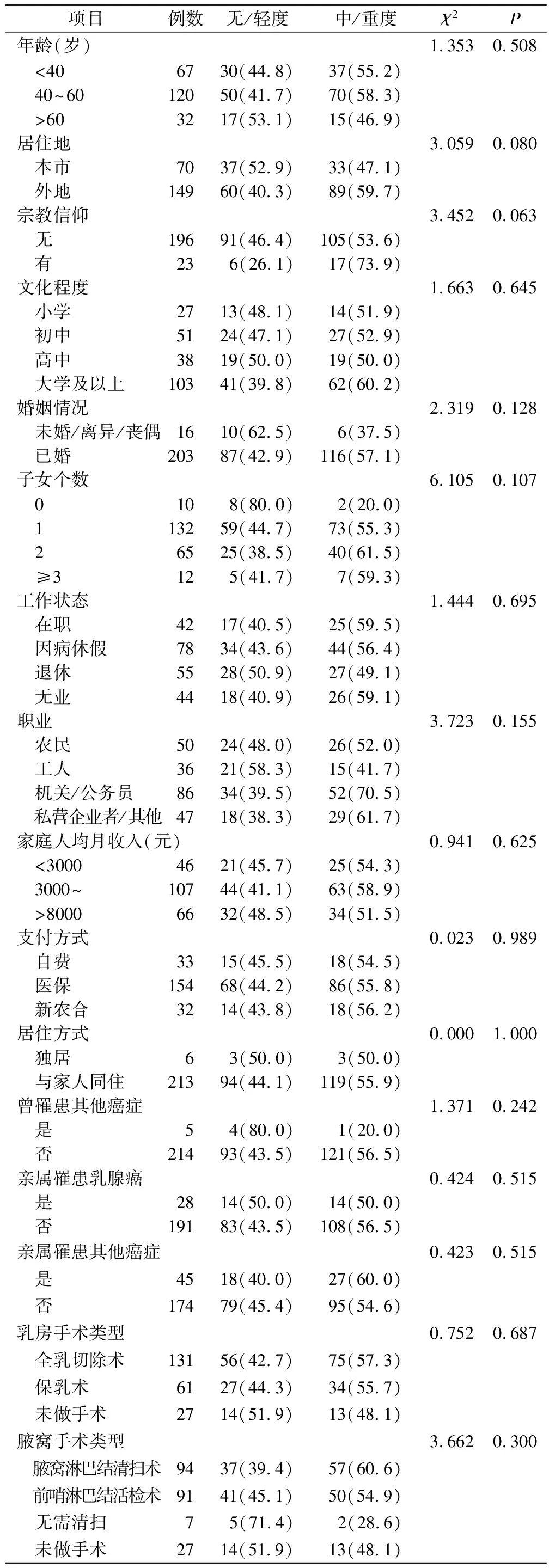
表2 乳腺癌化疗患者睡眠障碍轨迹类别的单因素分析 例(%)
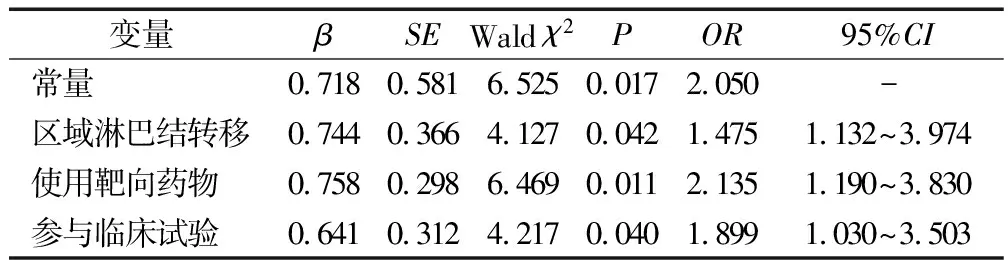
表3 乳腺癌化疗患者睡眠障碍轨迹类别的Logistic回归分析
3 讨论
3.1乳腺癌化疗患者睡眠障碍的变化趋势及其群体异质性 本研究结果显示,乳腺癌化疗患者在首次化疗开始前至化疗末期的4次调查中,睡眠障碍得分均处于中等水平,且首次化疗后睡眠障碍得分最高,随后略有下降但仍高于化疗前,与国内外研究结果[10-11,18]相似。本研究通过潜类别增长模型识别出乳腺癌化疗患者睡眠障碍4条不同的潜在轨迹,即无睡眠障碍组、中度睡眠障碍组、轻度睡眠障碍组及重度睡眠障碍组,该结果与Fleming等[13]对173例乳腺癌患者长达12个月的睡眠调查存在一定的相似性。其中,无睡眠障碍组患者在化疗期间基本未出现睡眠障碍,其所占比例为19.2%,该结果低于既往研究[8-9, 19],可能与各研究样本特征及调查实施不同有关,既往研究仅纳入乳腺癌术后化疗患者或所开展的研究为横断面研究。中度睡眠障碍组患者所占比例最高(50.7%),说明超过半数的患者在化疗全过程中基本处于中度睡眠障碍,该结果与Whisenant等[14]研究存在差异。原因可能在于:Whisenant等[14]调查实施的方式与本研究有所不同,其在化疗第2与第3周期时每天跟踪调查乳腺癌患者的睡眠障碍水平并识别其轨迹类别。重度睡眠障碍组患者所占比例为5.0%,该组患者在首次化疗开始前即有较高水平的睡眠障碍,且至化疗早期有所攀升。患者在化疗早期会面临各种问题,如未知的治疗效果、反复的治疗和高昂的花费,且患者化疗毒副反应在初期阶段较为显著并为首次面临。目前,口服大剂量地塞米松是乳腺癌化疗前的预处理,可减轻或消除紫杉类药物引起的不良反应,但服用大剂量地塞米松会引起睡眠障碍[20],大多处于化疗早期的患者难以耐受由化疗及预处理所引起的不良刺激,所以在T2时患者睡眠障碍水平达到高峰。此外,本研究所纳入的乳腺癌化疗患者大多来自上海市外,目前化疗又多采用门诊化疗或日间化疗的模式开展,需在医院周边租房或提前乘车至上海且在化疗结束后乘车回家,处于化疗早期的患者难以应对该类窘境,亦为影响患者化疗早期睡眠质量的原因之一[21]。而随着化疗进程的推进,患者对疾病及治疗方案的了解加深,自我调适能力和应对能力都得到一定的提高,因此患者的睡眠水平逐渐得以改善。提示医护人员应早期识别睡眠障碍潜在人群,在化疗早期,甚至是化疗未开始前,即要提供给患者相应的帮助和支持,并根据其睡眠障碍水平的变化特征开展后续的治疗与护理,以预防和减轻睡眠障碍对患者造成的困扰。
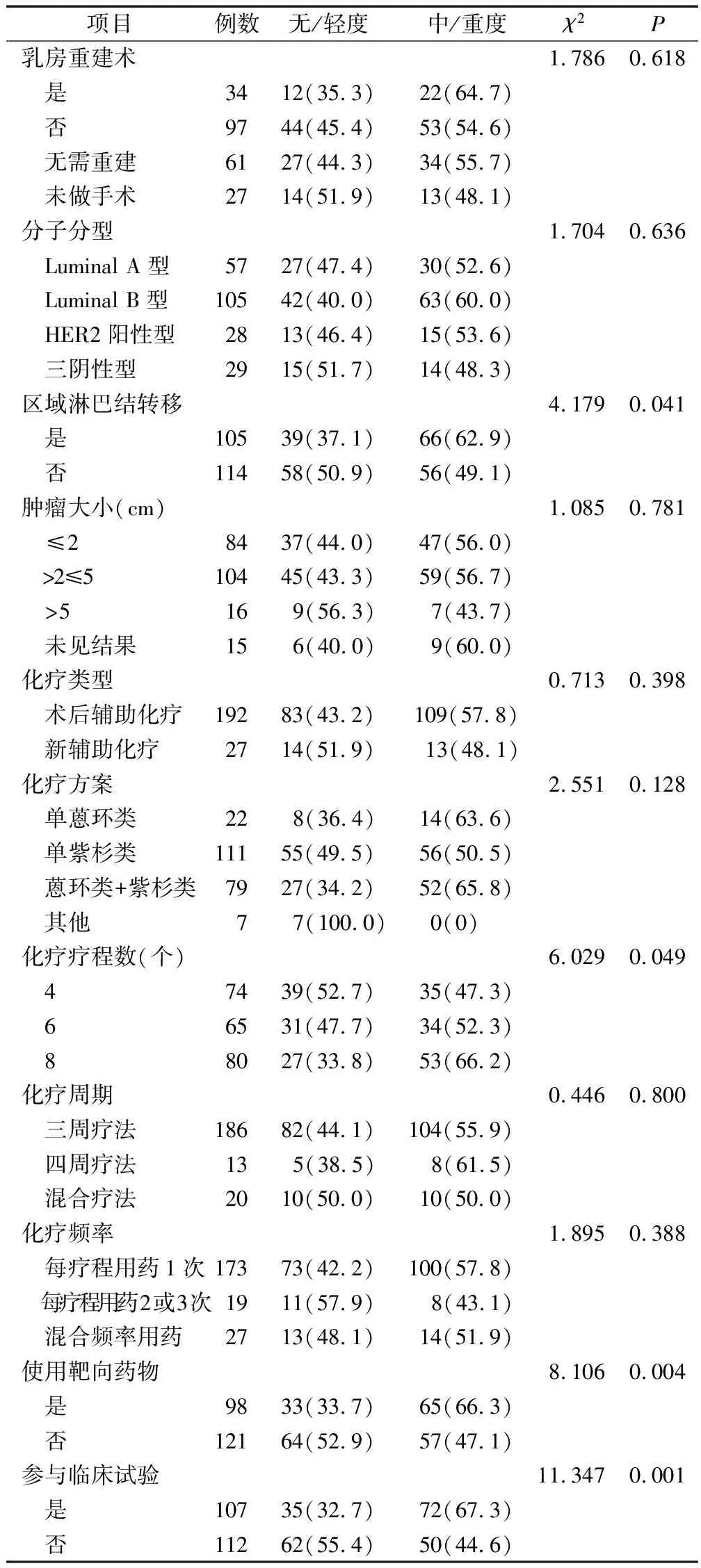
续表2 乳腺癌化疗患者睡眠障碍轨迹类别的单因素分析 例(%)
3.2乳腺癌化疗患者睡眠障碍轨迹的预测因素 本研究发现,区域淋巴结转移的患者发生严重睡眠障碍的概率更高,为未发生区域淋巴结转移患者的1.475倍。区域淋巴结转移与肿瘤分期密切相关,可反映疾病严重程度与预后。乳腺癌患者发生区域淋巴结转移,通常需要接受额外的治疗与手术,如新辅助化疗、淋巴结手术、内分泌治疗与放疗等[22],导致患者所面临的治疗毒副反应、心理及经济负担相对更重[23],从而发生睡眠障碍的概率更高。使用靶向药物的患者发生严重睡眠障碍的概率更高,为未使用靶向药物患者的2.135倍。与化疗药物相比,虽然靶向药物能相对高效地、具有选择性地抑制癌细胞,减少对机体正常细胞的损伤,但其仍存在心脏毒性、输注反应等不良反应[24-25],进一步加重患者首次化疗后的症状负担,从而影响患者的睡眠质量。目前,我国的乳腺癌诊治指南中推荐靶向治疗应维持1年[22],部分患者因自认为难以维持长达1年的治疗而出现忧虑情绪,所以使用靶向药物的患者睡眠障碍水平更高。本研究涉及到的靶向药物包括曲妥珠单抗与帕妥珠单抗,这2种药物现虽已纳入国家医保药品范围内[26],但靶向治疗的一部分花费仍需要患者自己承担。此类患者在忍受疾病本身与化疗带来的痛苦的同时,还要承受靶向治疗相关医疗费用带来的经济负担与精神压力,从而进一步导致睡眠障碍水平上升。参与临床试验的患者发生严重睡眠障碍是未参与临床试验患者的1.899倍。新兴药物的治疗效果与毒副反应、入选对照组还是试验组、如何确保试验过程中的自身权益等均属于参与临床试验患者可能顾虑的问题。同时,参与临床试验的患者必须接受常规以外的体检、检查或访视等[27],在一定程度上会对患者的日常生活产生一定的影响,导致此类患者更易发生睡眠障碍。提示是否存在区域淋巴结转移、使用靶向药物及参与临床试验是区分乳腺癌化疗患者睡眠障碍发展轨迹类型的关键性预测指标。建议临床医护人员重视早期识别睡眠障碍中、高危人群,并密切关注其化疗全过程中的睡眠障碍变化趋势,在可能出现症状负担高峰前予以相应的干预措施。
4 小结
本研究显示,乳腺癌化疗患者的睡眠障碍在化疗早期显著增高,随后略微降低但仍高于基线水平,其发展轨迹有显著的群体异质性,区域淋巴结转移、使用靶向药物及参与临床试验对患者的睡眠障碍轨迹类别具有预测作用。本研究仅探索了乳腺癌化疗患者部分人口学及疾病相关因素对轨迹类别的预测作用,所纳入研究的预测指标有限,有待探究与发现更多有益于临床实践的预测指标;将测评时间聚焦于化疗阶段,未涉及到乳腺癌治疗的其他阶段;所纳入的某一类型患者较少(如独居、曾罹患其他癌症等),可能导致统计学效力的降低。后续研究可增加样本量、纳入更多的相关预测因素并延长跟踪随访时间,以期为临床提供更多可靠的依据。
