神经生长因子对创伤性脊髓损伤大鼠膀胱功能和轴突损伤修复的作用
2021-10-14石胜柳盛祖桃王增亮
石胜柳,丁 桃,孙 瑜,盛祖桃,徐 婧,蔡 晶,王增亮
(1.昆明医科大学第一附属医院康复医学科,云南昆明 650031;2.云南博亚医院心脏中心心功能室,云南昆明 650031;3.新疆医科大学第一附属医院神经外科,新疆乌鲁木齐 830000)
创伤性脊髓损伤(traumatic spinal cord injury,t-SCI)是由于物理因素导致的脊髓急剧损伤,主要临床表现为脊髓内神经系统紊乱和膀胱括约肌失控导致的排尿功能阻碍,主要病理表现为脊髓神经元轴突变性和神经元凋亡等[1]。轴突具有运输蛋白质和营养物质等功能,是神经元的重要组成部分[2]。已有研究表明,刺激神经的运动传出,促进轴突再生,从而可以改善膀胱的自主性收缩[3]。目前,t-SCI主要治疗方案为手术缓解脊髓损伤,药物促进脊髓神经元和轴突再生,进而改善器官功能,但这些治疗措施对t-SCI的治疗效果有限[4]。因此,寻找t-SCI的治疗靶点至关重要。
神经生长因子(nerve growth factor,NGF)属于中枢神经系统重要的生物活性物质,具有促进脊髓中神经细胞的生长、发育和再生的功能[5]。研究表明,30~60 μg NGF干预t-SCI大鼠后,NGF可通过抑制神经元凋亡,改善脊髓损伤[6-7]。但NGF对t-SCI的膀胱功能以及脊髓神经轴突修复作用尚不清楚。本研究通过改良Allen’s击打法构建t-SCI大鼠,NGF腹腔注射治疗,采用BBB评估、大鼠尿动力学、左侧腰6前根(L6VR)甲苯胺蓝染色和蛋白免疫法(Western blotting)等方法,观察NGF对t-SCI大鼠膀胱功能和脊髓神经轴突修复的影响,以及丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路的变化。
1 材料与方法
1.1 实验动物及分组SPF级的雄性SD大鼠30只(广州中医药大学实验动物中心提供),12周龄,体质量(220±5)g,饲养于恒温(22±2)℃、50%~60%湿度且无特殊病原体的动物房中,自由摄入水和饲料。大鼠随机分为3组:假手术组、损伤组和NGF组,每组各10只。1 mL/L乌拉坦溶液(1.0 g/kg)腹腔注射麻醉大鼠,将其背部毛发剃光后,用含750 g/L乙醇棉消毒后,铺洞巾。以T8棘突为中心,正中切5 cm切口,充分暴露T7~T11棘突,再用手术钳固定T8棘突,制造脊髓为中心的3 mm圆形损伤区。通过改良Allen,通击打仪器,10 g冲击针从3 cm高度自由落体撞击脊髓,在撞击的时候,大鼠尾部蜷缩,双下肢发生回缩弹动,然后瘫痪,说明脊髓损伤模型构建成功[8]。常规缝合消毒放回饲养笼。从手术第一天起,假手术组、损伤组大鼠每日20 μL手术生理盐水腹腔注射,NGF组的大鼠给予20 μL生理盐水混合60 μg NGF,腹腔注射,干预6周。动物实验方案经昆明医科大学第一附属医院伦理委员会批准。
1.2 试剂及试剂盒乌拉坦(北京通县育才精细化工厂),NGF(赛默飞世尔科技有限公司),40 g/L多聚甲醛(北京雷根生物技术有限公司),甲苯胺(江苏福斯特化工制造有限公司),RIPA缓冲液、PMSF、蛋白磷酸酶抑制剂和BeyoECL发光液(上海碧云天生物技术有限公司),BSA(德宁生物技术有限公司),兔抗鼠Raf-1、MEK-2、p-MEK-2、ERK1/2、p-ERK1/2和GAPDH单分子抗体(Abcam),山羊抗兔二抗(CST)。
1.3 后肢运动功能评分采用BBB评分[9]评价假手术组、损伤组和NGF组术前和术后30 min的后肢运动能力。根据3组大鼠后肢关节灵活度、后肢的运动协调能力以及爪子的精细运动能力进行评分。0分为大鼠完全瘫痪,满分21分为大鼠正常活动,BBB评分越低,说明大鼠运动能力越差。BBB评分由2人独立进行评估,平均值为最终评分。
1.4 大鼠尿动力学检测假手术组、损伤组和NGF组大鼠干预6周后,在20 mL/L七氟烷吸入下麻醉大鼠,打开大鼠腹部,在耻骨上膀胱顶部造瘘并且将3号输尿管插入,再将腹部缝合。放入测压笼内,设置室温为30℃。输尿管导管接上三通,用注射器抽出膀胱尿液后,三通一端与微量灌注泵相接,另一端接尿动力仪的膀胱压力传感器,体内置零。在膀胱灌注生理盐水(速度为2.5 mL/h),至大鼠开始排尿时停止注水。再将测压管与BL-420生物机能实验系统连接。双极电极刺激(10 Hz,1 ms,0.5 mA)吻合口近端的腰4前根(L4VR),记录逼尿肌最大压力和膀胱内剩余尿量。
1.5 HE染色检测大鼠膀胱组织病理形态分离假手术组、损伤组和NGF组各10只大鼠膀胱组织,40 g/L多聚甲醛固定24 h,石蜡包埋固定后,冷冻切片机切10 μm薄切片,每只大鼠随机选取2张切片进行HE染色,倒置显微镜观察各组大鼠膀胱组织形态学变化。
1.6 TUNEL检测大鼠脊髓凋亡选取干预6周的假手术组、损伤组和NGF组大鼠各5只,麻醉后分离损伤严重的脊髓0.5 cm。通过石蜡包埋,超薄切片机切片,通过二甲苯脱蜡,梯度乙醇洗脱后,浸入H2O2封闭液中,室温封闭10 min,依次加入TdT酶反应液和FITC标记工作液。37℃避光孵育60 min后,放入荧光显微镜,400倍视野观察,取5个视野的平均数。
1.7 有髓轴突计数假手术组、损伤组和NGF组另5只大鼠干预6周后,腹腔注射10 g/L水合氯醛进行麻醉,背部正中切口,分离截取吻合口远端10 mm长度的L6VR。放入40 g/L多聚甲醛灌注固定24 h,脱水,环氧树脂包埋,再用超薄切片机切1 μm薄切片10 g/L甲苯胺蓝染色后,激光共聚焦显微镜观察5个视野的有髓轴突数量,记录5个视野的平均数。
1.8 蛋白质印迹法检测相关蛋白表达水平从假手术组、损伤组和NGF组大鼠分离采集脊髓损处0.5 cm的脊髓样品。用液氮研磨后,加入裂解混悬液(RIPA缓冲液∶PMSF∶蛋白磷酸酶抑制剂=1∶100∶100),放入匀浆机充分匀浆,12 500 g,4℃,离心15 min,取上清液,BCA试剂检测总蛋白的浓度,将各组的浓度调制一致。总蛋白通过电泳进行分离,再转移至PVDF膜上,30 g/L BSA封闭2 h。将膜放入以1∶1 000稀释的一抗Raf-1、MEK-2、p-MEK-2、ERK1/2、p-ERK1/2和GAPDH中,4℃孵育过夜。TBST洗涤3次,每次15 min,在二抗混合液(二抗:30 g/L BSA=1∶4 000)室 温 孵 育2 h。TBST洗 涤3次,每 次15 min,Beyo ECL发光液孵育条带1 min后,放入凝胶显影仪进行化学发光。通过Image J软件进行分析结果,计算各组目的条带与GAPDH比值。
1.9 统计学处理应用SPSS 20.0软件进行数据分析。计量资料以均数±标准差(±s)表示,各组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠术前和术后BBB评分情况BBB评分结果显示,术前各组之间的BBB评分差异无统计学意义(P>0.05)。术后与假手术组比较,损伤组和NGF模型组的BBB分数显著降低(P<0.05)。与损伤组比较,NGF组术后的BBB分数显著增加(P<0.05)。说明假手术组、损伤组和NGF组的大鼠t-SCI模型构建成功(表1)。
表1 3组大鼠术前和术后脊髓功能BBB评分Tab.1 BBB scores of spinal cord function of the three groups of rats before and after operation (±s,n=10)

表1 3组大鼠术前和术后脊髓功能BBB评分Tab.1 BBB scores of spinal cord function of the three groups of rats before and after operation (±s,n=10)
与假手术组比较,*P<0.05。
?
2.2 各组大鼠尿动力学和膀胱组织病理形态学变化尿动力学结果显示,与假手术组比较,损伤组的最大逼尿压力显著降低(P<0.05),而残余尿量显著增加(P<0.05)。与损伤组比较,NGF组的最大逼尿压力显著增加(P<0.05),而残余尿量显著降低(P<0.05,表2)。
表2 3组大鼠最大逼尿压力和残余尿量的比较Tab.2 Comparison of maximum detrusive pressure and resid⁃ual urine volume in the three groups of rats (±s,n=10)

表2 3组大鼠最大逼尿压力和残余尿量的比较Tab.2 Comparison of maximum detrusive pressure and resid⁃ual urine volume in the three groups of rats (±s,n=10)
与假手术组比较,*P<0.05;与损伤组比较,#P<0.05。
?
HE染色结果显示,假手术组上皮细胞排列整齐,逼尿肌细胞大小一致,肌纤维排列有序,肌束之间紧密排列,无水肿现象。损伤组肌纤维肥大,黏膜层出血,细胞结构破坏,严重水肿。NGF组膀胱水肿减轻,逼尿肌增厚,少数细胞变性,无出血现象[1-2](图1)。
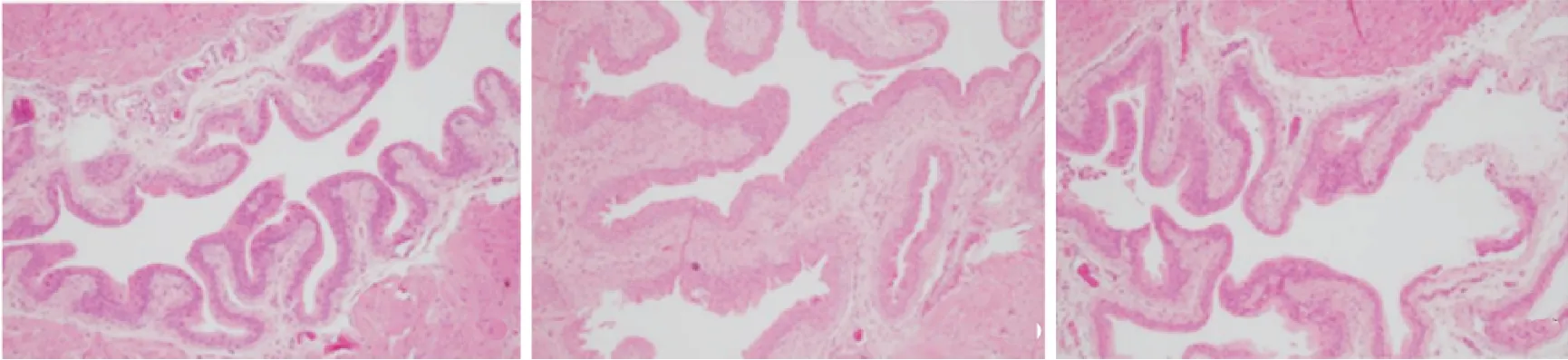
图1 3组膀胱组织HE染色结果Fig.1 HE staining of the three groups of bladder tissues(scale bar=10 μm,×100)
2.3 各组大鼠脊髓凋亡率的变化TUNEL染色结果显示,与假手术组比较,模型组脊髓组织TUNEL阳性率显著升高(P<0.05),NGF组差异无统计学意义(P>0.05)。与损伤组比较,NGF脊髓组织TUNEL阳性率显著降低(P<0.05,表3,图2)。

图2 3组大鼠脊髓TUNEL染色结果Fig.2 TUNEL staining of the spinal cord of three groups of rats(scale bar=10 μm,×400)
表3 3组大鼠脊髓TUNEL凋亡率比较Tab.3 Comparison of TUNEL apoptosis rate in the spinal cord of three groups of rats [(±s)%,n=10]

表3 3组大鼠脊髓TUNEL凋亡率比较Tab.3 Comparison of TUNEL apoptosis rate in the spinal cord of three groups of rats [(±s)%,n=10]
与假手术组比较,*P<0.05;与损伤组比较,#P<0.05。
?
2.4 各组大鼠髓轴突的数量假手术组、损伤组和NGF组吻合口远端L6VR髓轴突数量分别为(553.2±36.2)、(224.5±41.4)、(455.3±40.5)个。与 假手术组比较,损伤组大鼠吻合口远端L6VR髓轴突数量显著降低(P<0.05),NGF组髓轴突数量差异无统计学意义(P>0.05)。与损伤组比较,NGF组髓轴突数量显著增加(P<0.05,图3)。
2.5 各组大鼠脊髓中MAPK/ERK信号通路蛋白表达的变化Western blotting结果显示,与假手术组比较,损伤组大鼠脊髓组织MAPK/ERK通路中p-ERK1/2/ERK1/2和p-MEK-2/MEK-2蛋白比值以及Raf-1蛋白表达显著增加(P<0.05),NGF组差异无统计学意义(P>0.05)。与损伤组比较,NGF组的p-ERK1/2/ERK1/2和p-MEK-2/MEK-2蛋白比值以及Raf-1蛋白表达显著降低(P<0.05,图4,表4)。
表4 3组ERK通路蛋白表达量情况Tab.4 ERK pathway protein expressions in the three groups(±s,n=10)
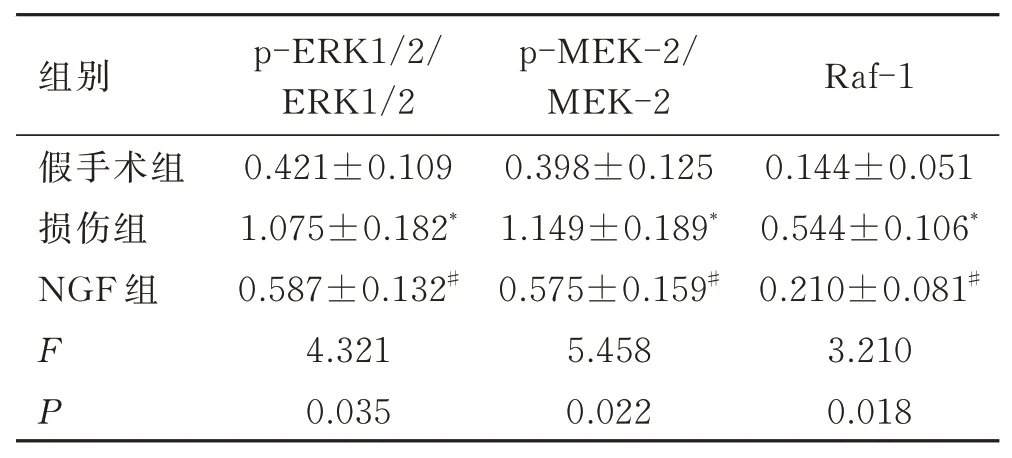
表4 3组ERK通路蛋白表达量情况Tab.4 ERK pathway protein expressions in the three groups(±s,n=10)
与假手术组比较,*P<0.05;与损伤组比较,#P<0.05。
?
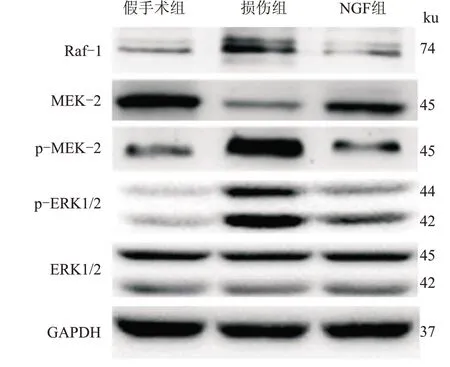
图4 3组大鼠脊髓中ERK通路蛋白变化情况Fig.4 Changes of ERK pathway proteins in the spinal cord of the three groups of rats
3 讨 论
创伤性脊髓损伤是损伤水平以下部位的脊髓功能受到阻碍[10]。脊髓受损后,轴突再生和受损神经元的重塑受到抑制,导致微环境的紊乱,引起二次损伤[11]。膀胱功能障碍是常见t-SCI并发症,主要临床特征为尿潴留、尿失禁和残余尿量增多等,严重者会出现泌尿系统感染和肾功能损伤,甚至危及生命[12]。目前,治疗t-SCI首选药物为糖皮质激素,但长时间使用会引起出血和应激性溃疡等并发症,并且对神经功能恢复效果有限[13]。已有研究表明,中枢神经系统中的NGF调控神经细胞生长、成熟和存活过程,是神经元发育中至关重要的物质[14]。脊髓损伤时,NGF随之表达量增加,但是由于其表达水平仍较低,无法持久保护损伤的神经元。NGF是神经保护剂和再生剂,常用于临床中神经损伤症状,其可治疗t-SCI。因此,需要借助外源性NGF促进t-SCI患者运动以及中枢神经系统功能恢复[15]。但NGF对t-SCI大鼠的膀胱功能改善以及轴突损伤修复的机制尚不明确。基于此,本研究通过腹腔注射NGF于t-SCI大鼠模型,观察大鼠膀胱的最大逼尿压力和残余尿量,以及膀胱组织病理形态学变化,检测脊髓中轴突的再生情况和TUNEL凋亡率以及MAPK/ERK信号通路的变化。
本研究BBB评分显示,改良Allen’s击打法后,与假手术组比较,损伤组和NGF组的大鼠评分显著降低,说明改良Allen’s击打法构建t-SCI大鼠模型成功。与假手术比较,损伤组中的膀胱功能以及病理组织均受损,这可能是因为脊髓损伤会出现膀胱或括约肌失去神经支配而产生排尿功能障碍,从而发生尿潴留,尿路感染。NGF可以增加t-SCI大鼠的最大逼尿压力,减少残余尿量,并且NGF可以促进膀胱组织的水肿消退和组织排列,说明NGF可以恢复t-SCI大鼠的膀胱功能。吻合口远端L6VR髓轴突数量统计结果显示,脊髓损伤后,大鼠的轴突数量明显减少,而NGF的干预后,轴突数量明显增加,促进t-SCI大鼠的轴突再生。TUNEL实验结果显示,与假手术组比较,损伤组的脊髓凋亡率增加。t-SCI大鼠通过NGF干预后,脊髓凋亡率明显减低,说明,NGF可以抑制脊髓凋亡,促进轴突再生。
MAPK/ERK通路主要是ERK分子磷酸化形成活性的p-ERK,随后入核参与调控细胞增殖、分化和凋亡等过程[16]。MAPK信号通路与疾病的发生发展密切相关。Ras/Raf/ERK信号通路属于丝裂原活化蛋白激酶(MAPKs)的家庭成员之一,是膜受体信号传导至细胞的重要途径,主要参与细胞的生长、分裂和凋亡等过程[12]。Ras/Raf/ERK信号通路属于三级酶促级联反应,Ras是上游激酶蛋白,与GTP结合后,其磷酸化后处于活化状态,进一步激活下游Raf分子,使Raf磷酸化后,最后催化下游分子ERK[13]。MAPK信号通路是机体内重要信号传递通路,参与调节多种生理过程,其中ERK信号途径是MAPK信号通路的重要组成部分,其异常传导会导致神经元细胞骨架解体,从而使轴突无法逆转变性[17]。脊髓中MAPK/ERK信号通路抑制后,能改善脊髓损伤大鼠膀胱功能,抑制脊髓中ERK通路,可以促进脊髓损伤中轴突的再生[18]。本研究Western blotting检测结果显示,t-SCI大鼠的MAPK/ERK通路被激活,但NGF干预后,MAPK/ERK信号通路被抑制,说明NGF对t-SCI大鼠脊髓的MAPK/ERK信号通路可能具有抑制作用。
综上所述,NGF可能抑制t-SCI大鼠脊髓中MAPK/ERK通路,从而促进大鼠膀胱的功能恢复和轴突再生能力。本研究结果显示,NGF对t-SCI的并发症膀胱功能障碍具有一定的改善作用,并且其可能通过抑制脊髓中MAPK/ERK通路和激活轴突再生功能有关。NGF对t-SCI的MAPK/ERK信号通路的具体机制还需进一步研究。
