亚低温通过抑制AIF核转位改善大鼠颅脑损伤
2021-10-13丁华强汪棋笙全星运刘胜杰廖落星
丁华强 廖 帅 汪棋笙 全星运 刘胜杰 廖落星 刘 亮
目前,颅脑损伤(traumatic brain injury,TBI)是导致青壮年死亡和残疾的主要原因,成为日益严重的公共卫生问题[1]。TBI 后神经细胞凋亡是导致神经功能缺损的主要原因。细胞凋亡分子通路主要包括Caspase 依赖性通路和非Caspase 依赖性通路[2]。凋亡诱导因子(apoptosis inducing factor,AIF)在非Caspase 依赖性通路中发挥重要作用。研究表明,TBI 后神经细胞凋亡与AIF 核转位有关[3,4]。虽然亚低温能通过降低颅内压、减轻神经炎症反应及细胞兴奋性毒性和抑制神经细胞死亡等机制阻止TBI继发性损伤,从而起到神经保护作用[5~10],但是临床亚低温治疗TBI仍存在一定的争议。以往有关亚低温对TBI 后神经细胞死亡的作用研究主要集中在对Caspase 依赖性通路[8,9,11]。本研究通过观察亚低温对大鼠TBI 后非Caspase 依赖性神经细胞凋亡通路中关键蛋白AIF 定位表达的影响,为临床亚低温治疗TBI提供参考。
1 材料与方法
1.1 实验动物及分组 取36只清洁级成年雄性SD大鼠[体重300~350g,由西南医科大学动物实验中心提供(许可证号:SYXK-2018-065)],采用随机数字表法分为3 组:假手术(n=12)、TBI 组(n=12)和亚低温组(n=12)。
1.2 TBI模型的制备 采用控制性皮质撞击法制作大鼠TBI 模型[12]。术前禁食12 h,腹腔注射3%水合氯醛(1 ml/100g)麻醉,俯卧位固定于立体定向头架上。沿中线切开头皮,暴露右顶骨,颅骨矢状缝中点旁约2 mm 处,牙钻钻直径6 mm圆形骨窗,暴露硬脑膜。致伤参数:打击速度4.0 m/s,打击深度2.8 mm,停留时间50 ms,打击头直径5.0 mm。假手术组大鼠只暴露硬脑膜不予以CCI打击。
1.3 亚低温的实施 亚低温组参照Jiang等[6]报道的方法,采用冰浴加间断使用冰袋的方法降温,15 min内使直肠温度降至(33.0±1.0)℃,并维持6 h,治疗结束后自然复温至37 ℃。假手术组和模型组大鼠置于常温环境,温度维持在(37±0.5)℃。使用体温监测仪持续监测大鼠直肠温度。
1.4 脑组织取材TBI 后24 h,4%多聚甲醛灌注固定后取出完整脑组织,用4%多聚甲醛后固定24 h。冠状切取脑组织块,常规梯度酒精脱水、透明、浸蜡,然后石蜡包埋用于HE染色和免疫组织化学染色。
1.5 HE染色 每组取6只大鼠脑组织标本,石蜡切片(厚5 μm),脱蜡,梯度乙醇水化,HE 染色,脱水,封片,在光学显微镜下观察。
1.6 免疫组织化学染色 每组取6 只大鼠脑组织标本,石蜡切片,二甲苯脱蜡、梯度乙醇水化、柠檬酸盐缓冲液行抗原热修复,3%H2O2浸泡10 min,PBS洗5 min×3次,10%山羊血清室温封闭10 min,甩掉血清,滴加一抗AIF(1:100;美国Abcam 公司),4 ℃孵育过夜;常温复温1 h,PBS洗5 min×3次,滴加二抗,常温孵育30 min,PBS洗5 min×3次,滴加DAB溶液,显微镜下观察3~10 min,出现深棕色后,自来水冲洗终止染色,苏木素复染;梯度乙醇脱水,干片后中性树胶封片,显微镜下观察。
1.7 免疫印迹法检测蛋白表达 每组取6只大鼠,TBI后24 h 麻醉后立即断头处死,冰上取损伤侧大脑组织,用RIPA裂解液提取总蛋白。按线粒体提取试剂盒和细胞核蛋白提取试剂盒(北京索莱宝科技有限公司)说明书提取线粒体蛋白和细胞核蛋白。BCA法(上海碧云天生物技术研究所)进行定量,SDSPAGE胶分离,PVDF转膜。10%脱脂奶粉封闭PVDF膜1 h,PBST 洗10 min×3 次,加一抗AIF(1:1 000;美国Abcam 公司)、Caspase-3(1:1 000;上海碧云天生物技术研究所),小鼠抗一抗β-actin(1:1 000;上海碧云天生物技术研究所)、Histone H3(1:1 000;上海碧云天生物技术研究所)、COXⅣ(1:1 000;美国Abbkine公司)4 ℃孵育过夜。PBST洗10 min×3次,加山羊抗兔IgG 二抗或山羊抗小鼠IgG 二抗室温孵育1 h。PBST洗10 min×3次,ECL法显影,使用ImageJ软件测定灰度值。β-actin、Histone H3 和COXⅣ分别作为总蛋白、细胞核蛋白和线粒体蛋白内参。
1.8 统计学分析 应用SPSS 22.0软件分析;正态分布计量资料以表示,采用单因素方差分析和t检验;P<0.05表示差异具有统计学意义。
2 结果
2.1 亚低温对TBI 大鼠脑组织形态结构的影响HE染色结果显示,假手术组大鼠脑组织神经细胞形态、结构正常,未见挫伤及出血;TBI 组和亚低温组可见沿灰白质界面的挫伤和出血,但亚低温组挫伤和出血灶明显减轻。见图1。

图1 亚低温对TBI大鼠脑组织形态结构的影响(HE,×40)
2.2 亚低温对TBI大鼠AIF核转位的影响 免疫印迹法检测结果显示,与假手术组比较,TBI 组和亚低温组损伤脑组织caspase-3 蛋白表达量明显增加(P<0.01),细胞核AIF蛋白表达量明显增加(P<0.01),而线粒体AIF 表达量明显降低(P<0.05)。与TBI 组比较,亚低温组损伤脑组织caspase-3蛋白表达量明显下降(P<0.01),细胞核AIF蛋白表达量明显下降(P<0.01),而线粒体AIF 表达量明显升高(P<0.05)。见图2。
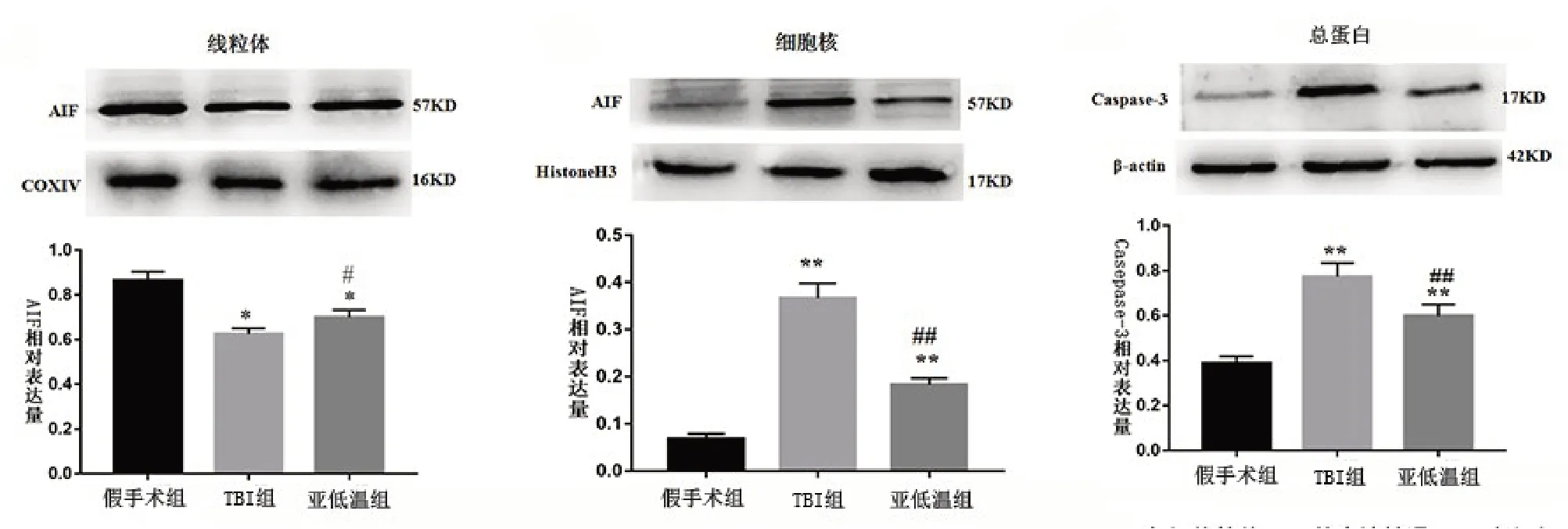
图2 亚低温对TBI大鼠损伤脑组织caspase-3和AIF表达的影响
免疫组织化学染色结果显示,假手术组AIF 位于大脑皮质和海马神经元细胞核外。与假手术组比较,TBI 组与亚低温组大鼠损伤侧大脑皮质及同侧海马区AIF从线粒体转移至细胞核内的阳性细胞数量明显增多(P<0.01)。与TBI 组比较,亚低温组大鼠损伤侧大脑皮质及同侧海马区AIF发生核内转移的阳性细胞数量减少(P<0.01)。见图3。
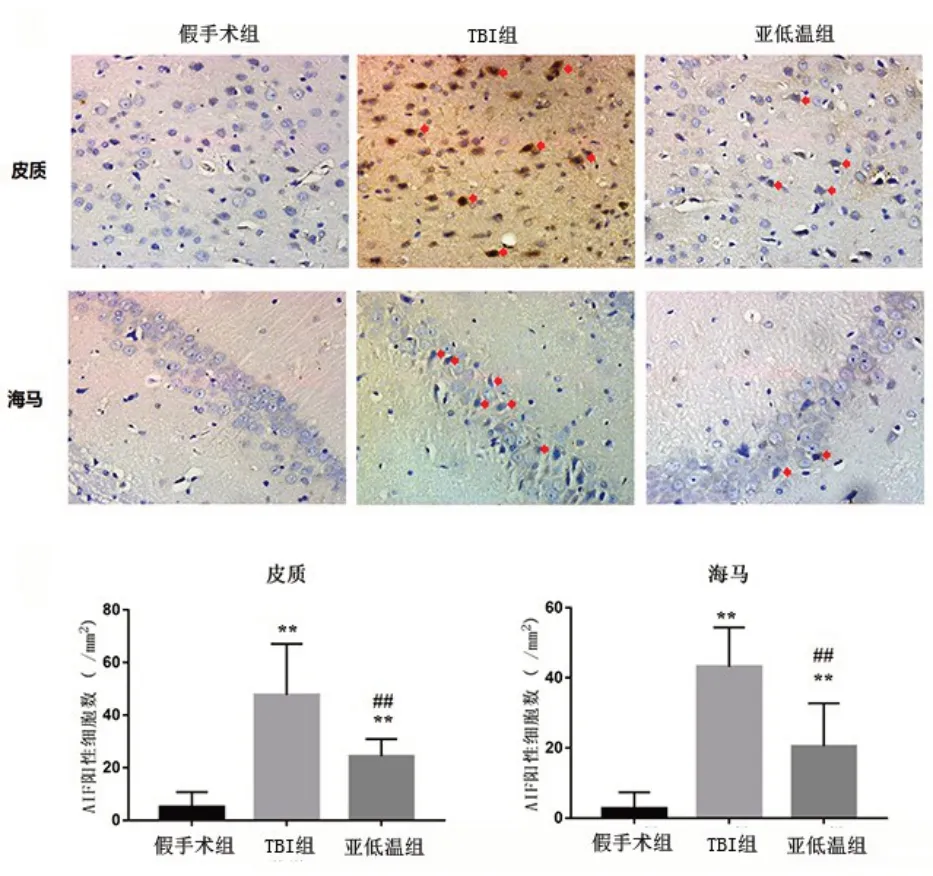
图3 亚低温对TBI大鼠损伤侧皮质和海马AIF表达的影响(免疫组化染色,×200;红色↑为AIF阳性细胞)
3 讨论
亚低温能减轻TBI 后神经细胞凋亡,但其作用机制仍不清楚。本研究发现亚低温能减轻大鼠TBI后脑挫伤和出血,其机制可能与亚低温抑制AIF 核转位、抑制神经细胞凋亡有关。
研究证实TBI后神经细胞凋亡与caspase依赖性细胞凋亡机制相关[13~15]。本实验也发现TBI 后大鼠伤侧脑组织caspase-3 表达水平明显升高。尽管如此,AIF 介导的非caspase 依赖性细胞凋亡通路同样在TBI 继发性损伤中起着十分重要的作用[16]。AIF是一种存在于线粒体内膜、相对分子量为57 000 的核黄素蛋白。当线粒体外膜通透性增加后,AIF 释放进入细胞质,随后转移至细胞核与染色质结合,导致染色质凝聚和大规模DNA 片段化,最终引发非caspase 依赖性细胞凋亡[17]。AIF 核转位是非caspase-3依赖性细胞凋亡的标志[18]。Zhang等[3]研究发现大鼠TBI 后伤侧皮质及海马神经元发生AIF 由线粒体向细胞核内的转移,并伴随有大量DNA片段化。Slammer 等[4]研究发现敲除AIF 基因明显减轻TBI 小鼠继发性损伤。本实验也表明大鼠TBI 后伤侧皮质和海马区神经细胞发生明显的AIF核转位。
TBI动物模型研究发现,亚低温通过降低TIMP-3、Bax、caspase-3、caspase-8及RIPK1等caspase依赖性细胞凋亡通路相关蛋白表达,抑制神经细胞凋亡[10,11,19]。我们的实验不仅证实亚低温能够下调TBI后caspase-3的表达,还发现亚低温能够抑制线粒体内AIF向细胞核内转移。其机制可能为亚低温可以保护线粒体的完整性,降低线粒体通透性,从而减少AIF向细胞质的释放和核内的转移[20]。
总之,亚低温可通过抑制AIF的核转位减轻TBI后神经细胞凋亡,从而起到神经保护作用。
