猪骨骼肌肌钙蛋白T单克隆抗体的制备及鉴定
2021-10-12张静李玉静张二敬李紫然刘静静李春生
张静 李玉静 张二敬 李紫然 刘静静 李春生

摘 要:为制备猪骨骼肌肌钙蛋白T单克隆抗体,利用生物化学方法提取猪骨骼肌肌钙蛋白并免疫小鼠,通过细胞融合制备稳定分泌单克隆抗体的杂交瘤细胞株,采取体内诱生腹水法批量制备单克隆抗体,并对其免疫学特征进行鉴定。结果表明:最终筛选获得1 株杂交瘤细胞株,将其命名为2E8,其分泌的抗体为免疫球蛋白G 2a亚型,效价为1∶4.1×105,亲和力常数为5.14×106 L/mol;采用间接酶联免疫吸附测定检测单克隆抗体2E8特异性,结果表明,单克隆抗体2E8与鸡、鸭检测原的交叉反应率均为25%;与牛、羊检测原的交叉反应率分别为1.7%、6.3%;免疫印迹检测结果显示,单克隆抗体2E8与猪检测原反应条带清晰,与羊、鸡、鸭检测原反应条带轻微,与牛检测原几乎不发生反应。
关键词:猪骨骼肌肌钙蛋白T;单克隆抗体;肉类掺假;间接酶联免疫吸附测定;免疫学特征
Preparation and Characterization of Monoclonal Antibody against Porcine Skeletal Muscle Troponin T
ZHANG Jing1, LI Yujing2, ZHANG Erjing3, LI Ziran3, LIU Jingjing1, LI Chunsheng1,*
(1. Institute of Biology, Hebei Academy of Science, Shijiazhuang 050081, China; 2. Hebei Jiaotong Vocational and Technical College, Shijiazhuang 050035, China; 3. College of Life Sciences, Hebei Normal University, Shijiazhuang 050024, China)
Abstract: In order to prepare monoclonal antibodies against porcine skeletal muscle troponin T (sTnT), porcine skeletal muscle troponins were extracted by biochemical methods and used to immunize mice. By means of cell fusion, we acquired hybridoma cell strains that can secrete monoclonal antibodies (mAbs) stably. Ascites was induced in vivo to further prepare and characterize monoclonal antibodies against sTnT. Finally, we screened out one hybridoma cell strain that secretes mAb stably and named it 2E8. The monoclonal antibody 2E8 belonged to the IgG2a subtype, whose titer and affinity constant were 1 : 4.1 × 105 and 5.14 × 106 L/mol, respectively. The specificity of 2E8 was evaluated by indirect enzyme-linked immunosorbent assay (iELISA). The cross-reactivity with chicken sTnT and duck sTnT were both 25%. The cross-reactivity with bovine sTnT and goat sTnT were 1.7% and 6.3% respectively. Immunoblotting data showed that the monoclonal antibody 2E8 exhibited a clear band after reaction with the porcine antigen, but only a slight band after reaction with the goat, chicken, or duck antigen. In addition, the monoclonal antibody hardly reacted with the bovine antigen.
Keywords: porcine skeletal muscle troponin T; monoclonal antibody; meat adulteration; indirect enzyme-linked immunosorbent assay; immunological characteristics
DOI:10.7506/rlyj1001-8123-20210417-102
中圖分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2021)09-0033-05
引文格式:
张静, 李玉静, 张二敬, 等. 猪骨骼肌肌钙蛋白T单克隆抗体的制备及鉴定[J]. 肉类研究, 2021, 35(9): 33-37. DOI:10.7506/rlyj1001-8123-20210417-102. http://www.rlyj.net.cn
ZHANG Jing, LI Yujing, ZHANG Erjing, et al. Preparation and characterization of monoclonal antibody against porcine skeletal muscle troponin T[J]. Meat Research, 2021, 35(9): 33-37. DOI:10.7506/rlyj1001-8123-20210417-102.
http://www.rlyj.net.cn
肉类及其制品是百姓餐桌上不可或缺的美味,市场对肉类的需求逐年增加,肉类产品的质量问题随之成为重要的民生问题,在利益驱使下,肉类及其制品掺假问题频繁发生。例如,猪肉、鸡肉或鸭肉部分代替牛肉或羊肉[1-2]、马肉充当牛肉[3]、马肉冒充驴肉[4]等。目前,对肉类及其制品掺假检测技术主要有感官鉴别[5]、聚合酶链式反应[6-12]、红外光谱[13-17]、色谱-质谱联用[18-22]、酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)[23-27]等方法。ELISA方法基于抗原与抗体的特异性结合,从而捕获目的蛋白,具有高敏感性、特异性的特点,且方法简便,不需要昂贵的仪器设备[28]。
肉制品加工过程中常采用的蒸煮、烘烤等处理会导致蛋白质降解或损失[28]。对耐热性标志蛋白的研究发现,肌钙蛋白具有热稳定性,可以作为生肉及热加工肉制品的肉源性成分鉴别标志蛋白[29-30]。骨骼肌肌钙蛋白是调节横纹肌收缩功能的结构蛋白,包括sTn T、sTn C和sTn I 3 个亚基,其分子质量分别为37、18、24 kDa[31-34]。
本研究采用2 种蛋白质提取方法[28-29],对猪骨骼肌肌肉组织进行研磨、煮沸、匀质等操作,获得猪骨骼肌肌钙蛋白免疫原及检测原。通过免疫小鼠制备单克隆抗体,并对抗体的效价、特异性等特征进行评价。本研究对建立猪肉源性成分免疫学鉴别方法,进一步促进肉类制品掺杂、掺假的快速检测研究具有重要意义。
1 材料与方法
1.1 材料与试剂
弗氏完全佐剂、弗氏不完全佐剂、聚乙二醇(polyethylene glycol,PEG)、细胞培养板 美国康宁公司;DMEM培养基、胎牛血清 美国Gibco公司;HAT培养基补充剂(50×)Hybri-MaxTM、HT培养基补充剂(50×)Hybri-MaxTM、免疫球蛋白(immunoglobulins,Ig)亚型检测试剂盒 美国Sigma公司;辣根过氧化物酶标记山羊抗小鼠IgG 北京中杉金桥生物科技有限公司;丙烯酰胺、亚甲基双丙烯酰胺、甘氨酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、Tris、四甲基乙二胺(N,N,N,N-tetramethylethylenediamine,TEMED) 美国BBI公司;其他试剂均为国产分析纯。
BALB/c小鼠由河北医科大学实验动物中心提供,动物生产许可证号:SCXK(冀)2018-004。
1.2 仪器与设备
MCO-15AC CO2培养箱 日本Sanyo公司;SW-CJ-2FD净化工作台 苏州净化设备有限公司;CKX41SF倒置显微镜 日本Olympus公司;4710超声破碎仪
美国Cole-Parmer仪器公司;Heraus Multifuge高速冷冻离心机、ND2000超微量核酸蛋白测定仪、MT-13K-L迷你手持均质仪 杭州米欧仪器有限公司、Multiskan Go 1510型酶标仪 德国Thermo公司。
1.3 方法
1.3.1 猪骨骼肌肌钙蛋白免疫原的提取及SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electropheresis,SDS-PAGE)鉴定
取新鲜猪腿肉10 g,去除脂肪及结缔组织,剁碎,加入20 mL 0.15 mol/L NaCl溶液,用匀质仪匀质1 h。超声波(100 W、5 min)处理后沸水浴20 min,6 000 r/min离心30 min,取上清液,121 ℃、0.12 MPa处理30 min。用Whatman No.1滤纸过滤,向滤液中按体积比1∶3.74加入体积分数90%乙醇,8 000 r/min离心20 min,弃上清,将沉淀溶于0.01 mol/L磷酸盐缓冲液中,得到猪骨骼肌肌钙蛋白免疫原,用超微量核酸蛋白测定仪测定溶液蛋白质量浓度,于-20 ℃或-80 ℃保存备用。
配制12%分离胶、5%浓缩胶,对猪骨骼肌肌钙蛋白免疫原进行SDS-PAGE分析。
1.3.2 檢测原的提取及SDS-PAGE鉴定
取新鲜猪、牛、羊、鸡、鸭腿肉若干,切块、分装,于-80 ℃保存,使用前于室温放置3 h完全解冻。分别称取各种肉样10 g,剁碎,分别装于离心管中,沸水浴15 min后,立即用冰水冷却,向离心管中加入20 mL含0.5 mol/L NaCl的0.01mol/L磷酸盐缓冲液,匀质1 h。6 000 r/min离心30 min,弃沉淀,取上清,得到以上各物种骨骼肌提取物,即为相应骨骼肌肌钙蛋白检测原,用超微量核酸蛋白测定仪测定溶液蛋白质量浓度,于-20 ℃或-80 ℃保存备用。
配制12%分离胶、5%浓缩胶,对检测原进行SDS-PAGE鉴定。
1.3.3 动物免疫
用生理盐水将猪骨骼肌肌钙蛋白免疫原稀释至0.2 mg/mL,取600 μL稀释的免疫原溶液与等体积弗氏佐剂混合振荡10 min,首次免疫选用弗氏完全佐剂,之后免疫选用弗氏不完全佐剂。取BALB/c小鼠3 只,向其颈背部注射上述含弗氏佐剂的猪骨骼肌肌钙蛋白免疫原,注射剂量400 μL/只,共免疫4 次,每隔2 周免疫1 次,最后一次免疫10 d后断尾取血,间接ELISA方法检测血清抗体效价,选取效价最高的小鼠进行后续细胞融合实验。
1.3.4 猪骨骼肌肌钙蛋白单克隆抗体的制备
参考文献[27]的方法,采用PEG法进行细胞融合,融合7 d后出现细胞集落,更换HT培养基。用间接ELISA方法检测细胞上清,筛选分泌单克隆抗体为阳性的孔,通过有限稀释法进行细胞亚克隆,得到抗体分泌稳定的杂交瘤细胞株。取1 只BALB/c小鼠进行致敏,向其腹腔内注射500 μL石蜡油,致敏14 d后,向其腹腔注射入杂交瘤细胞,12 d后待腹部膨大取腹水,采用辛酸-硫酸铵法纯化,得到单克隆抗体,检测抗体质量浓度,-20 ℃保存备用。
1.3.5 猪骨骼肌肌钙蛋白单克隆抗体特征评价
1.3.5.1 单克隆抗体效价测定
采用间接ELISA方法进行单克隆抗体效价的测定[27]。
用含0.015 mol/L Na2CO3、0.035 mol/L NaHCO3的碳酸盐缓冲液将检测原质量浓度稀释至2 μg/mL,加入96 孔板,每孔100 μL,37 ℃包被1 h;用含0.1%吐温-20的0.01 mol/L磷酸盐缓冲液洗涤,每孔洗涤3次,拍干;用含0.1%吐温-20的0.01 mol/L磷酸盐缓冲液将单克隆抗体以1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600、1∶51 200、1∶102 400、1∶204 800、1∶409 600、1∶819 200做倍比稀释,每孔加入100 μL,37 ℃孵育45 min,洗涤,拍干;每孔加入100 μL山羊抗小鼠IgG二抗(稀释比例1∶10 000),37 ℃孵育30 min,洗涤,拍干;每孔加入100 μL显色液,37 ℃避光反应12 min;每孔加入50 μL终止液,于450 nm波长处测定光密度(optical density,OD)值。阴性对照孔(0.01 mol/L、pH 7.4的磷酸盐缓冲液)记为OD0,各实验孔记为ODt,以ODt/OD0≥2.1所对应的稀释比作为效价检测结果。
1.3.5.2 单克隆抗体亚型测定
按照Ig亚型检测试剂盒的说明书步骤进行测定。
1.3.5.3 单克隆抗体特异性测定
用间接ELISA方法测定单克隆抗体与牛、羊、鸡、鸭骨骼肌提取物的效价[27]。
用免疫印迹方法检测单克隆抗体与猪、牛、羊、鸡、鸭骨骼肌提取物结合的特异性。取1.3.2节制备的猪、牛、羊、鸡、鸭检测原各15 μg,经SDS-PAGE电泳后,切胶,92 mA恒定电流转膜1 h,封闭,洗膜,用封闭液(含5 g/100 mL牛血清白蛋白、0.05%吐温-20、0.8 g/100 mL NaCl、0.01 mol/L的Tris缓冲液)将单克隆抗体溶液按体积比1∶2 000稀释,37 ℃摇动孵育1~1.5 h,洗膜,再用上述封闭液将山羊抗小鼠IgG二抗按1∶3 000稀释,37 ℃摇动孵育1~1.5 h,洗膜后滴加显色液,拍照。
1.3.5.4 单克隆抗体亲和力测定
采用间接ELISA方法[27],将猪骨骼肌肌钙蛋白检测原按质量浓度梯度(1、0.5、0.25、0.125 μg/mL)进行包被;对每个检测原质量浓度下,均用含0.1%吐温-20的0.01 mol/L磷酸盐缓冲液将单克隆抗体按照1∶10、1∶30、1∶90、1∶270、1∶810、1∶2 430、1∶7 290、1∶21 870、1∶65 610、1∶196 830、1∶590 490、1∶1 771 470、1∶5 314 410、1∶15 943 230和1∶47 829 690做倍比稀释,每孔加入100 μL,37 ℃孵育45 min,洗涤,拍干;每孔加入100 μL山羊抗小鼠IgG二抗(稀释比例1∶10 000),37 ℃孵育30 min,洗涤,拍干;每孔加入100 μL显色液,37 ℃避光反应12 min;每孔加入50 μL终止液,于450 nm波长处测定OD值。以抗体浓度的对数值作为横坐标,以对应OD值作为纵坐标,绘制曲线。根据下式计算亲和力常数。
式中:Ab和Ab分别表示抗原稀释中2 个不同猪骨骼肌肌钙蛋白检测原质量浓度下OD=1/2ODmax时分别对应的抗体浓度;n表示对应猪骨骼肌肌钙蛋白检测原质量浓度间的稀释倍数。4 个质量浓度下分别计算Ka后,结果取平均值。
1.4 数据处理
使用Excel软件、GraphPad Prism 8作图软件处理数据。
2 结果与分析
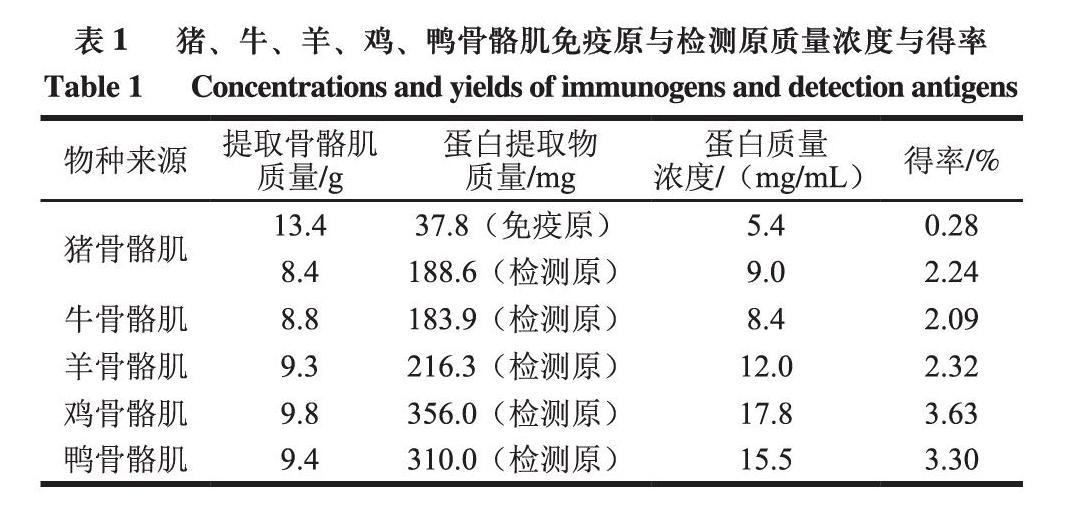
2.1 豬、牛、羊、鸡、鸭骨骼肌免疫原及检测原的提取结果
由表1可知,分别取猪、牛、羊、鸡、鸭骨骼肌肌肉组织,猪骨骼肌提取后得到蛋白提取物中免疫原及检测原质量浓度分别为5.4 mg/mL和9.0 mg/mL,得率分别为0.28%和2.24%。牛、羊、鸡、鸭骨骼肌检测原蛋白质量浓度分别为8.4、12.0、17.8、15.5 mg/mL,得率分别为2.09%、2.32%、3.63%和3.30%。
2.2 猪、牛、羊、鸡、鸭骨骼肌免疫原及检测原的SDS-PAGE结果
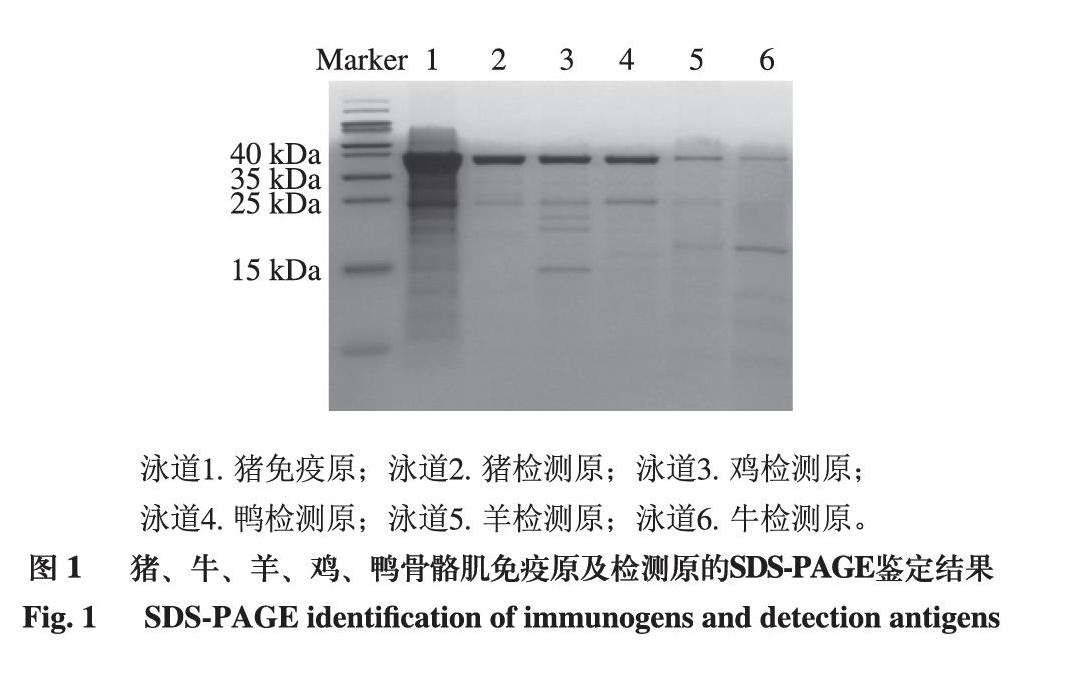
由图1可知,5 种动物的骨骼肌肌钙蛋白提取后,蛋白条带清晰且颜色较深的共有条带主要有2 条。在37 kDa(sTn T)和24 kDa(sTn I)处,猪免疫原及猪、牛、羊、鸡、鸭检测原均有清晰条带,其中猪免疫原条带最为明显,但24 kDa处不及37 kDa处明显,牛、羊、猪检测原在24 kDa处条带较浅。此外,在18 kDa处(sTn C)牛、羊检测原有较清晰条带,其余检测原没有;鸡检测原在15 kDa处有1 条特异条带,鸭检测原在16 kDa处有1 条特异条带。以上结果表明,在蛋白提取过程中不同肌钙蛋白亚型在不同物种中的损失程度不同。
泳道1. 猪免疫原;泳道2. 猪检测原;泳道3. 鸡检测原;泳道4. 鸭检测原;泳道5. 羊检测原;泳道6. 牛检测原。
2.3 单克隆抗体效价测定结果
融合7 d后,用间接ELISA方法检测细胞上清,筛选出抗体分泌为阳性的孔,经过3~4 次亚克隆至全阳,得到1 株单克隆抗体细胞株,命名为2E8。由表2可知,单克隆抗体2E8经纯化后,测得其蛋白质量浓度为6.2 mg/mL;包被猪检测原质量浓度2 μg/mL时,其效价为1∶4.1×105。
2.4 单克隆抗体2E8亚型测定结果
由图2可知,2E8与IgG2a反应的A450 nm为2.49,与其他亚类抗体反应的A450 nm均很低,因此,细胞株2E8分泌的抗体亚型为IgG2a。
2.5 单克隆抗体2E8特异性测定结果
2.5.1 间接ELISA法检测结果
由图3可知,单克隆抗体2E8与猪检测原反应的效价为1∶4.1×105,与鸡、鸭检测原反应的效价均为1∶1.0×105,交叉反应率为25%;与牛、羊检测原反应的效价较低,分别为1∶6.4×103、1∶2.6×104,交叉反应率分别为1.7%、6.3%。以上结果表明,单克隆抗体2E8可以在一定程度上区分猪骨骼肌提取物与牛、羊、鸡、鸭的骨骼肌提取物。
2.5.2 免疫印记检测结果
泳道1. 鸭免疫原;泳道2. 鸡检测原;泳道3. 羊检测原;泳道4. 牛检测原;泳道5. 猪检测原。
由图4可知,免疫印迹结果显示,在37 kDa(sTn T)处,单克隆抗体2E8与猪检测原反应明显,条带清晰,与羊、鸡、鸭检测原反应轻微,与牛检测原几乎不反应。这说明单克隆抗体2E8可以特异性结合猪骨骼肌肌钙蛋白T亚基(sTn T),与羊、鸡、鸭骨骼肌肌钙蛋白T有轻微交叉反应,与牛骨骼肌肌钙蛋白T无交叉反应。
间接ELISA与免疫印迹的分析结果均表明,单克隆抗体2E8虽然能在一定程度上区分猪骨骼肌提取物与牛、羊、鸡、鸭的骨骼肌提取物,但与牛、羊、鸡、鸭的骨骼肌提取物均存在一定的交叉反应。这与猪、牛、羊、鸡、鸭的骨骼肌肌钙蛋白的氨基酸序列具有高相似性有关。
2.6 单克隆抗体亲和力常数
采用间接ELISA法测定4 种包被质量浓度下的抗原与倍比稀释的抗体反应的OD值,绘制单克隆抗体2E8的亲和力曲线。通过GraphPad Prism 8软件计算OD=1/2ODmax时对应的抗体物质的量浓度,4 个质量浓度下分别计算Ka后,取平均值,最终获得单克隆抗体2E8的亲和力常数
Ka=5.14×106 L/mol。
3 结 论
采用2 种骨骼肌肌钙蛋白提取的方式,分别提取猪骨骼肌肌钙蛋白免疫原与猪、牛、羊、鸡、鸭骨骼肌肌钙蛋白检测原,选择免疫效果好的小鼠进行细胞融合,3 次亚克隆后最终筛选获得抗猪骨骼肌肌钙蛋白的抗体1 株,命名为2E8。通过间接ELISA方法对抗体的特征进行评价。结果表明,单克隆抗体2E8为IgG2a亚型;与牛、羊、鸡、鸭的交叉反应率分别为1.7%、6.3%、25%、25%;亲和力常数为5.14×106 L/mol;免疫印记结果显示抗体2E8能够结合猪骨骼肌肌钙蛋白T亚基。以上结果表明单克隆抗体2E8可以在一定程度上区分猪、牛、羊、鸡、鸭的骨骼肌蛋白提取物,为肉类掺假快速检测技术的发展提供理论与技术支持。
参考文献:
[1] 许如苏, 周广彪, 魏霜, 等. 锁核酸探针多重荧光PCR快速检测肉制品中的4 种动物肉掺假的研究[J]. 检验检疫学刊, 2016, 26(2): 12-16.
[2] 胡馨予, 黄朱梁, 汤海凤, 等. 基于PCR技术的肉类成分溯源鉴定方法研究进展[J]. 食品安全质量检测学报, 2020, 11(11): 3385-3390.
[3] 李丹, 王守偉, 臧明伍, 等. 国内外经济利益驱动型食品掺假防控体系研究进展[J]. 食品科学, 2018, 39(1): 320-325. DOI:10.7506/spkx1002-6630-201801048.
[4] 刘国强, 罗建兴, 其勒木格, 等. 网销市场中驴肉真伪及掺假分析[J]. 食品安全质量检测学报, 2020, 11(9): 2816-2821.
[5] 汤祝华, 周玉玲, 周颖雪, 等. 浅析五类问题肉的危害及感官鉴别[J]. 肉类工业, 2015, 36(12): 47-54.
[6] 李婷婷, 张桂兰, 赵杰, 等. 肉及肉制品掺假鉴别技术研究进展[J]. 食品安全质量检测学报, 2018, 9(2): 409-415.
[7] 杜洪振, 赵欣欣, 陈倩, 等. 猪牛肉掺假鉴定技术及其特异性物质研究进展[J]. 食品研究与开发, 2017, 38(13): 199-204. DOI:10.3969/j.issn.1005-6521.2017.13.043.
[8] 苗丽, 李志娟, 王珊, 等. 肉制品中牛源性成分荧光定量聚合酶链式反应方法的建立与应用[J]. 肉类研究, 2015, 29(9): 30-33. DOI:10.15922/j.cnki.rlyj.2015.09.007.
[9] 李慧洁, 蒋会敏, 贾小同, 等. 应用二重PCR技术检测肉制品中的肉源性成分[J]. 农产品加工, 2019, 18(2): 51-62. DOI:10.16693/j.cnki.1671-9646(X).2019.01.049.
[10] MANE B G, MENDIRATTA S K, TIWARI A K, et al. Detection of adulteration of meat and meat products with buffalo meat employing polymerase chain reaction assay[J]. Food Analytical Methods. 2012, 5(2): 296-300. DOI:10.1007/s12161-011-9237-x.
[11] 李宗梦, 赵良娟, 马兴, 等. 肉及肉制品中大鼠成分PCR检测方法研究[J]. 食品研究与开发, 2016, 37(24): 109-113. DOI:10.3969/j.issn.1005-6521.2016.24.026.
[12] 孙海新, 孙不春, 刘伟, 等. 羊肉与鸭肉的分子生物学鉴别技术[J].
肉类研究, 2017, 31(5): 46-50. DOI:10.7506/rlyj1001-8123-201705009.
[13] 陈迎丽, 何钰, 龚会琴, 等. 基于欧式距离法或因子化法的近红外光谱技术对牛肉掺假鉴定的研究[J]. 食品研究与开发, 2019, 40(15): 141-146. DOI:10.12161/j.issn.1005-6521.2019.15.023.
[14] ALAMPRESE C, AMIGO J M, CASIRAGHI E, et al. Identification and quantification of turkey meat adulteration in fresh, frozen-thawed and cooked minced beef by FT-NIR spectroscopy and chemometrics[J]. Meat Science, 2016, 121: 175-181. DOI:10.1016/j.meatsci.2016.06.018.
[15] 丁武, 杨志敏. 近红外光谱技术快速鉴别原料肉掺假的可行性研究[J].
肉类研究, 2011, 25(2): 25-28.
[16] 黄伟, 杨秀娟, 张燕鸣, 等. 近红外光谱技术在肉类定性鉴别中的研究进展[J]. 肉类研究, 2014, 28(1): 31-34. DOI:10.7506/rlyj1001-8123-201401008.
[17] 张丽华, 相启森, 李顺峰, 等. 基于支持向量机的近红外光谱技术鉴别掺假牛肉[J]. 西北农林科技大学学报, 2016, 44(12): 201-205. DOI:10.13207/j.cnki.jnwafu.2016.12.027.
[18] 郑越男, 郭亚辉, 曹进, 等. 液相色谱质谱技术在食品掺假中的应用[J]. 食品安全质量检测学报, 2019, 10(23): 7953-7958. DOI:10.19812/j.cnki.jfsq11-5956/ts.2019.23.026.
[19] 孙英慧, 王守云, 冯雪松, 等. 超高效液相串联质谱法检测牛肉中的马肉[J]. 化学研究, 2019, 30(6): 612-618. DOI:10.14002/j.hxya.2019.06.010.
[20] 王綪, 李璐, 王佳奕, 等. 电子鼻结合气相色谱-质谱法对宁夏小尾寒羊肉中鸭肉掺假的快速检测[J]. 食品科学, 2017, 38(20): 222-228. DOI:10.7506/spkx1002-6630-201720032 .
[21] FORNAL E, MONTOWSKA M. Species-specific peptide-based liquid chromatography-mass spectrometry monitoring of three poultry species in processed meat products[J]. Food Chemistry, 2019, 283: 489-498. DOI:10.1016/j.foodchem.2019.01.074.
[22] 張颖颖, 李莹莹, 范维, 等. 测定肉串源性成分的液相色谱-串联质谱与聚合酶链式反应方法对比研究[J]. 肉类研究, 2020, 34(7): 70-77. DOI:10.7506/rlyj1001-8123-20200512-119.
[23] 职爱民, 余曼, 乔苗苗, 等. 免疫技术在动物源性食品快速检测中的研究进展[J]. 肉类研究, 2019, 33(5): 60-66. DOI:10.7506/rlyj1001-8123-20190124-020.
[24] 马永征, 马冬, 白娣斯, 等. 免疫学检测肉类制品掺假研究进展[J].
肉类研究, 2012, 26(9): 26-29. DOI:10.7506/rlyj1001-8123-201209007.
[25] JIANG X Y, FULLER D, HSIEH Y H P, et al. Monoclonal antibody-based ELISA for the quantification of porcine hemoglobin in meat products[J]. Food Chemistry, 2018, 250: 170-179. DOI:10.1016/j.foodchem.2018.01.032.
[26] LIU L, CHEN F C, HSIEH Y H P, et al. Sensitive monoclonal antibody-based sandwich ELISA for the detection of porcine skeletal muscle in meat and feed products[J]. Journal of Food Science, 2006, 71(1): M1-M6. DOI:10.1111/j.1365-2621.2006.tb12393.x.
[27] 刘静静, 张静, 孙劲冲, 等. 鸭骨骼肌肌钙蛋白I单克隆抗体的制备及其特征[J]. 肉类研究, 2020, 34(2): 60-64. DOI:10.7506/rlyj1001-8123-20191204-294.
[28] CHEN F C, HSIEH Y H P, BRIDGMAN R C. Monoclonal antibodies to porcine thermal-stable muscle protein for detection of pork in raw and cooked meats[J]. Journal of Food Science, 1998, 63(2): 201-205. DOI:10.1111/j.1365-2621.1998.tb15709.x.
[29] CHEN F C, HSIEH Y H P. Detection of pork in heat-processed meat products by monoclonal antibody-based ELISA[J]. Journal of AOAC International, 2000, 83(1): 79-85. DOI:10.1093/jaoac/83.1.79.
[30] CHEN F C, HSIEH Y H P, BRIDGMAN R C. Monoclonal antibodies against troponin I for the detection of rendered muscle tissues in animal feedstuffs[J]. Meat science, 2002, 62(4): 405-412. DOI:10.1016/S0309-1740(02)00029-3.
[31] 张镭, 孙俊红, 李永强. 骨骼肌肌钙蛋白I的研究进展及法医学应用展望[J]. 中国法医学杂志, 2013, 28(4): 300-302. DOI:10.13618/j.issn.1001-5728.2013.04.012.
[32] 陈健, 陈敏, 陈彬, 等. 快速骨骼肌型肌钙蛋白I的研究进展[J].
生命的化学, 2004, 24(3): 183-185. DOI:10.3969/j.issn.1000-1336.2004.03.001.
[33] 马学华, 刘忠英, 张萱, 等. 亲和层析法提取纯化人心肌肌钙
蛋白I[J]. 哈尔滨医科大学学报, 2008, 42(3): 258-260. DOI:10.3969/j.issn.1000-1905.2008.03.013.
[34] 马志民. 大豆脂肪氧化酶单克隆抗体的制备及其检测应用[D].
保定: 河北农业大學, 2007: 22-35.
