日粮添加尿素对瘤胃上皮细胞增殖、凋亡以及吸收转运能力的影响
2021-10-12陆钟岩张雯萱阿合拉托留拜
陆钟岩,张雯萱,阿合拉·托留拜
1 南京农业大学动物医学院;农业农村部动物生理生化重点试验室,江苏南京 210095
2 南京农业大学动物医学院,江苏南京 210095
0 引言
反刍动物(如奶牛、绵羊和山羊等)是重要的农用动物,它们依靠瘤胃共生微生物分解植物蛋白和非蛋白氮源(尿素),并将分解产物合成反刍动物可以利用的微生物蛋白,为动物体提供营养。在目前的大规模集约化畜牧生产中,大多数养殖者通过饲喂高精料日粮来提高动物的肉、奶产量。豆粕是反刍动物饲养中常用和主要的蛋白来源,在第三世界国家中,大豆也是人类消费的重要粮食之一,同时养猪业和家禽养殖业也将大豆作为饲料的主要蛋白成分。加之新冠肺炎疫情的影响和过去几年的中美贸易争端,造成了主要农业国减产,国际市场的大豆价格可能会大幅提高。而我国作为主要的大豆进口国,进口的大豆主要制造动物饲料,大豆价格上涨无形中提高了动物饲养的成本。因此,研究在反刍动物养殖中的替代氮源,包括植物蛋白氮和非蛋白氮,将有助于降低饲养成本,减少对大豆进口的依赖。
尿素是一种参与反刍动物蛋白代谢的非蛋白氮源之一,氮含量高且价格低廉。反刍动物自身的尿素在肝脏中通过鸟氨酸-尿素循环产生,并通过肝静脉进入血液。肝脏合成的尿素可以再循环回消化道或排泄到尿液中[1,2]。在反刍动物的消化道中,瘤胃是最大、最重要的营养物质消化吸收室。在瘤胃中,无论是日粮中或者是循环回消化道的尿素都会被微生物分解生成氨(NH3)[3],并将其作为合成微生物蛋白的原料,从而促进微生物生长[4]。瘤胃微生物与消化液混合后流入小肠。在小肠中,微生物蛋白通过酶解释放氨基酸和核酸[5]。通过这种方式,将反刍动物无法利用的日粮中的蛋白氮和尿氮分解成NH3-N,NH3-N通过微生物固氮转化为宿主可用的微生物蛋白氮,为宿主提供营养。科学家长期以来一直在研究用尿素作为一种低成本氮源,以取代反刍动物日粮中的一部分植物蛋白成分[6],但不能过度使用,在畜牧生产中,日粮中添加尿素能够大幅提高反刍动物瘤胃中NH3的浓度,提高动物NH3中毒的风险。当尿素添加量达到25 g/kg干物质(DM)时,会降低动物的干物质摄入量和体重增加值[7]。
Abdoun等[8]报告,当瘤胃液的生理pH值低于6.5,瘤胃内的NH3主要以NH4+的形式被吸收。瘤胃上皮细胞对NH4+的吸收需要载体或通道的帮助,与NH3相比,其吸收速度较慢。理论上,瘤胃液体的低pH值可以降低NH3从瘤胃进入血流的吸收率,降低NH3中毒的风险。通过饲喂高精料日粮可升高瘤胃中短链脂肪酸(Short Chain Fatty Acid,SCFA)的产生,降低瘤胃pH值[9],从而降低因日粮中添加尿素产生NH3中毒的风险。基于以上理论,Xu等[10]将尿素与高精日粮(45%NFC)混合饲喂,证明了高精日粮饲喂条件下尿素可替代75%的日粮蛋白,而不对动物体造成危害。Lu等[11]研究了添加尿素后瘤胃微生物组及其镍依赖性微生物群落的变化,并进一步分析了瘤胃环境因素(包括发酵变量和镍浓度)在这些群落重建中的作用。但是目前缺少日粮添加尿素对瘤胃上皮细胞功能,特别是增殖、凋亡和吸收转运功能影响的研究。由于中精日粮(30%NFC)可以显著提高瘤胃上皮细胞的增殖、凋亡和吸收转运功能,因此,在本研究中,采用尿素与中精日粮混合并取代日粮中部分豆粕的方案,在整体动物水平上与粗料饲喂条件下的瘤胃上皮细胞对比,研究日粮添加尿素对胃上皮细胞增殖、凋亡和上皮吸收转运功能相关基因表达的影响;并在组织水平上研究尿素对瘤胃上皮细胞吸收转运能力的调节。由于之前的研究表明,饲喂中精日粮可以显著调节研究瘤胃发酵参数、加快瘤胃上皮细胞的增殖与凋亡和增强上皮吸收转运功能。所以,进一步探讨添加尿素取代日粮中的部分豆粕之后,尿素+中精日粮对瘤胃上皮功能的调节与中精日粮相比是否有改变。
1 材料与方法
1.1 试验设计与动物饲养
从溧水山羊养殖场(江苏省南京市)购得18 只波杂山羊(4月龄,体重14~16 kg)。饲养地点为南京农业大学动物房,每只羊被饲养在单独的栏舍里,可以自由饮水。在14 天适应期(只饲喂干草饲料)后,将山羊随机分为3 组,分别接受含有无尿素+纯粗料(LC组,n=6)、0%缓释尿素+30%精料(MC组,有豆粕,n=6)以及1%DM缓释尿素+30%精料(Urea组,部分豆粕被替代,n=6)的饲料。日粮符合《NY/T816—2004 产肉山羊饲养标准》的营养要求,日粮的成分和化学成分见表1。在试验开始和结束时对饲料进行取样分析,样品的干物质、灰分、粗脂肪和粗蛋白含量按照AOAC程序进行分析。根据Van Soest等[12]的程序分析酸性洗涤剂纤维(ADF)和中性洗涤剂纤维(NDF)值。

表1 日粮营养和化学成分
在试验期间,每天07:00和19:00时喂食混合日粮,每天测量每只山羊的采食量和剩余日粮量。连续饲喂28 天,在第29天,18 只山羊在早晨喂食后6h在当地屠宰场屠宰,并收集瘤胃内容物和上皮。瘤胃内容物通过4 层粗棉布过滤,四等分(50 mL)的瘤胃液体储存在-20℃用于SCFA浓度、pH值和NH3-N浓度测定。自瘤胃腹侧盲囊采集上皮并剪成1cm×1cm的小块,冲洗,放置在RNALate溶液中过夜,然后在-80 ℃下储存,用于mRNA提取和Real-Tme PCR,如下所述。在试验的最后1 天,在早晨喂食前1 h,通过颈静脉穿刺将血样采集到5mL EDTA涂层真空采集器管中。立即将血样置于冰上,4 ℃,1 500 r/min,离心15 min以获得血清,然后在-20 ℃下储存。
1.2 瘤胃NH3-N、SCFA 浓度以及pH 值的测定
按照Yang 等[13]的方法,使用气相色谱仪(HP6890N,Agilent Technologies,Wilmington,DE)测定瘤胃SCFA浓度;采用NH3分析试剂盒(南京建成,中国南京)测定瘤胃NH3-N浓度。在双尾T检验中,当P<0.05时,差异被认为是显著的;使用pH计进行瘤胃pH值测定(Mettler Toledo Delta 320;Mettler-Toledo Group,Halstead,=UK)。
1.3 瘤胃上皮的形态学观察
根据Malhi等[14]的描述,测量了瘤胃乳头的密度、长度和宽度,即使用1 cm2福尔马林固定的瘤胃上皮计算乳头密度(乳头个数/cm2)。使用滑动卡尺测量福尔马林固定上皮样本中的15 个乳头的长度和宽度。
用Odongo等[16]的方法,将单个福尔马林固定乳头包埋在石蜡中,并以6 μm厚切片。每个切片用苏木精和曙红染色,然后安装在载玻片上进行显微镜分析。瘤胃上皮每个样品选四张切片,使用Image Pro Plus6.0软件(Media Cybernetics,Silver Spring,MD,USA)观察所有样本中上皮细胞的形态,每个切片选取4 个区域,计算单位面积内颗粒层和棘突层细胞个数和单位长度上的基底层细胞个数。
用流式细胞仪检测细胞周期。每个样品计数10 000 个细胞,CELLQuest软件收集细胞大小及细胞DNA含量等数据,ModFit LT for Macintosh软件分析结果。
1.4 Real-Tme PCR
用Neasy微型试剂盒(Qiagen,Shanghai,China)从瘤胃上皮提取总RNA。使用随机六聚体引物(Invitrogen,Shanghai,China)和M-MLV(莫罗尼鼠白血病病毒)逆转录酶(Fermentas,Burlington,ON,Canada)合成cDNA。使用StepOne Plus实时PCR系统(Applied Biosystems,Den Ijssel,Netherlands)和SYBR Green(Roche,Shanghai,China)进行定量PCR检测。选择甘油醛-3-磷酸脱氢酶(GADPH)作为管家基因。根据NCBI中的可用序列设计靶基因的引物(表2)。引物的扩增效率通过一系列稀释的上皮cDNA测定。所有样品均一式三份,并根据2-ΔΔCT法[15]。利用扩增结束时进行的熔融曲线分析,检查扩增产物的特性和纯度。

表2 Real-time PCR 引物
1.5 Ussing Chamber 瘤胃上皮离体培养
利用Ussing Chamber上皮体外培养系统,通过测量尿素跨上皮转运率,研究尿素特异性载体,尿素转运蛋白-B(UT-B)的蛋白活性。按照Lu等[9]的方法配置标准缓冲液,配方见表3,并保持38 ℃,动物在屠宰后2~3min内从腹腔取出前胃。从腹侧囊取出一块约400 cm2的瘤胃壁,在38 ℃缓冲溶液中反复清洗,并从肌肉层剥离。随后将组织浸泡在通有95%CO2和5%O2的缓冲溶液中运输至实验室。取瘤胃上皮(3 cm ×3 cm)安装在Ussing Chamber培养小室的两半之间,暴露面积为3.14 cm2。系统两侧注入16 mL培养液,配方见表3,对安装好的组织进行浸泡,并在38 ℃下用O2/CO2(5:95)的混合气体进行充气,模拟瘤胃和血液环境,并设定瘤胃上皮乳头一侧为瘤胃侧,对侧为血液侧。根据Lu等[9]的方法进行电生理参数监控,上皮的瘤胃侧培养pH值保持在6.4,血液侧pH保持在7.4,向血液侧加入C14标记的尿素。培养一段时间后从瘤胃侧采集培养液,并与闪烁液混合(Rotiszint,Roth–Karlsruhe,Germany),通过使用β计数器(LKB Wallace Perkin Elmer;Überlingen,Germany)。测定培养液中出现的放射性进而来计算尿素在瘤胃上皮的转运率。

表3 Ussing chamber 培养液配方
2 结果
2.1 各组瘤胃发酵参数、血浆尿素氮(BUN)浓度比较
如表4结果所示,与LC组相比,Urea组的乙酸、丙酸、丁酸和总SCFA浓度均显著增加,分别增加约30%、50%、35%和35%(P<0.05)。同时,丙酸、丁酸和总SCFA的浓度在Urea组和MC组之间并未显示出显著变化(P>0.05)。Urea组的瘤胃pH值与LC组相比显著降低(P<0.05),与MC组相比则无出显著差异(P>0.05)。随着日粮精料的增加,瘤胃NH3-N和BUN浓度显著升高(P<0.05)。而Urea组的瘤胃NH3-N和BUN浓度显著高于MC组(P<0.05)。
将职务犯罪调查中的技术运用划分为两条泾渭分明的路线,并非是将这样的路线之争实质化,而是将其中的技术原理予以提炼后,分析国家对职务犯罪调查技术运用的制度安排。从目前来看,国家对于职务犯罪调查的技术安排体现为发展与制约并重。一方面,在技术运用较为薄弱的科学技术方面强化投入与产出,在最短的时间内提升战斗力。另一方面,通过制度设计制约人文技术,使其始终保持在稳定可控的范围内。这样扬长避短的制度思路或许还将长期存在于职务犯罪调查的技术安排之中。

表4 对比各组瘤胃发酵参数和血浆Urea-N 浓度(n=6)
2.2 瘤胃上皮的形态学分析
如表5结果所示,由于日粮精料水平的增加,MC组与LC组相比,瘤胃乳头的长度、宽度和密度均显著增加(P<0.05)。Urea组与LC组相比,这些参数同样显著增加(P<0.05)。而Urea组和MC组相比,瘤胃乳头的以上参数差异均不显著(P<0.05)。通过计算Urea组单位面积瘤胃上皮内乳头吸收面积显著高于LC组,同时低于MC组,但是降低趋势并不明显(P>0.05)。

表5 对比各组瘤胃上皮乳头参数(n=6)
如表6结果所示,与LC组相比,Urea组和MC组瘤胃上皮棘突层和颗粒层细胞密度以及层数显著升高(P<0.05),Urea组与MC相比较则不显著;而3组之间基底层细胞层数和细胞数量无差异显著。

表6 对比各组瘤胃上皮形态学变化
2.3 各组瘤胃上皮细胞周期的比较
如表7所示,与LC组相比,Urea组山羊瘤胃上皮细胞S期和G2/M期细胞百分率均显著升高(P<0.05),Urea组与MC相比较则不显著;Urea 组的G0/G1 期细胞百分率显著低于LC 组(P<0.05),但与MC组之间差异不显著。
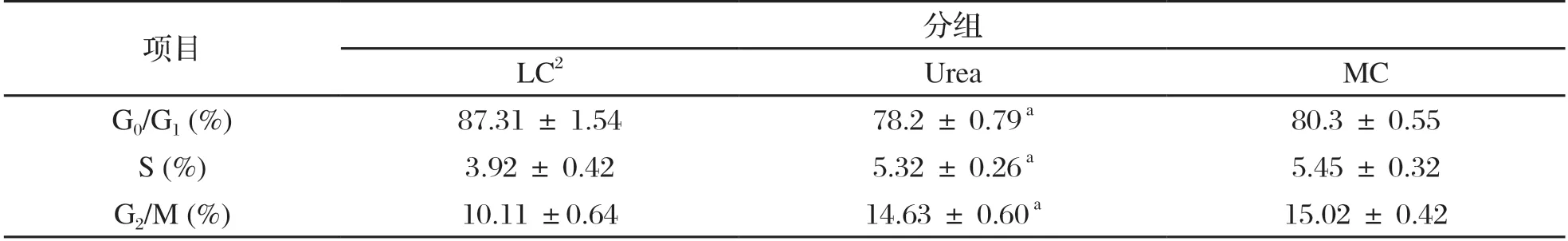
表7 对比各组瘤胃上皮细胞周期的变化1
2.4日粮添加尿素对山羊瘤胃上皮细胞增殖凋亡相关基因mRNA 表达的影响
如图1结果所示,Urea组山羊瘤胃上皮细胞增殖相关基因cyclin A、cyclin B1、cyclin D1、cyclin E1、CDK1、CDK2、CDK4、和CDK6mRNA表达均显著高于LC组(P<0.05),同时这些基因的表达量与MC组无显著差异。

图1 瘤胃上皮细胞增殖相关基因mRNA 表达
如图2结果所示,Urea组山羊瘤胃上皮细胞凋亡相关基因Caspase 3、Caspase 8、Caspase 9、p53、Bcl 2与Bax的mRNA表达都显著高于LC组(P<0.05),与MC组相比Caspase 9、Bax的表达量显著降低(P<0.05),Bax则显著升高(P<0.05),其余基因无显著差异。

图2 瘤胃上皮细胞凋亡相关基因mRNA 表达
2.5日粮添加尿素对山羊瘤胃上皮SCFA 转运载体mRNA 表达的影响
如图3 所示,Urea 组山羊瘤胃上皮三种SCFA–/HCO3

图3 瘤胃上皮SCFA 转运载体mRNA 表达
–交换载体DRA、PAT1和AE2的m RNA 的表达显著高于LC 组(P<0.05),两 种SCFA–与H+的共转运载体MCT1和MCT 4 的m RNA 表达也显著高于LC 组(P<0.05)。但与MC组相比这些基因的表达量差异不显著。
2.6日粮添加尿素对山羊瘤胃上皮pHi 调节相关蛋白和UT-B mRNA 表达的影响

图4 瘤胃上皮pHi 调节相关蛋白和UT-B mRNA 表达
2.7日粮添加尿素对山羊瘤胃上皮UT-B 蛋白活性的影响
如表8 所示,尿素在瘤胃上皮中的转运受瘤胃p H 值、SCFA 浓度和N H3浓度的调节。Ussingchamber 数据显示,与LC 组相比,Urea 组(P<0.0 5)和MC 组(P<0.05)瘤胃上皮将尿素从血液转运到瘤胃能力随着日粮精料水平提高而显著增加。而这两组数据之间对比,MC 组上皮的尿素转运能力则要显著高于Urea 组(P<0.0 5)。结果表明U T-B 蛋白活性由高到低分别为:MC 组、Urea 组以及LC 组。

表8 对比各组血浆尿素跨上皮转运率(n=6)
3 讨论
3.1 瘤胃发酵参数
在所研究的发酵变量中,精料+尿素的混合日粮显著升高了瘤胃乙酸、丙酸和丁酸浓度,瘤胃pH值显著降低,但是与饲喂中精日粮的MC组相比,以上参数没有因为日粮中添加尿素而改变。瘤胃SCFA和H+主要来源于日粮中碳水化合物的微生物发酵水解,这表明Urea组与MC组相比,瘤胃微生物发酵的功能并未改变,这与Currier等[16]的研究一致。因此,日粮中碳水化合物的比例相似会导致所有组中乙酸、丙酸、丁酸以及总SCFA的浓度相近。
N H3是瘤胃中微生物蛋白合成和生长的重要氮源[8]。瘤胃NH3的最适宜浓度约为8.8 mg/dL[17]。然而,当瘤胃NH3浓度超过140 mg/dL时,反刍动物可能遭受NH3中毒[18]。瘤胃NH3的浓度由日粮中氮的水平和通过尿素循环进入瘤胃的尿素决定。尿素可被瘤胃解脲微生物(主要是细菌)迅速水解为NH3,100%可在瘤胃内降解[19]。前人的大量研究结果显示日粮中添加尿素能够大幅提高反刍动物瘤胃中NH3的浓度[20~22],Patra等[23]的研究报道,瘤胃NH3浓度是尿素循环的主要抑制因素。因此Urea组中较高的瘤胃NH3浓度抑制了血液中的尿素通过尿素循环跨过瘤胃上皮进入瘤胃,导致了Urea组BUN浓度显著高于MC组。
3.2 瘤胃上皮形态学和细胞周期
瘤胃上皮对发酵终产物的吸收至关重要,例如50%~85%的SCFA直接通过瘤胃上皮吸收,SCFA的吸收途径主要包括被动扩散和通过载体介导的转运蛋白[24~26],瘤胃上皮乳头表面积决定了上皮的吸收转运能力[13,27,28]。针对山羊和绵羊的研究表明,提高日粮精料水平可以提高瘤胃SCFA浓度,进而增加瘤胃乳头的大小和表面积[29,30]。在本研究中,Urea组的瘤胃乳头长宽、密度和表面积均显著大于LC组,这与Urea组摄入更多的能量和氮源一致,此外,也与Urea组的发酵终产物SCFA浓度更高相一致。因此,Urea组的瘤胃乳头表面积更大,增加了吸收能力。与MC组相比,摄入的能量和氮源几乎相同,导致瘤胃SCFA浓度无显著差异,所以两组的瘤胃乳头长宽、密度和表面积也无显著差别。
本文的研究表明,相比LC组,Urea组中瘤胃上皮中角质层以及棘突层和颗粒层细胞层数增加。这是由于Urea组提高日粮精料水平增加了瘤胃SCFA浓度,进而上调了上皮细胞增殖相关基因表达引起的(图3)。但是表4的数据又显示,瘤胃上皮的棘突层和颗粒层以及基底层细胞数量没有显著的变化,推测这是因为提高日粮精料水平不仅促进了瘤胃上皮的细胞增殖,而且加快了瘤胃上皮细胞的死亡,比如加快瘤胃上皮细胞凋亡水平。同时,瘤胃上皮细胞周期的变化显示,Urea组的G0/G1期细胞所占百分比显著下降,而G2/M期细胞所占百分比显著升高。这个结果表明,Urea组由于调高了日粮精料水平,瘤胃上皮细胞周期进程加快。由于Urea组和MC组的瘤胃SCFA浓度几乎相同,所以它们的瘤胃上皮细胞增殖生长和细胞周期的数据无显著差异。
3.3 瘤胃上皮细胞增殖凋亡相关基因mRNA表达
细胞周期控制系统基于两个蛋白家族:细胞周期蛋白依赖性蛋白激酶(CDK)和细胞周期蛋白(cyclins)[31]。在本试验中,与LC组相比,Urea组和MC组山羊瘤胃上皮的细胞周期调节因子(cyclinA、cyclinB1、cyclinD1、cyclinE1、CDK1、CDK2、CDK4和CDK6)的基因表达均显著增强,表明这些细胞周期调节因子促进了这两组的细胞周期进程。本研究中,通过将提高日粮精料水平,增加瘤胃SCFA浓度,降低瘤胃pH值。这与之前的报告一致[13,32]。研究结果表明,提高日粮精料水平使瘤胃乳头密度增加,乳头大小增大。这与加速上皮细胞增殖有关[30,33]。瘤胃乳头生长主要受瘤胃SCFA(主要是丁酸)浓度和pH值的调节[34,35]。提高日粮精料水平会升高SCFA的浓度,SCFA被认为是上调瘤胃上皮细胞增殖的因素[36]。McLeod等[37]进一步报道,消化道SCFA是促进消化道上皮增殖的主要因素。
细胞凋亡对细胞数量的稳态起着中重要的作用。在通过细胞有丝分裂促进细胞数量的增加和通过细胞凋亡减少细胞数量,这两者的动态平衡对于维持组织细胞的稳态都起着至关重要的作用,SCFA能促进细胞凋亡,尤其是丁酸的作用更加明显。在本研究中,与LC组相比,Urea组和MC组山羊瘤胃上皮的细胞凋亡调节因子(caspase 3、caspase 8、caspase 9、p53、Bcl-2和Bax)的基因表达均增强。这与Urea组和MC组瘤胃SCFA特别是丁酸浓度显著升高相一致。简言之,提高日粮精料水平可加速瘤胃细胞周期并促进瘤胃细胞凋亡。在此水平上,凋亡细胞产生的营养物质可用于细胞增殖,这可能有助于维持上皮内稳态。
由于作为主要调节因素的瘤胃SCFA浓度在Urea组和MC组间无显著差异,所以两组的上皮细胞增殖相关基因mRNA表达同样无显著差异。
3.4 瘤胃上皮SCFA 转运载体和pHi 调节相关蛋白mRNA 表达
提高日粮精料水平不仅会使瘤胃内的发酵增加,还导致瘤胃对SCFA的吸收增加[38~40]。Sehested等[40]在2000年报道,增加日粮的精料水平,可以在不改变吸收表面积的情况下,增加瘤胃上皮对丁酸的吸收能力。随后Kuzinski[41]与Connor[42]等分别发现,提高日粮中的精料比例,会引起瘤胃上皮中SCFA转运载体MCT1与DRA的mRNA表达增加。这些发现表明,瘤胃上皮吸收功能的变化源自瘤胃上皮细胞内SCFA转运系统的改变。提高日粮中的精料水平可增加瘤胃上皮内SCFA转运载体的基因表达,从而增加瘤胃上皮对SCFA的吸收能力。在本研究中我们发现,同LC组相比,Urea组和MC组瘤胃上皮中SCFA转运载体(MCT1、MCT4、DRA、PAT1和AE2)的表达都显著升高。这些结果与[43]的发现一致,由于SCFA转运载体的mRNA表达增加,这两的组瘤胃上皮对SCFA的吸收能力也可能会相应的升高。由于Urea组和MC组间SCFA浓度相似,所以两组的SCFA转运载体mRNA表达无显著差异。
之前的发现提高日粮精料水平不仅会引起SCFA转运载体的表达升高,还能引起细胞内pHi调节蛋白(NHE1、NHE2、NHE3、vH+ATPase与Na+/K+ATPase)的mRNA表达升高[43]。SCFA转运载体与细胞内pH调节蛋白的表达同时升高,对瘤胃上皮有着重要的生理意义。目前已经证实,SCFA的吸收会导致瘤胃上皮细胞内的H+浓度升高,细胞内的pH值下降,这就需要pH调节蛋白来帮助排出胞内的H+,以维持内环境的稳定,保证细胞的正常生理活动[24]。本研究发现Urea组和MC组瘤胃上皮中SCFA浓度显著高于同LC组,因此这两组中的细胞内pHi调节蛋白(NHE1、NHE2、NHE3、vH+ATPase与Na+/K+ATPase)的mRNA表达均显著升高。由于Urea组中添加尿素替代部分豆粕,造成瘤胃NH3浓度显著高于MC组。先前的研究发现NH3对NHE1、NHE2和NHE3的mRNA表达有抑制作用[44]。因此,以上5种细胞内pHi调节蛋白在Urea组中的mRNA表达显著低于MC组。
3.5 瘤胃上皮尿素转运能力
反刍动物具有特殊的氮节约机制,可以通过尿素循环,将2/3的需将尿素运回瘤胃[1,2,45]。尿素进入瘤胃后被微生物分泌的脲酶分解,产生的NH3被微生物作为原料合成微生物蛋白,为宿主提供营养。尿素跨瘤胃上皮转运是尿素循环中最关键的一步,尿素通过特异性载体UT-B实现跨上皮转运。瘤胃上皮对尿素的转运能力包括UT-B的蛋白活性和mRNA表达量。之前的研究显示,瘤胃SCFA和低pH值对瘤胃上皮UT-B的蛋白活性和mRNA表达量均有显著的上调作用,而瘤胃NH3则起抑制作用[9,46]。Urea组与LC组相比,由于瘤胃SCFA浓度显著增加,pH值显著降低,因此UT-B的蛋白活性和mRNA表达量均显著升高。Urea组中添加尿素替代部分豆粕,造成瘤胃NH3浓度显著高于MC组,同时瘤胃SCFA浓度和pH值相似,所以UT-B的蛋白活性和mRNA表达量受到抑制显著低于MC组。
4 结论
本研究通过在3 0%精料的日粮中添加尿素(1%DM)替代部分豆粕作为非蛋白类氮源。添加尿素对于日粮精料水平提高而发生的瘤胃SCFA浓度升高、pH值降低趋势没有显著改变,但在精料日粮的基础上进一步显著提高瘤胃NH3和BUN浓度。因此添加尿素对于以瘤胃SCFA为主要调节因子的瘤胃上皮生理活动(上皮生长、细胞周期、增殖凋亡相关基因mRNA表达和SCFA转运载体mRNA表达)均无显著影响。但是对于受瘤胃NH3调节的尿素转运、pHi调节相关蛋白mRNA表达则有显著的负调节。我们的研究结果表明,添加尿素对于提高日粮精料水平而发生的瘤胃和瘤胃上皮的一系列技能变化有部分调节作用,为进一步研究尿素作为替代豆粕的非蛋白类氮源对反刍动物生理机能的影响提供了数据和理论依据。
