细菌脲酶分解尿素机制及其调控
2021-10-12熊展博赵圣国王加启
熊展博,赵圣国,王加启
中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室,北京 100193
0 引言
脲酶(EC3.5.1.5)又称尿素胺基水解酶,是一种高活性的非氧化还原金属酶[1],其具有催化尿素分解产生二氧化碳和氨的能力[2]。相较于非催化反应,在脲酶催化作用下的尿素分解速度提高1.0×104~1.0×105倍,脲酶也被认为是目前已知的催化效率最高的水解酶[3]。在畜牧业中,尿素作为脲酶底物,是一种重要的反刍动物非蛋白氮饲料原料,可替代30%左右的蛋白饲料[4]。由于脲酶活性过高,使得尿素快速分解生成二氧化碳和氨,尿素分解速度大于尿素被利用的速度,从而降低了尿素的利用率和微生物蛋白合成效率,而且尿素氮的过度排放,造成环境污染[5]。反刍动物瘤胃内短期产大量氨气提高血液中氨浓度,对动物机体的生产性能造成不利影响[6]。在环境生态方面,土壤中存在大量产脲酶微生物,脲酶高效的催化机制导致pH值的快速上升,导致氨挥发引发了大量土壤氮流失[7]。在人体健康方面,目前已知多种细菌脲酶是人类病原体的毒力因子,包括幽门螺旋杆菌(Helicobacter pylori)、金黄色葡萄球菌(Staphylococcus aureus)、结核分枝杆菌(Mycobacterium tuberculosis)、小肠结肠炎耶尔森菌(Yersinia enterocolitica)和新生隐球菌(Cryptococcus neoformans)[8]。目前,脲酶抑制剂可以有效调控脲酶活性,减少产氨反应。鉴于此,本文将按照细菌脲酶活性中心的结构特征、尿素水解机制和抑制剂调控脲酶活性机制进行阐述,研究细菌脲酶分解尿素的机制为有效调控脲酶活性提供理论基础,探讨化合物抑制脲酶活性的机制,以期对设计和合成新型环境友好脲酶抑制剂提供理论支持和参考。
1 细菌脲酶活性中心的结构特征
1.1 蛋白复合体
不同细菌脲酶结构蛋白的亚基数量与种类不同,但是不同细菌脲酶同一亚基具有同源性。第一个获得三维脲酶结构的产气克雷伯氏菌脲酶(Klebsiella Aerogenesurease,KAU)结构蛋白由UreA、UreB、UreC基因编码的γ、β、α亚基组成,大多数细菌脲酶中,四级结构由三聚体(αβγ)3组成,三聚体有三个相同的活性位点均位于α亚基中,小肠结肠炎耶尔森菌脲酶是由(αβγ)3低聚体组装成四面对称的十二聚合体[(αβγ)3]4空心球体结构,幽门螺旋杆菌脲酶由4 个(αβ)3三聚体组成[(αβγ)3]4复合球体结构[9](图1)。
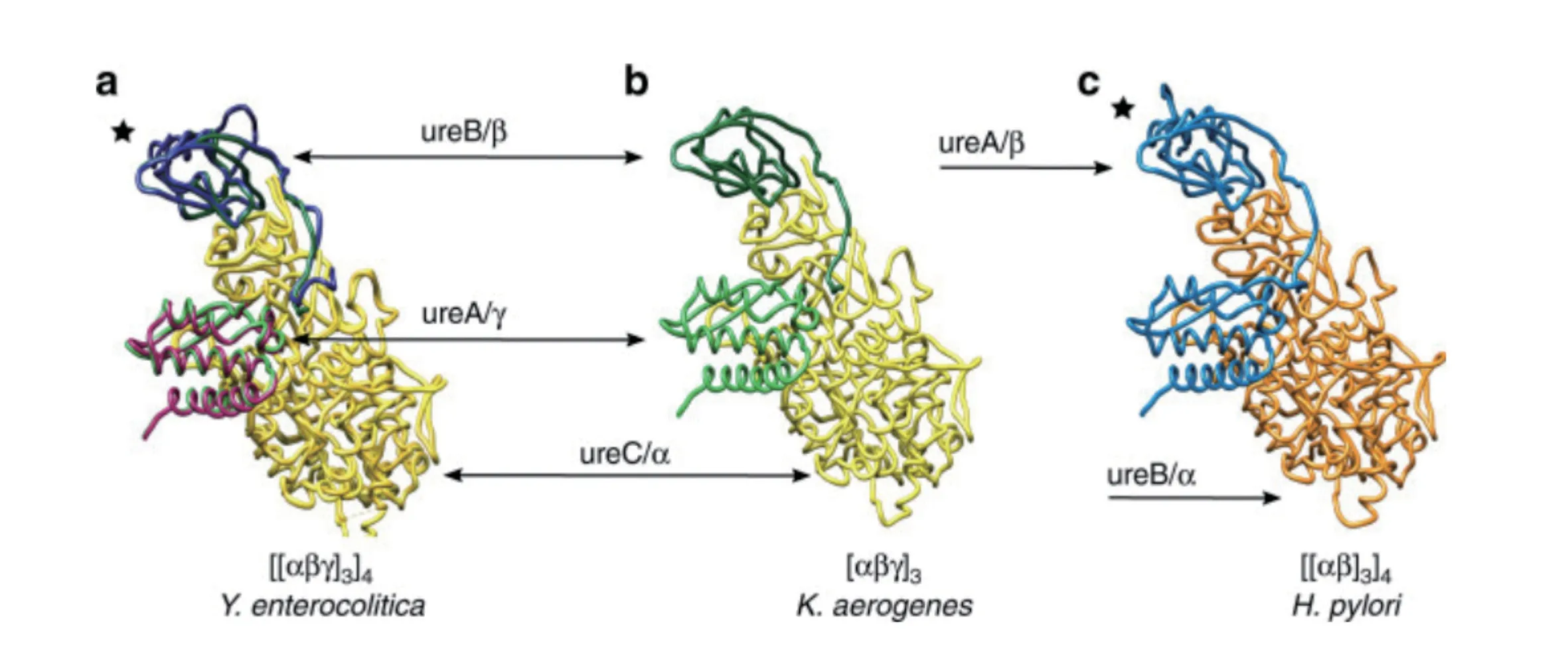
图1 不同细菌脲酶蛋白结构的组装方式[9]
1.2 活性中心结构
随着三维(3D)结构解析技术的日益成熟,高分辨率脲酶蛋白结构被越来越多的发现。目前蛋白数据库(PDB)中含有312 个细菌源脲酶结构,其中来源于产气克雷伯氏菌(Klebsiella aerogenes)(31个),巴氏芽孢杆菌(Sporosarcina pasteurii)(26个),大肠杆菌(Escherichia coli)(34 个),缺陷短波单胞菌(Brevundimonas diminuta)(25 个),枯草芽孢杆菌(Bacillus subtilis)(10 个),绿脓假单胞菌(Pseudomonas aeruginosa)(9 个),幽门螺旋杆菌(Helicobacter pylori)(4 个),炭疽芽孢杆菌(Bacillus anthracis)(2 个),小肠结肠炎耶尔森氏菌(Yersinia enterocolitica)(2 个)等。
脲酶活性位点位于UreC编码的α亚基中,每个活性位点含有两个镍离子(Ni2+),每个金属离子都与2 个组氨酸残基的咪唑N原子结合,并与远端的中性水分子结合[10],存在活性口袋中的水分子不仅与蛋白质主链或者氨基酸侧链形成氢键,而且这些水分子之间相互形成氢键构成一个水合网络。活性位点附近具有一个螺旋-转角-螺旋基序(Helix-Turn-Helix),被称作Flap区域(图2),其功能是控制底物进入催化部位和释放产物[3]。Flap区域上组氨酸的质子化状态决定活性口袋的开放构象和闭合构象,并且受pH值的影响。例如在pH值6.5~7.0范围内,巴氏芽孢杆菌的αHis323以50%的质子化和50%的中性形式存在;pH值<6.5时,脲酶晶体结构的镍离子占有率比较低,Flap区域的电子密度弱,过酸条件破坏了活性中心的蛋白支架;而在pH值>7.5条件下脲酶蛋白结晶困难。通过闭合活动瓣,使脲酶蛋白Flap区域上组氨酸残基接近活性位点,达到稳定活性口袋中尿素末端氨基的目的[11](图3)。

图2 脲酶活性中心结构[10]

图3 巴氏芽胞杆菌脲酶活性中心Flap 区域的闭合(宝蓝色)和开放(透明蓝色)结构图[11]
2 尿素水解机制
尿素上的羰基氧与脲酶活性中心的Ni(1)螯合,然后在覆盖活性中心的Flap区域的构象发生改变,脲酶活性口袋形成闭合构象,尿素上的氨基氮与Ni(2)进行结合,使尿素的中心碳原子缺乏电子。镍桥上的氢氧化物对尿素中心缺电碳原子更容易进行亲核攻击,一个质子从金属桥联的C-OH基团转移到氨基末端,产生的C-NH3+键断裂后产生氨分子。Flap区域活动瓣打开后会释放出氨和氨基甲酸盐,后者会自发水解成一分子氨和碳酸氢盐分子[2](图4)。

图4 脲酶水解尿素的模式图[2]
3 抑制剂调控脲酶活性机制
脲酶活性的调控依赖于抑制剂化合物,目前,常用的脲酶抑制剂为乙酰氧肟酸。
乙酰氧肟酸(AHA)(分子式为C2H5NO2)属于异羟肟酸化合物,具有良好的金属螯合能力,乙酰氧肟酸可以与脲酶活性中心的镍离子进行螯合,使其失去催化尿素分解的活性。在畜牧养殖业中广泛应用于脲酶抑制剂领域,通过降低反刍动物生产中氮排出,提高动物的尿素等非蛋白氮利用效率。此外,AHA也是重要的人体药物。
关于乙酰氧肟酸在脲酶催化位点的作用机制已经被充分证实,根据Zerner等[12]的研究表明,在正常pH值下天然刀豆脲酶的两个镍离子分别与1 个水分子和1 个氢氧根离子配位,活性中心是由与αAsp360连接的羧基[13]、αCys319硫醇的巯基[14]和组氨酸上的未知基团组成[15]。在此模型下,AHA的共振形式与镍离子双齿方式配位,该形式下的AHA-Ni复合物由活性部位附近阴离子(未知的碱基)平衡电位。与镍离子配位的氢氧根离子对AHA羰基氧的亲核攻击可能导致更稳定复合物的形成,进而导致脲酶失活。该机制被Morrison和Walsh归类为经典的快速结合竞争抑制机制[16,17]。
Stemmler 等[18]首次将乙酰氧肟酸与脲酶活性中心镍离子结晶,并确定该复合物的X射线结构,发现乙酰氧肟酸通过羟肟酸盐和羰基氧以双齿形式与镍离子结合,并且两个镍离子形成二聚肟桥。虽然已经有大量二聚肟络合物相关研究[19],但是异羟肟酸氧与过渡金属的桥联双齿形式是首次被观察到[20]。广泛认可的机制是异羟肟酸酯的羰基氧与活性位点一个镍离子结合,随后桥联镍离子的羟基阴离子对异羟肟酸的羰基碳的亲核攻击,出现二聚肟桥结构,从而形成更稳定的脲酶-抑制剂复合物,这是一种类似底物结合的过渡态四面体,阻止活性中心与底物结合达到抑制效果。
Matthew 通过对位于产气克雷伯氏菌脲酶(Klebsiella Aerogenes Urease,KAU)活性部位的Flap区域上半胱氨酸319位点进行定点突变,发现该氨基酸残基在催化中不起重要作用,但是对脲酶稳定性有影响。突变获得多种变异体,发现变异体Cys319A具有接近野生型的活性和更稳定的结构。Cys319A与AHA结合的晶体结构表明:AHA与活性中心的两个镍离子结合,AHA的羰基氧与Ni(1)相互作用并且与His219的氮原子形成氢键,另一个氧原子桥联两个镍离子。AHA取代活性位点中三个水分子(Wat-500、Wat-501和Wat-502)的空间位置,AHA的氮原子与Ala363主链羰基氧形成了额外的氢键。与AHA结合的Cys319A脲酶和天然Cys319A脲酶相比没有明显构象变化(图5)。AHA的甲基与His320的氮原子相互作用可能迫使Flap区域活性瓣远离活性位点,成为无序状态[21]。
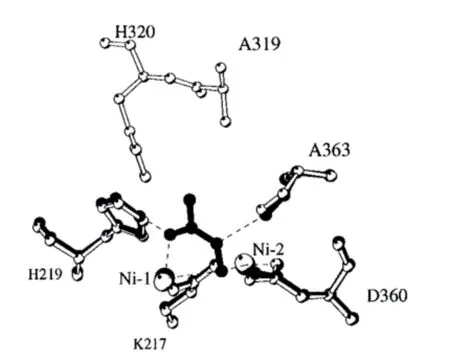
图5 与AHA 结合的Cys319A 脲酶和天然Cys319A 脲酶结构比较[21]
4 展望
脲酶分解尿素机制涉及到脲酶活性的关键位点和氨基酸残基,通过对关键位点结构分析,人工合成具有特异性的抑制剂化合物。目前研究者通过分子对接和化学修饰的方法获得大量具有脲酶抑制作用的化合物,但用于动物生产和人类医药的化合物相对稀少。天然植物源的提取物具有天然安全、无毒害的特点,开发天然植物提取物作为脲酶抑制剂将是一个新思路。
