SIRT5通过调控G6PD促进结肠癌细胞的糖代谢及增殖*
2021-10-12刘迪张秀梅
刘迪 张秀梅
结肠癌是常见的易发于结直肠部位的消化道恶性肿瘤。近年来,中国结肠癌的发病率和病死率均呈上升趋势[1],严重威胁着人们的生命健康。异常的代谢模式是恶性肿瘤的一个重要特征,有氧糖酵解已被确认为肿瘤细胞的主要代谢特征[2],其为肿瘤细胞的生长提供原料和能量。SIRT5 是Sirtuin 家族的一员,主要定位于线粒体基质中,具有不同的去乙酰化酶活性、去琥珀酰化、去戊二酰基化和去丙二酰基化的催化活性,可诱导糖酵解和葡萄糖有氧氧化增加[3]。戊糖磷酸途径(pentose phosphate pathway,PPP)是糖酵解支路,因此该途径流量和速度的改变直接影响糖酵解。葡萄糖-6-磷酸脱氢酶(G6PD)存在于胞质中,是PPP 的限速酶,其代谢产物NADPH 和5-磷酸核糖是维持肿瘤细胞生长增殖所必需的物质。目前尚鲜见关于SIRT5 对结肠癌细胞糖代谢、生长增殖的报道及其中可能的分子机制。本研究旨在检测SIRT5 与G6-PD 在结肠癌临床样本中的表达水平,探讨SIRT5 对结肠癌细胞糖代谢、增殖的影响以及该机制是否通过调控G6PD 实现,从而为临床治疗结肠癌提供新的实验依据。
1 材料与方法
1.1 材料及主要试剂
HCT116 和HT29 人结肠癌细胞系由锦州医科大学基础医学院生物化学与分子生物学教研室提供。结肠癌组织切片(包括癌组织和癌旁组织)由中国医科大学附属第一医院病理科提供。SIRT5 干扰RNA 购自上海吉玛公司,SIRT5 质粒购自武汉淼灵生物科技有限公司;葡萄糖氧化酶试剂盒购自北京索莱宝科技有限公司;乳酸测试盒购自南京建成生物公司;PCR 引物购自北京鼎国昌盛生物公司;兔抗人SIRT5、G6PD 多克隆抗体购自美国ABclonal 公司。
1.2 方法
1.2.1 细胞培养、分组及转染 HCT116 和HT29 细胞置于37℃、5%CO2培养箱中进行培养。将细胞接种于6 孔板中,待细胞密度达到70%~90%且状态良好时进行转染,SIRT5 干扰实验分为si-SIRT5-1、si-SIRT5-2、si-SIRT5-3 和阴性对照(si-NC)组,其序列分别为si-SIRT5-1:5′-CCAGCUACGAACAGAUUC ATTUGAAUCUGUUCGUAGCUGGTT-3′,si-SIRT5-2:5′-GUCCAGCUUUAUCAGGAAATTUUUCCUG AUAAAGCUGGACTT-3′,si-SIRT5-3:5′-GGAGAUC CAUGGUAGCUUATTUAAGCUACCAUGGAUCU CCTT-3′,si-NC:5′-UUCUCCGAACGUGUCACGUT TACGUGACACGUUCGGAGAATT-3′;SIRT5 过 表达实验分为HA 空载质粒转染(Control)组、HASIRT5 质粒转染组。回复实验分si-SIRT5 单独转染组、si-SIRT5+G6PD 质粒共转组、si-NC+Flag 空载质粒共转组。转染6 h 后更换为含10%胎牛血清和双抗的RPMI 1640 完全培养液。
1.2.2 Western blot 法检测SIRT5、G6PD 蛋白的表达水平 待HCT116、HT29 细胞均生长至可消化传代时,各取适量细胞悬液收集细胞测SIRT5 蛋白,SIRT5 过表达组转染48 h、干扰组转染36 h 后收集细胞测G6PD 蛋白。在收集的细胞中加入细胞裂解液和蛋白酶抑制剂提取总蛋白。采用BCA 蛋白浓度测定试剂盒检测蛋白浓度,制备样品。将蛋白经过SDS-PAGE 电泳分离,90 V、90 min 转膜转至PVDF膜,用含5%脱脂奶粉的TBST 室温封闭2 h 后,将膜与SIRT5、G6PD 和Actin 抗体结合4℃孵育过夜。次日PVDF 膜经TBST 洗涤后用二抗室温孵育2 h,TBST 洗涤后ECL 法发光成像。
1.2.3 培养液中葡萄糖、乳酸浓度的测定 SIRT5 过表达组转染42 h、SIRT5 干扰组转染30 h 后收集并更换一次完全培养液。换液后6 h 再分别收集培养液,按照葡萄糖氧化酶试剂盒和乳酸测试盒说明书检测培养液中葡萄糖与乳酸的浓度。
1.2.4 CCK-8 实验检测细胞活力 SIRT5 过表达组及干扰组细胞均转染24 h 后用胰酶消化,每组按4×103个/孔细胞密度接种于96 孔板,并设3 个复孔。分别于接种细胞后0、1、2、3 天内的恒定时间点在每孔加入10 μL CCK-8 溶液,5% CO2、37℃细胞培养箱中孵育2 h,用酶标仪检测各孔在450 nm 处的吸光值。
1.2.5 克隆形成实验检测细胞的增殖能力 胰酶消化转染24 h 后,对上述分组细胞进行收集,各组分别取400 个/孔细胞接种到6 孔板中,于培养箱培养10~14 天,直到大多数单个细胞集落含有50 个细胞以上时停止培养。4% 多聚甲醛固定细胞后加入0.1%结晶紫溶液染色,细胞克隆计数并计算克隆形成率(克隆形成率=克隆数/接种细胞数×100%)。
1.2.6 RT-PCR 检测转染后G6PD 的mRNA 表达水平 SIRT5 过表达组转染48 h、SIRT5 干扰组转染36 h 后用Trizol 法提取细胞总RNA,按ClonExpress Ultra One Step Cloning Kit 说明书配制反应体系进行One Step RT-PCR 反应。PCR 扩增反应条件为50℃30 min,95℃ 3 min,(95℃ 30 s、60℃ 30 s、72℃ 30 s)×30 个循环,72℃ 5 min。扩增后的反应样品即进行1%琼脂糖凝胶电泳,电压为80 V,完成后置凝胶于凝胶成像系统中显影。G6PD 序列:F5’-CTCAGCCCCCGG AAACGG-3’,R5’-GATGAAGGTGTTTTCGGGCAG-3’。
1.2.7 免疫组织化学法检测SIRT5、G6PD 在结肠癌组织中的表达情况 所有结肠癌组织切片(包括癌组织和癌旁组织)于60℃烘箱烤片2 h,将切片常规脱蜡、水化、抗原修复,分别滴加一抗和二抗,DAB 显色,再常规脱水透明、树脂封片晾干、镜下采集图像。每张切片各选5 个视野,根据染色程度和染色阳性率评分之积进行评分,总分0 分为阴性(-),1~4 分为弱阳性(+),5~8 分为阳性(++),9~12 分为强阳性(+++)[4]。
1.3 统计学分析
采用SPSS 17.0 软件和GraphPad 8.0 进行统计学分析。计量资料(数据均重复3 次以上)以±s表示,组间差异比较采用t检验。以P<0.05 为差异具有统计 学意义。
2 结果
2.1 SIRT5 在HCT116、HT29 细胞中的表达
Western blot 结果显示,SIRT5 蛋白在HT29 细胞中的表达水平较低,在HCT116 细胞中的表达水平较高(图1A)。在后续实验,本研究将对HCT116 细胞进行SIRT5 干扰处理、对HT29 细胞进行SIRT5过表达处理,以检测SIRT5 对结肠癌细胞糖代谢、增殖的影响。与此同时,本研究通过Western blot 在HCT116 细胞中验证了SIRT5 不同干扰序列的干扰效果。结果表明,干扰效果最显著的是si-SIRT5-3 转染组(图1B),故接下来所有细胞实验干扰组的处理均用筛选出的si-SIRT5-3 进行。

图1 SIRT5 在结肠癌细胞中的表达
2.2 SIRT5 促进结肠癌细胞葡萄糖的消耗和乳酸的生成
对培养液中葡萄糖浓度的检测结果显示,HCT116 细胞沉默SIRT5 后培养液中葡萄糖的含量明显增加(P=0.005,图2A),HT29 细胞过表达SIRT5 后培养液中葡萄糖的含量明显减少(P=0.004,图2B),上述结果显示SIRT5 促进葡萄糖的消耗。而对培养液中乳酸的浓度进行检测后发现,HCT116 细胞沉默SIRT5 后培养液中乳酸的含量则显著降低(P=0.005,图2C),HT29 细胞过表达SIRT5 后培养液中乳酸的浓度显著增加(P=0.004)(图2D),上述结果提示SIRT5 促进乳酸的生成。

图2 调控SIRT5 对结肠癌细胞糖代谢的影响
2.3 SIRT5 促进结肠癌细胞的增殖
CCK-8 实验显示,HCT116 细胞si-SIRT5 组的OD 值与si-NC 组及Untreated(空白)组相比均明显降低(P=0.002,P=0.003)(图3A);HT29 细胞SIRT5 质粒组的OD 值与Control 组及Untreated 组相比均明显增高(P=0.024,P=0.040)(图3B),说明SIRT5 可增强结肠癌细胞的活性。HCT116 细胞干扰SIRT5 后,si-SIRT5 组的细胞克隆数及克隆形成率明显少/低于si-NC 组及Untreated 组(P<0.001)(图3C,3D);HT-29 细胞过表达SIRT5 后,SIRT5 质粒组的细胞克隆数及克隆形成率明显多/高于Control 组及Untreated组(P<0.001)(图3E,3F),这表明SIRT5 提高了结肠癌细胞的克隆形成能力。
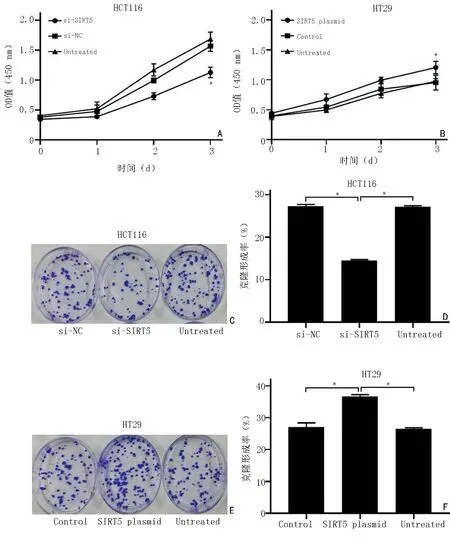
图3 调控SIRT5 对结肠癌细胞增殖的影响
2.4 SIRT5 正向调控结肠癌细胞内G6PD 的表达
以上研究结果证实,SIRT5 可促进结肠癌细胞葡萄糖的消耗、乳酸的生成,并可提高结肠癌细胞的活力和增殖能力。本实验组对其调控机制,以及是否通过调控戊糖磷酸途径的限速酶G6PD 来实现上述功能进行进一步研究。
RT-PCR 结果显示,HCT116 细胞沉默SIRT5 后G6PD mRNA 的表达水平明显降低(图4A);HT29 细胞过表达SIRT5 后,G6PD mRNA 的表达水平明显升高(图4B)。同样,HCT116 细胞沉默SIRT5 后的Western blot 结果显示G6PD 蛋白的表达水平显著降低(图4C);HT29 细胞过表达SIRT5 后,G6PD 蛋白的表达水平显著升高(图4D)。

图4 SIRT5 调控G6PD 表达的情况
2.5 G6PD 参与SIRT5 介导的结肠癌细胞的糖代谢及增殖过程
本研究在HCT116 细胞中进行了干扰回复实验以验证G6PD 是否参与SIRT5 介导的结肠癌细胞的糖代谢及增殖过程:在该细胞中单独转染si-SIRT5、共转染si-SIRT5 和G6PD 质粒、共转染si-NC 和Flag 空载质粒。结果显示si-SIRT5+G6PD 质粒共转组与si-SIRT5 组相比,培养液中葡萄糖浓度降低(P=0.012)、乳酸浓度升高(P=0.041)、细胞活性增强(P=0.003)、细胞克隆数增多及克隆形成率增高(P<0.001),而si-SIRT5+G6PD 质粒共转组与si-NC+Control 共转组相比,以上各项实验结果均无显著性差异(P>0.05)(图5)。这说明G6PD 在SIRT5 调控的结肠癌细胞的糖代谢、增殖过程中发挥了一定作用。
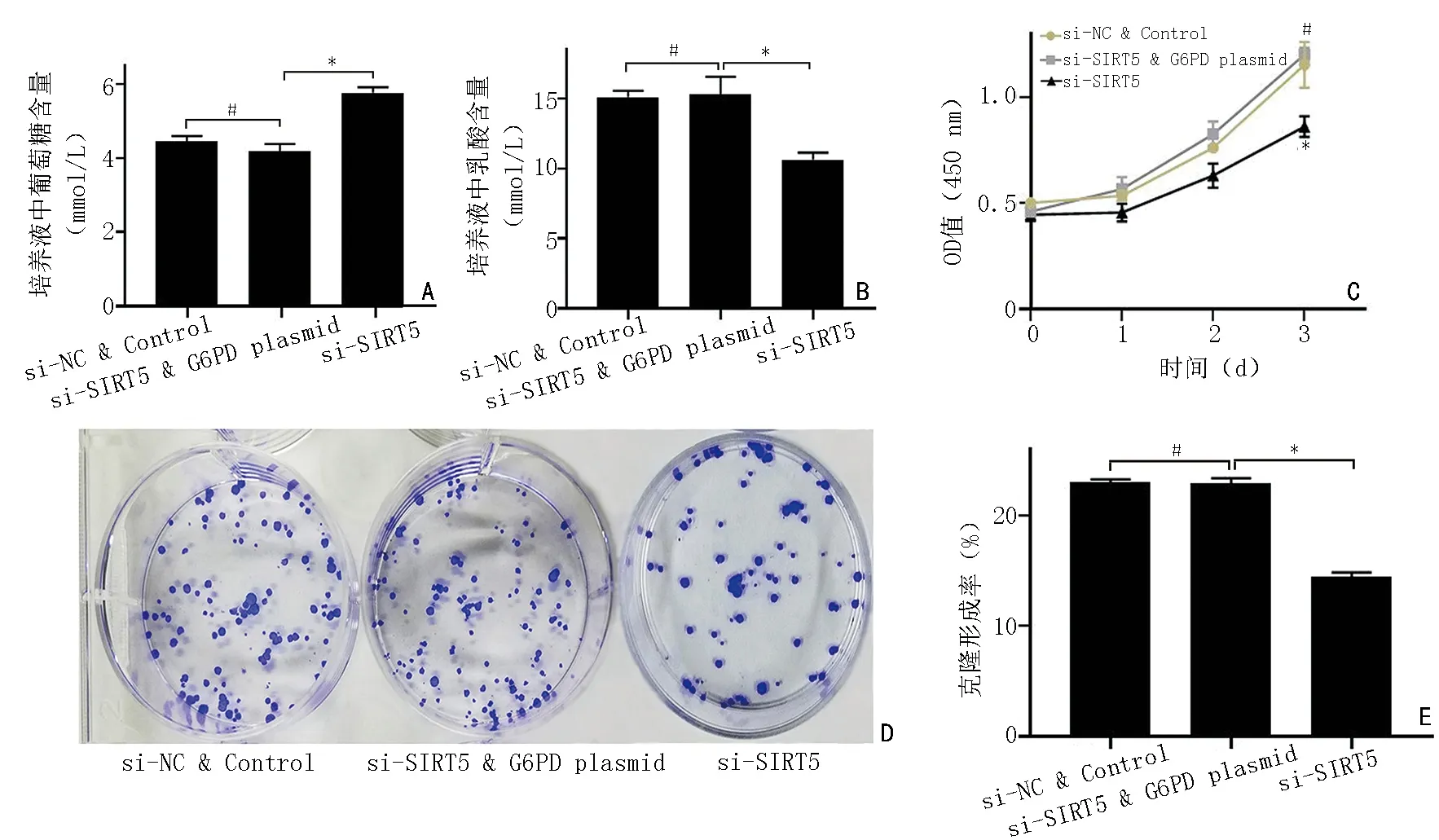
图5 HCT116 细胞的干扰回复实验
2.6 SIRT5、G6PD 在结肠癌组织及癌旁组织的表达情况
为进一步验证SIRT5 和G6PD 在结肠癌临床样本中表达的相关性,本研究应用免疫组织化学法对结肠癌临床样本进行了检测,结果表明SIRT5 和G6PD在癌旁组织中表达较低,而在癌组织中的表达明显增高(图6)。

图6 SIRT5、G6PD 在结肠癌组织中的表达(IHC×200)
3 讨论
有研究表明,肿瘤细胞为满足其快速增殖的需要,需消耗大量的葡萄糖,即使在氧气充足的条件下,也主要依靠糖酵解供能,这种代谢特征被称为Warburg效应或有氧糖酵解[5]。糖酵解是供应肿瘤细胞能量和生产代谢终产物的关键[6],肿瘤细胞以此维持其生存,抑制糖酵解具有抑制肿瘤细胞增殖和杀伤肿瘤细胞的作用,这有望成为治疗肿瘤的靶点。
现有证据表明,SIRT5 多作为癌基因发挥作用,在促进肿瘤发生发展的同时对患者的预后不利[7-9],它可以通过调控3-磷酸甘油醛脱氢酶(GAPDH)、乳酸脱氢酶B(LDHB)等在糖酵解过程中发挥作用[10-11]。为验证SIRT5 在结肠癌中作为何种角色及如何影响结肠癌细胞的糖代谢和增殖能力,本研究首先从细胞水平探究了SIRT5 在结肠癌细胞系HCT116、HT29中的表达情况,随后对SIRT5 表达水平较高的HCT116 细胞进行了SIRT5 干扰处理,发现细胞对葡萄糖的消耗和乳酸的生成能力也就是糖代谢能力降低(P<0.05)、细胞的活力和克隆形成能力也明显降低(P<0.05),即细胞的增殖能力减弱。同时对SIRT5 表达水平较低的HT29 细胞进行了SIRT5 过表达处理,发现细胞的糖代谢能力增强(P<0.05)、细胞的增殖能力提高(P<0.05)。以上结果证明SIRT5 可促进结肠癌细胞的糖代谢和增殖。
肿瘤细胞在糖酵解过程中某些酶的活性会增高,如G6PD,已有研究证实G6PD 在多种癌症中高表达[12-13],密切影响肿瘤细胞的发生发展,并与患者化疗预后不良相关。SIRT5 与G6PD 在结肠癌中是否相关以及SIRT5 对结肠癌细胞糖代谢、增殖的机制与G6PD 有无关系。针对以上问题,本研究从蛋白和mRNA 水平分别验证了两者之间的相关性。结果显示,在下调SIRT5 的表达后HCT116 细胞内G6PD蛋白和mRNA 的表达水平明显降低;在过表达SIRT5后HT29 细胞内G6PD 蛋白和mRNA 的表达水平明显提高。由此可见,SIRT5 对G6PD 有明显的正向调控作用。为证实SIRT5 对结肠癌细胞的糖代谢、增殖的调控作用是通过G6PD 发挥的,本研究在HCT116细胞中共转了si-SIRT5 和G6PD 质粒。结果显示,与si-SIRT5 单独转染组相比,si-SIRT5+G6PD 质粒共转组细胞的糖代谢、增殖能力都得以恢复(P<0.001)。由此推断G6PD 参与SIRT5 调控结肠癌细胞葡萄糖的消耗、乳酸的生成和增殖。SIRT5、G6PD 的免疫组织化学结果显示其在结肠癌组织中均为高表达,这也与部分研究结果一致[14-15]。
综上所述,SIRT5 对G6PD 的表达呈正调控,且SIRT5 通过调控G6PD 促进结肠癌细胞的糖代谢、增殖,具体机制还需进一步研究。
致谢:感谢中国医科大学附属第一医院病理科提供实验组织切片。
