ZnOHF纳米棒用于电催化二氧化碳还原制一氧化碳
2021-10-12钟达忠郝根彦李晋平
王 栋 ,钟达忠 ,郝根彦 ,李晋平 ,赵 强,*
(1.太原理工大学 化学化工学院,山西 太原 030024;2.气体能源高效清洁利用山西省重点实验室,山西 太原 030024)
近年来,二氧化碳(CO2)等温室气体的大量排放导致的环境问题日趋严重[1, 2]。通过适当的方法将其转化为化工原料,不仅能缓解或消除气候变化引起的生态危机,而且能创造一定的经济价值[3, 4]。电催化转化的方式由于其设备简单、条件温和及反应可控等优点受到了研究者们的广泛关注,特别是以可再生能源为驱动,通过电催化还原的方式将CO2转化为具有较高工业附加值的燃料或化学品 是 当前的研究热点之一[3, 5, 6]。
一氧化碳(CO)是化学工业中费托合成的重要原料之一,其在冶金工业方面也发挥着极其关键的作用[7 − 9]。因此,将 CO2电催化还原为 CO 具有较大的应用潜力。然而电催化CO2还原目前也存在很多瓶颈,首先由于涉及多电子转移过程,反应中间体种类复杂,导致其反应产物众多,选择性较低,为后续分离纯化带来了较大困难[10, 11]。其次由于二氧化碳还原在负电势下进行,电极与电解液接触时会发生剧烈的析氢反应[12, 13]。最后,二氧化碳缓慢的动力学以及反应过程中缓慢的传质过程导致电流密度较小,反应速率较低[14]。开发高效的催化剂是提升产物选择性以及抑制析氢反应的关键,尽管贵金属催化剂如Au、Ag、Pd等被报道具有良好的CO选择性,然而其稀缺性决定了其无法满足未来大规模工业生产的需求[15 − 17]。
金属Zn是可以将CO2有效还原为CO的一种廉价金属,被认为是未来替代贵金属材料的理想选择[18 − 20]。但是 Zn 催化剂的选择性依然较低,需要进一步提高。据文献报道,卤素原子的存在可以有效抑制析氢反应的发生,因此,引入卤素原子是提升产物选择性的有效途径[21 − 23]。此外,传统H型电解槽由于受限于CO2在水中较低的溶解度及较慢的传质速率很难获得大的电流密度,因此,越来越多的研究者开始使用流动型电解槽(Flow-Cell)作为反应器[24, 25]。Flow-Cell工作电极为气体扩散电极,工作界面为气液固三相界面,这保证了即使在较大的电流密度下也有充足的CO2与电极接触,同时还可以降低内阻减少电势损耗[26]。本文通过简单水热法合成了ZnOHF纳米棒并将其首次应用于电催化CO2RR,同时使用Flow-Cell进行性能测试。纳米棒较大的比表面积以及F-的引入使其具有良好的CO选择性,Flow-Cell的使用有效改善了传质过程提升了反应速率,获得了较大的电流密度。在−1.28 V(vs.RHE)电势下,R2-ZnOHF纳米棒获得了76.4 %的CO法拉第效率,CO 分电流密度为 57.53 mA/cm2。
1 实验部分
1.1 试剂
无水醋酸锌((CH3COO)2Zn,分析纯,国药集团)、氢氧化钾(KOH,分析纯,阿拉丁)、尿素(CH4N2O,分析纯,国药集团)、氟化铵(NH4F,≥ 99.99 %,阿拉丁)、碳酸氢钾(KHCO3,≥ 99.5 %,国药集团)、异丙醇(C3H8O,分析纯,国药集团)、Nafion溶液(5 %,阿尔法)。实验中所用到的超纯水均由美国Millipore Elix公司生产的超纯水仪制取,其余试剂均未进行进一步处理。
1.2 合成Zn4CO3(OH)6
称取 1 g 无水醋酸锌和 0.05 mol尿素溶于 40 mL超纯水中,搅拌90 min。将上述混合物转移至100 mL聚四氟乙烯内衬不锈钢外壳的水热反应釜内,放置于100 ℃烘箱内反应4 h。反应完毕后,自然降温至室温并真空抽滤,抽滤后的样品放入60 ℃烘箱干燥 12 h。
1.3 合成不同尺寸的ZnOHF纳米棒
称取总摩尔量为0.05 mol的尿素与氟化铵混合物,氟化铵的摩尔分数分别为 15 %、20 %、25 %。再称取1 g无水醋酸锌,并一起溶于40 mL超纯水中,搅拌90 min。将上述三种混合物分别转移至100 mL聚四氟乙烯内衬不锈钢外壳的水热反应釜内,放置于100 ℃烘箱内反应4 h。反应完毕后,自然降温至室温并真空抽滤,放入60 ℃烘箱干燥12 h。将制备的样品分别标记为R1-ZnOHF、R2-ZnOHF和R3-ZnOHF。
1.4 制备工作电极
本文阴极工作电极使用含表面疏水层的碳纸为基底,使用前用吹风机吹净表面灰尘,并将其裁剪为 30 mm× 30 mm 的正方形。将 27 mg 催化剂超声分散在 270 μL 5 % Nafion 溶液和 830 μL 异丙醇的混合液中,使用以氩气为气源的气动喷笔将均匀分散的混合液喷涂于裁剪后的碳纸疏水面一侧,室温干燥12 h以备下一步使用。按此比例得到的工作电极催化剂负载量为3 mg/cm2。
1.5 表征手段
X 射线衍射仪(XRD, Bruker D8 Discover)、场发射扫描电镜(SEM, SU8010 Japan)、场发射透射电镜(TEM, JEM-2100 Japan)、X 射线光电子能谱仪(XPS, VG Scientific UK)、红外吸收光谱仪(FT-IR,INVENIO)、氮气吸附仪 (BET, TriStarⅡ 3020)。
1.6 电催化CO2RR性能测试
本论文采用定制的三电极体系流动型电解槽为反应器。反应器由CO2流动室和阴、阳极电解液流动室三个流动室组合而成,以Nafion-115质子交换膜分隔阴阳两极,参比电极位于阴极电解液流动室一侧,工作电极喷涂有催化剂的一侧面向参比电极放置,利用铜导电胶带连接电极与普林斯顿电化学工作站。实验中使用的工作电极均为疏水面喷涂有催化剂的碳纸,汞-氧化汞电极(Hg/HgO)和泡沫镍分别作为参比电极和对电极,电解液使用1 mol/L KOH溶液。反应器出口与岛津GC-2014C气相色谱仪相连以对气体产物样品进行实时分析,色谱使用前利用标准气体进行标定。
2 结果与讨论
2.1 催化剂的制备与表征
催化剂制备过程见图1(a),通过调控原料配比,利用简单水热合成法得到了不同形貌的样品。样品 XRD 表征结果与标准卡数据(JCPDS No.11-0287,图中标为红色;JCPDS No.32-1469,图中标记为黑色)相一致,说明已成功合成了Zn4CO3(OH)6和ZnOHF(图1(b))。R1-ZnOHF的XRD衍射图中可以观察到少量属于Zn4CO3(OH)6的衍射峰(图1(b)中用“♠”符号标出),说明合成的R1-ZnOHF样品中可能含有Zn4CO3(OH)6杂相。当氟化铵物质的量比为20 %时,则样品的XRD衍射峰全部属于ZnOHF。使用扫描电镜分析样品的表面形貌,如图2(a)−(d)所示,Zn4CO3(OH)6由纳米片堆叠而成,ZnOHF微观上则为纳米棒结构,且随着氟化铵用量增大而逐渐变粗,R1-ZnOHF的SEM图中仍然可以观察到少量的片状结构,这与XRD表征结果一致。
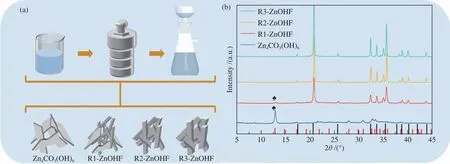
图1 (a):样品的制备流程图;(b):Zn4CO3(OH)6、R1-ZnOHF、R2-ZnOHF 及 R3-ZnOHF 的 XRD 衍射谱图Figure 1 (a): Sample preparation flow chart; (b): XRD patterns of Zn4CO3(OH)6, R1-ZnOHF, R2-ZnOHF and R3-ZnOHF

图2 (a)Zn4CO3(OH)6、(b)R1-ZnOHF、(c)R2-ZnOHF 及(d)R3-ZnOHF 的扫描电镜照片Figure 2 SEM of (a) Zn4CO3(OH)6, (b) R1-ZnOHF, (c) R2-ZnOHF and (d) R3-ZnOHF
为进一步研究合成样品组成与原料配比的关系,对样品进行红外光谱分析(图3(a))。ZnOHF特征峰的位置与文献报道的数据相吻合,469、525 cm−1处的特征峰分别属于 Zn−O 和 Zn−F 振动峰,1023 cm−1处的特征峰则属于 O−O振动峰,2300 cm−1左右的波动来自于空气中 CO2的干扰[27],其余特征峰则属于O−H的振动峰或弯曲振动峰[28]。通过分析样品红外特征峰的变化趋势,结合XRD与SEM表征结果,作者认为R1-ZnOHF中存在少量Zn4CO3(OH)6,R2-ZnOHF 及R3-ZnOHF 则为纯相。综上笔者推测催化剂的合成机理如下[29, 30]。
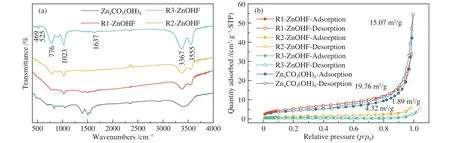
图3 Zn4CO3(OH)6、R1-ZnOHF、R2-ZnOHF 及 R3-ZnOHF 的(a)红外谱图和(b)N2吸附-脱附曲线Figure 3 (a) FT-IR spectra and (b) N2 adsorption/desorption isotherms of Zn4CO3(OH)6, R1-ZnOHF, R2-ZnOHF and R3-ZnOHF
Zn4CO3(OH)6的合成:

R1-ZnOHF、R2-ZnOHF及R3-ZnOHF的合成:

Zn4CO3(OH)6的合成过程中,尿素加热后分解生成二氧化碳和氨水,氨水进一步分解获得OH−,再与溶液中的Zn2+结合生成Zn4CO3(OH)6。而ZnOHF合成时,充分搅拌使得Zn2+与F−结合生成稳定中间体ZnF+,尿素受热分解后获得的OH−则直接与ZnF+结合生成ZnOHF。当F−含量较低时,溶液中未结合的Zn2+则会反应生成Zn4CO3(OH)6,这也是R1-ZnOHF中存在少量Zn4CO3(OH)6的原因。图3(b)为催化剂氮气吸附-脱附曲线,Zn4CO3(OH)6的比表面积为15.07 m2/g,R1-ZnOHF纳米棒直径最小,比表面积最大为19.76 m2/g。随着纳米棒直径变大,比表面积逐渐减小,R2-ZnOHF及R3-ZnOHF的比表面积分别为4.32、1.89 m2/g。此外,吸附-脱附曲线还表明,对比NH4F加入前后材料大孔减少,微孔增多,推测这可能是由于NH4F加入后材料形貌由500 nm以上的纳米片转变为直径100 nm左右的纳米棒,尺寸较大的纳米片堆叠使得大孔较多而直径较小的纳米棒堆叠更容易产生微孔,因此,微孔数量略有增加。
利用XPS分析R1-ZnOHF、R2-ZnOHF及R3-ZnOHF的表面元素组成(图4)。由XPS全谱可以看出,位于~1022、~531及~685 eV结合能处的三个特征峰清楚地表明,Zn、O及F三种元素的存在(图4(a)−(c))。图中的表格表明了各样品表面各原子比例,R1-ZnOHF 中O∶F 比为1.7∶1,而R2-ZnOHF与R3-ZnOHF的O∶F比则约等于1∶1。催化剂表面卤素原子的存在有利于抑制析氢反应的发生,使用柱状图更直观的比较各样品中F原子的含量,相较R1-ZnOHF,R2-ZnOHF中F原子含量增加明显,而R3-ZnOHF中F原子含量则与R2-ZnOHF接近(图4(d))。
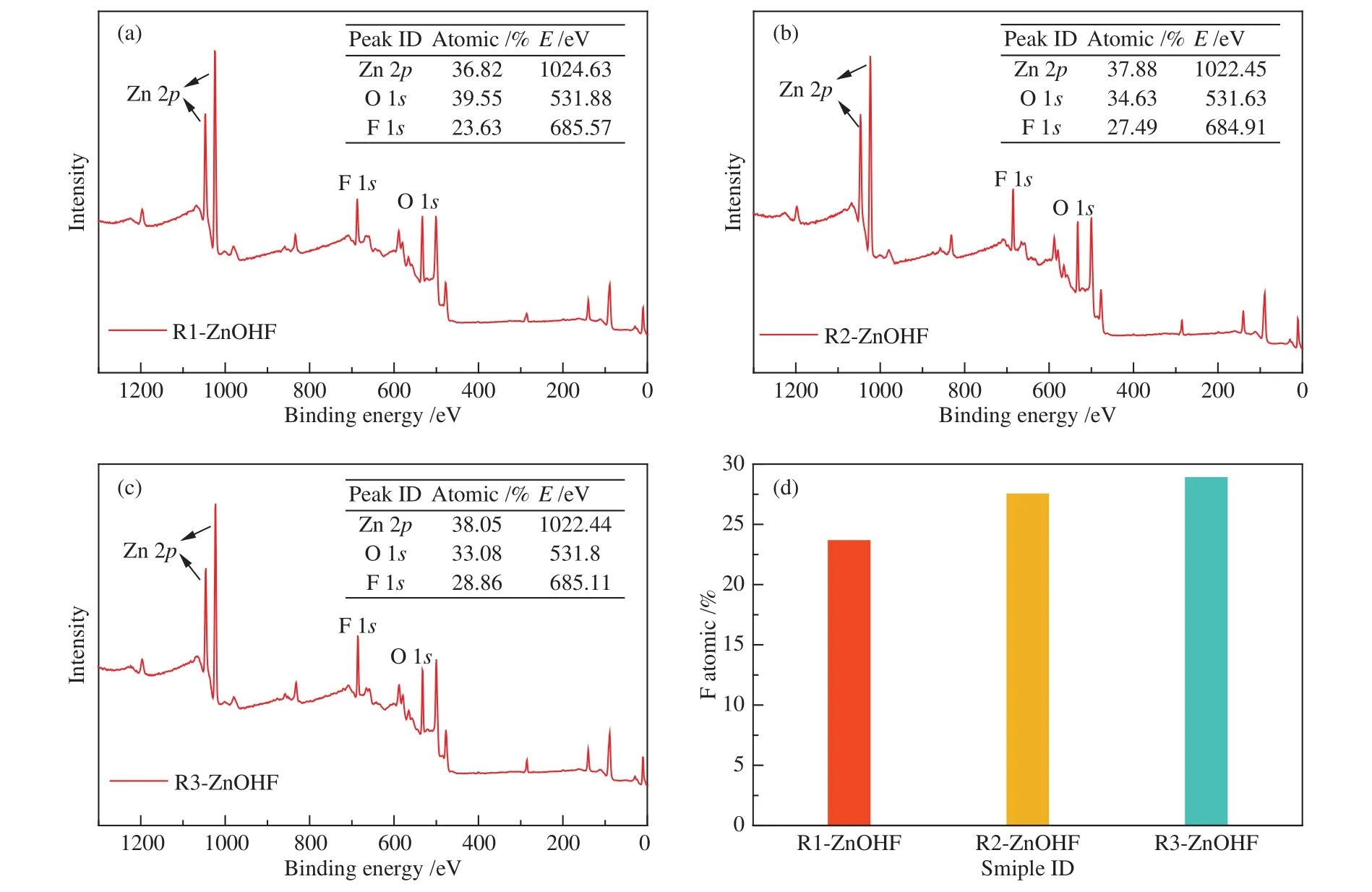
图4 (a):R1-ZnOHF、(b):R2-ZnOHF、(c):R3-ZnOHF 的 XPS 全谱图(表格为各元素含量及结合能位置);(d):R1-ZnOHF、R2-ZnOHF和R3-ZnOHF的表面F原子含量柱状对比Figure 4 XPS survey spectra of (a): R1-ZnOHF; (b): R2-ZnOHF; (c): R3-ZnOHF (the table shows the content and binding energy position of each element); (d): surface F atom content for R1-ZnOHF, R2-ZnOHF and R3-ZnOHF
为进一步分析ZnOHF纳米棒的微观结构,对其进行TEM表征(图5)。如图5(a)所示,R2-ZnOHF为直径200 nm左右的纳米棒结构,高倍透射电镜图(图5(b))显示其晶格条纹间距为0.22 nm,与 ZnOHF(211)晶面相对应(JCPDS No.32-1469)。EDS元素分布图显示Zn、O、F三种元素均匀分布,结合XPS分析,说明R2-ZnOHF不存在相位差,由此推测R3-ZnOHF同样不存在相位差(图5(c))。

图5 R2-ZnOHF 的(a)透射电镜照片,(b)高倍透射照片,(c)EDS 元素分布Figure 5 (a) Transmission electron microscope image, (b) High resolution transmission image, (c) EDS mapping of R2-ZnOHF
2.2 催化剂的性能测试
为探究ZnOHF纳米棒的催化活性,将喷涂在疏水碳纸上的R1-ZnOHF、R2-ZnOHF及R3-ZnOHF使用流动型电解池进行CO2RR性能测试,电解液为1 mol/L KOH 溶液。利用恒电位法持续电解 15 min以上,获得不同电位下的CO2还原电流密度,并利用色谱仪定量分析还原产物,通过计算获得不同电位下样品的法拉第效率。如图6(a)所示,R1-ZnOHF的CO和H2的法拉第效率较为接近,产物CO选择性较差,在−1.28 V(vs.RHE)处获得最大 CO 法拉第效率仅为66.9 %,这主要是因为材料中杂质的存在以及其表面较低的F含量未能有效抑制析氢反应的发生。R2-ZnOHF的CO法拉第效率明显提高,在−1.28 V(vs.RHE)处获得最大 CO 法拉第效率为76.42 %(图6(b))。R3-ZnOHF的CO法拉第效率最大处在−1.48 V处取得为 71.8 %(图6(c))。三者任一电位下CO与H2的法拉第效率之和均约等于100 %,说明还原产物只有CO和H2。通过柱状图对比三种样品的法拉第效率值的变化,R2-ZnOHF具有最优的CO2还原活性,R1-ZnOHF性能最差,R3-ZnOHF在各个电位下的法拉第效率与R2-ZnOHF接近但整体较低,这可能是因为ZnOHF纳米棒直径增大导致其比表面积减小而造成的(图6(d))。
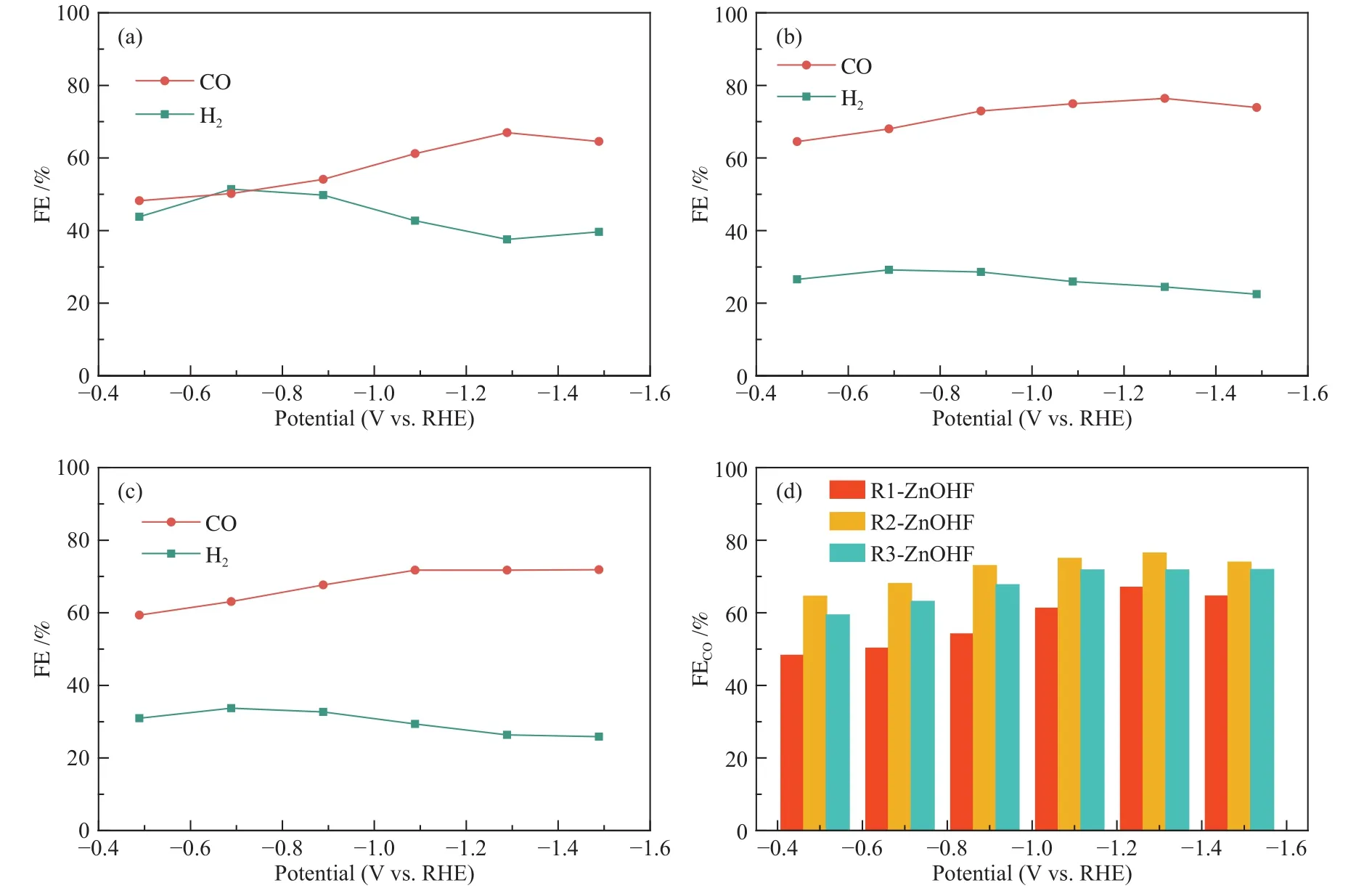
图6 (a)R1-ZnOHF、(b)R2-ZnOHF 及(c)R3-ZnOHF 的 CO 和 H2法拉第效率;(d)R1-ZnOHF、R2-ZnOHF 及R3-ZnOHF不同电位下CO法拉第效率柱状对比Figure 6 CO and H2 Faraday efficiency of (a) R1-ZnOHF, (b) R2-ZnOHF and (c) R3-ZnOHF; (d) CO Faraday efficiency comparison chart of R1-ZnOHF, R2-ZnOHF and R3-ZnOHF at different potentials
由于流动型电解池避免了CO2在电解液中缓慢的传质过程,通常进行CO2RR测试时会获得较大的电流密度[31]。图7(a)展示了R1-ZnOHF、R2-ZnOHF及R3-ZnOHF在不同测试电势下的电流密度,三种样品的总电流密度较为接近,在−1.28 V(vs.RHE)处分别为 82.93、75.7、79.1 mA/cm2。总电流密度与某一产物的法拉第效率的乘积即为该产物的部分电流密度[32]。图7(b)为三种催化剂不同电势下的 CO 部分电流密度,在−1.28 V(vs.RHE)处分别为 55.54、57.53、56.93 mA/cm2。R2-ZnOHF、R3-ZnOHF的H2部分电流密度相差不大,但明显低于R1-ZnOHF,说明在R2-ZnOHF、R3-ZnOHF在催化过程中对析氢反应的抑制更加明显,这可能是因为两者表面F原子含量更高(图7(c))。合适的F原子含量有助于抑制析氢反应,较大的比表面积会使得反应过程中材料表面局部pH值的升高进而起到抑制析氢的作用,两者综合作用使得R2-ZnOHF的H2分电流密度最低[18]。电化学阻抗谱测试显示R2-ZnOHF弧半径最小,说明其具有最好的动力学性能(图7(d))。

图7 R1-ZnOHF、R2-ZnOHF 及 R3-ZnOHF 的(a)总电流密度,(b)CO 分电流密度,(c)H2分电流密度,(d)EIS 谱图Figure 7 (a) Total current density, (b) CO partial current density, (c) H2 partial current density,(d) EIS spectra of R1-ZnOHF, R2-ZnOHF and R3-ZnOHF
为明确F原子的引入对催化剂性能的影响,将不添加NH4F合成得到的Zn4CO3(OH)6进行性能测试并与R2-ZnOHF对比(图8(a)、(b))。如图8(a)所示,Zn4CO3(OH)6的CO选择性明显低于R2-ZnOHF。在−1.28 V电势下,R2-ZnOHF的 H2部分电流密度相较Zn4CO3(OH)6下降约40 %,说明F原子的存在确实抑制了析氢反应的发生。为进一步说明流动型电解池相较传统H型电解池在提升反应总电流密度上的优势,分别使用Flow-Cell及H型电解池测试R2-ZnOHF样品,对比获得的对应法拉第效率和总电流密度(图8(c)、(d))。如图8(c)所示,在最佳电位−1.28 V处,H型电解槽中R2-ZnOHF的CO法拉第效率为74.18 %,与使用Flow-Cell测试获得的CO法拉第效率(76.42 %)接近。但在最佳电位下,相同样品在Flow-Cell中获得的总电流密度是使用H型电解池测得总电流密度的 9.3 倍,分别为 75.7 和 8.14 mA/cm2,这主要得益于流动型电解槽中反应传质速率的极大提升(图8(d))。

图8 Zn4CO3(OH)6和 R2-ZnOHF 的(a)CO 法拉第效率对比,(b)H2分电流密度对比;H 型电解池和流动型电解池中R2-ZnOHF 的(c)CO 法拉第效率,(d)总电流密度Figure 8 (a) CO Faraday efficiency comparison and (b) H2 partial current density comparison of Zn4CO3(OH)6 and R2-ZnOHF;(c) CO Faraday efficiency and (d) Total current density in H-type cell and Flow cell of R2-ZnOHF
利用XRD和SEM对反应后的R2-ZnOHF进行表征,如图9(a)所示,可以明显观察到属于金属锌(002)、(100)、(101)晶面的三个衍射峰(图9(a)中用“♣”符号标出),通常Zn催化剂中暴露的(101)晶面更多是则更有利于CO的生成,(002)晶面占比更高是则有利于析氢反应的发生[20, 33],由R2-ZnOHF纳米棒还原得到的金属Zn的(101)晶面与(002)晶面比率大于1,因此,具有良好的CO选择性。反应后的XRD仍然可以观察到属于ZnOHF的衍射峰(图9(a)中用“♥”符号标出),说明反应过程中F原子没有完全流失,因此,可以起到抑制析氢的作用,其余衍射峰则属于碳纸基底(图9(a)中用“♦”符号标出)。利用SEM表征考察其结构稳定性,从图9(b)可以看出,反应后的R2-ZnOHF仍然保持棒状形貌且直径大小没有明显变化,说明其具有良好的结构稳定性。此外,长时间稳定性是催化剂未来能否走向工业化的重要指标。由于碳纸本身机械强度较差,难以承受长时间寿命实验,因此,将R2-ZnOHF样品按相同单位面积负载量滴涂于玻炭电极上使用H型电解槽进行稳定性测试。如图9(c)所示,在−1.28 V的恒电位下,样品保持了300 min以上的稳定性,总电流密度无明显变化,CO选择性基本保持稳定。

图9 (a)反应后 R2-ZnOHF 的 XRD 谱图;(b)反应后 R2-ZnOHF 的扫描电镜照片;(c)稳定性测试,电解液为 0.1 mol/L KHCO3Figure 9 (a) XRD pattern and (b) Scanning electron micrograph of R2-ZnOHF after reaction; (c) Stability Test of R2-ZnOHF in H-type cell, the electrolyte is 0.1 mol/L KHCO3
3 结 论
本研究成功制备了不同直径大小的ZnOHF纳米棒,探究了其合成机理,并将其首次运用到电催化CO2还原反应当中。F元素的存在有效抑制了析氢反应的发生,更高的(101)晶面占比有利于CO的生成,直径200 nm左右的R2-ZnOHF表现出最好的二氧化碳还原活性。在−1.28 V(vs.RHE)电势下,R2-ZnOHF纳米棒的CO法拉第效率为76.4 %,流动型电解池的使用使反应速率有了明显提升,CO分电流密度达到57.53 mA/cm2且具有良好的结构和性能稳定性。本研究为Zn基催化剂的开发提供了更多选择。
