M2型巨噬细胞旁分泌调控甲状腺乳头状癌细胞生物学行为研究
2021-10-12龚麒麟吴宇刘辉
龚麒麟 吴宇 刘辉
甲状腺癌是近年来全球发病率上升最快的恶性肿瘤之一,美国甲状腺癌的发病率平均每年增加3.6%[1],在我国同样增长迅速。2006年甲状腺癌发病率在我国所有恶性肿瘤中位于第10 位之后,而2019年国家癌症中心发布的数据显示,甲状腺癌已位于常见恶性肿瘤第7 位,女性常见恶性肿瘤第4位[2]。甲状腺乳头状癌是甲状腺癌最常见的病理类型,研究甲状腺乳头状癌的发病机制具有重要意义。
肿瘤的发展与肿瘤所处的微环境密切相关。巨噬细胞是肿瘤微环境中重要的基质细胞,肿瘤相关巨噬细胞(Tumor-associated macrophages,TAMs)是浸润于肿瘤组织周围的巨噬细胞,与肿瘤发生、发展密切相关[3]。在正常生理情况下,巨噬细胞有M1、M2 型两种激活状态。TAMs 的表型和功能更倾向于M2 型巨噬细胞,因此,经常以M2 型巨噬细胞为对象研究TAMs 的致病过程[4,5]。
M2 型巨噬细胞与甲状腺乳头状癌关系密切。研究发现M2 型巨噬细胞密度越高,甲状腺乳头状癌分期越晚,预后越差[3],但M2 型巨噬细胞对甲状腺乳头状癌生物学行为的调控作用及其机制仍需深入研究。本研究探讨M2 型巨噬细胞对甲状腺乳头状癌TPC-1 细胞增殖、侵袭、迁移能力的影响及其作用途径。
1 材料与方法
1.1 细胞和主要试剂人甲状腺乳头状癌TPC-1细胞、人单核细胞系THP-1 细胞购于中国科学院上海细胞生物学研究所。CCK-8 试剂盒购自中国Biosharp 公司。SYBR Premix EX Taq 试剂盒购自宝生物工程(大连)有限公司。PCR 引物由美国 Invitrogen(北京)公司合成。
1.2 细胞培养甲状腺乳头状癌TPC-1 细胞加入含有1%双抗、10%胎牛血清的DMEM 培养基中,人单核细胞系THP-1 细胞加入含10%胎牛血清的RPMI 1640 培养基中,均于37℃、5%CO2孵箱中培养,2 天扩增1 次。
1.3 诱导、极化M2 型巨噬细胞每个含人单核细胞系THP-1 细胞培养皿加入5μl 佛波酯(PMA),放入37℃、5%CO2孵箱中培养24h,诱导THP-1 细胞贴壁分化为未极化的巨噬细胞(M0)。然后加入重组人IL-4(1∶500)和重组人IL-13(1∶500)各5μl,混匀后继续放入37℃、5%CO2孵箱中培养18h,分化为诱导极化的M2 型巨噬细胞。
1.4 M2 型巨噬细胞鉴定M2 型巨噬细胞的特点为高表达IL-10,精氨酸酶1(Arginase-1)活性增加。用RT-PCR 检测未极化的巨噬细胞和诱导极化的巨噬细胞IL-10、Arginase-1。按Trizol 试剂盒步骤提取每组细胞的总RNA,使用 Primer Script Treagent Kit试剂盒将提取的RNA 逆转录成 cDNA;再以cDNA为模板,使用 SYBR Premix EX Taq 试剂盒进行RTPCR。以β-actin 为内参,检测IL-10、Arginase-1的表达。各目的基因扩增条件相同,95℃预变性10min,95℃变性15s,60℃复制60s,95℃延伸15s,共40 个循环。结果采用2-ΔΔCT方法分析,引物序列见表1。
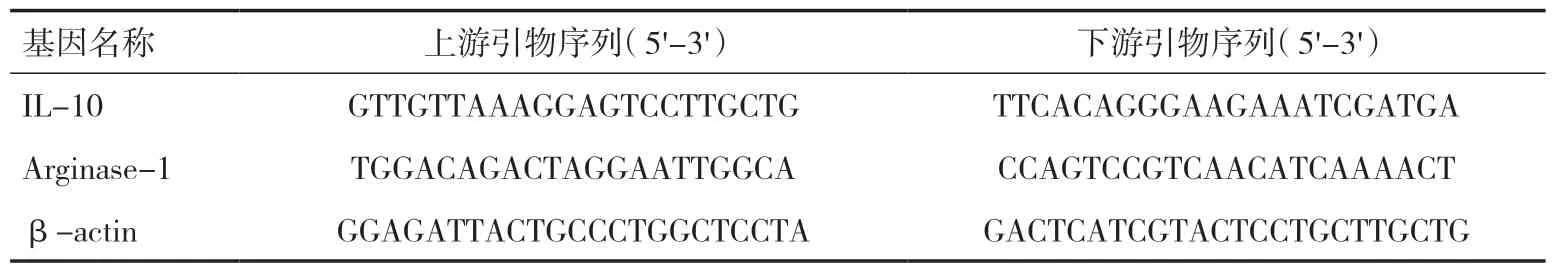
表1 引物设计
1.5 获得条件培养基及分组将M2 型巨噬细胞在无血清DMEM 中培养12h,然后通过0.22μm 滤膜过滤以除去细胞并收集条件培养基(CM)。设置研究组及对照组。研究组将TPC-1 细胞置入含CM的无血清DMEM 中培养。对照组将TPC-1 细胞置入不含CM 的无血清DMEM 中培养。研究组及对照组均置于37℃、5% CO2培养箱中培养24h。
1.6 细胞侵袭、增殖和迁移实验采用CCK-8 法检测细胞增殖能力:将研究组及对照组细胞接种于96孔细胞培养板中,细胞浓度为1×105个/ml,每孔加入100μl 细胞悬液(每组设置6 孔重复)。37℃、5% CO2培养箱中培养24h 后,加入CCK-8 进行细胞增殖检测,2h 内读取OD450 值。
采用Transwell 法检测细胞侵袭能力:研究组及对照组细胞培养24h 后,先消化细胞,然后用无血清培养基洗3 次,配成5×105个/ml 细胞悬液,在上室中加入100μl 细胞悬液(3 个室),在下室中加入500μl 完全培养基,培养24h 后用多聚甲醛固定,擦去上室内基质胶和细胞,1%结晶紫乙醇溶液孵育染色,显微镜下(×100)随机计数16 个视野内的膜下细胞数。
采用划痕法检测细胞迁移能力:将研究组及对照组细胞分别接种于6 孔板中,每个孔中加入约3.5×106个细胞。用记号笔在6 孔板背后用直尺划横线,每孔划3 条。细胞贴壁后用枪头和直尺垂直于背后的横线划痕, PBS 洗细胞2~3 次,去除划下的细胞,加入无血清培养基。放入37℃、5% CO2培养箱,培养0h、24h、48h 时各拍照6 张。
1.7 统计学分析采用SPSS 20.0 统计学软件分析数据,计量资料用均数±标准差(±s)表示,组间比较采用t检验,计数资料用n(%)表示,组间比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 M2型巨噬细胞诱导及鉴定经RT-PCR检测,诱导极化的THP-1 细胞中IL-10 表达量为2.58±0.36, Arginase-1 含量为3.79±0.45;未极化的THP-1 中IL-10 表达量为0.92±0.11,Arginase-1 含量为1.20± 0.23。诱导极化的巨噬细胞IL-10、Arginase-1 表达均高于未极化的巨噬细胞,两者差异有统计学意义(t=9.894,P=0.000;t=11.427,P=0.000)。结果显示诱导极化后的THP-1 细胞高表达IL-10、Arginase-1,符合M2 型巨噬细胞表型特征。
2.2 M2 型巨噬细胞对甲状腺乳头状癌TPC-1 细胞增殖能力的影响采用CCK-8 法检测细胞增殖能力。结果显示:研究组和对照组OD450 值分别为1.32±0.70、0.85±0.57,研究组OD450 值高于对照组,差异有统计学意义(t=11.869,P=0.000)。表明研究组细胞增殖能力强于对照组。
2.3 M2 型巨噬细胞对甲状腺乳头状癌TPC-1 细胞侵袭能力的影响采用Transwell 法检测细胞侵袭能力。结果显示:研究组和对照组的穿膜细胞数分别为(264.20±43.22)个、(138.60±29.99)个,研究组穿膜细胞数多于对照组(见图1),差异有统计学意义(t=5.339,P=0.01)。表明研究组细胞侵袭能力强于对照组。

图1 Transwell 法检测细胞侵袭能力(×100)
2.4 M2 型巨噬细胞对甲状腺乳头状癌TPC-1 细胞迁移能力的影响采用划痕法检测细胞增殖力。结果显示:研究组和对照组的迁移距离分别为(255.94±35.10)μm、(167.58±33.26)μm,研究组细胞迁移距离大于对照组(见图2),差异有统计学意义(t=4.086,P=0.04)。表明研究组细胞迁移能力强于对照组。

图2 划痕法检测细胞迁移能力(×100)
3 讨论
巨噬细胞是肿瘤微环境中的重要细胞,在某些肿瘤中可达到肿瘤微环境的50%[6]。在正常生理情况下,巨噬细胞有两种极化状态类型:M1 型巨噬细胞为经典活化型巨噬细胞,M2 型巨噬细胞为替代活化型巨噬细胞。M1 型巨噬细胞可由脂多糖(Lipopolys accharide,LPS)、干扰素γ(Interferon-γ,IFN-γ)和粒细胞-巨噬细胞集落刺激因子(GMCSF)刺激经典活化而来,它的特征是高表达IL-1β、TNF、IL-12 和IL-18,低表达IL-10。可抑制肿瘤、产生促炎细胞因子、介导对病原体的抗性并表现出强大的杀菌能力[7]。与经典途径相反的途径激活的巨噬细胞被称为 M2 型巨噬细胞,CSF-1、IL-4、IL-10、转化生长因子β(TGF-β)、IL-13、真菌和蠕虫感染之类的刺激有利于 M2 型巨噬细胞激活。M2 型巨噬细胞的特征是高表达IL-10,Arginase-1活性增加,低表达IL-12、IL-13[8]。M2 型巨噬细胞在促进肿瘤发生、血管生成、细胞基质重塑及过敏性疾病反应中起重要作用[9]。TAMs 是浸润在肿瘤周围的巨噬细胞,严格意义上来说,它并非巨噬细胞的一个亚群,因为这些细胞在稳态环境中并不存在,但在许多肿瘤中可以观察到。TAMs 与多种肿瘤的发生、增殖、侵袭和转移有关。研究发现,在大多数人和鼠的肿瘤组织中,TAMs 通常具有M2 型巨噬细胞的表型特征,因此可以通过研究M2 型巨噬细胞分析TAMs 的作用[10~12]。
M2 型巨噬细胞与乳腺癌[13]、肝癌[14]、结肠癌[15]等多种肿瘤的发生、增殖、侵袭和转移有关。动物模型也已证实,M2 型巨噬细胞减少与抑制肿瘤生长和转移相关[11]。M2 型巨噬细胞与甲状腺乳头状癌的关系同样密切。有组织学研究发现,高密度的M2 型巨噬细胞与甲状腺乳头状癌的高侵袭性、淋巴结转移数量多和TNM 分期晚有关,且M2 型巨噬细胞密度越高,癌症相关生存时间越短[16]。但在甲状腺癌细胞学上,相关研究甚少。本研究通过将M2 型巨噬细胞条件培养基与甲状腺乳头状癌TPC-1 细胞共培养,检测癌细胞的增殖、侵袭及迁移能力,发现在M2 型巨噬细胞条件培养基刺激下,TPC-1 细胞增殖、侵袭及迁移能力增加。本研究细胞学实验证实了M2 型巨噬细胞可以促进甲状腺乳头状癌TPC-1 细胞增殖、侵袭及迁移,可与上述学者在组织学上发现的结果相互印证[11,13~16]。本研究中TPC-1 细胞增殖、侵袭及迁移能力的增强是在去除M2 型巨噬细胞的条件培养基刺激下所致,因此进一步提示M2 型巨噬细胞促肿瘤作用是通过旁分泌相关细胞因子完成。
M2 型巨噬细胞通过旁分泌细胞因子调节肿瘤生物学行为在其他类型的肿瘤中已有发现,有学者在小鼠模型中发现巨噬细胞分泌的TNF-α 和IL-6 与结肠癌浸润增加有关[17]。M2 型巨噬细胞分泌基质金属蛋白酶9(MMP-9)会促进皮肤鳞癌的浸润[18]。在人乳腺癌细胞中发现,M2 型巨噬细胞表达表皮生长因子 (EGF) 促进乳腺癌细胞的侵袭,而乳腺癌细胞产生的CSF-1 会促进巨噬细胞高表达EGF,从而形成一个恶性循环[19]。但关于M2 型巨噬细胞是通过旁分泌哪些细胞因子调控甲状腺癌细胞生物学活性,目前国内外相关研究较少。有学者在PTC 的M2 型巨噬细胞培养基中发现趋化因子8(CXCL8)升高,而用CXCL8 抗体中和培养基后,PTC 细胞侵袭性降低,推断M2 型巨噬细胞可能通过CXCL8 旁分泌作用促进PTC 细胞转移[20]。但CXCL8 并非巨噬细胞分泌的特有细胞因子,内皮细胞及正常或恶性的甲状腺滤泡细胞均能分泌[21~23]。因此CXCL8 可能并非M2 型巨噬细胞调控甲状腺癌细胞转移的主要细胞因子。M2 型巨噬细胞促进甲状腺癌进展的分子机制仍未明确。
综上所述,本研究在体外细胞学层面证实了M2 型巨噬细胞可以促进甲状腺乳头状癌TPC-1 细胞的增殖、侵袭及迁移,且此作用是通过旁分泌细胞因子实现。但M2 型巨噬细胞调控甲状腺癌细胞生物学行为的具体细胞因子及其机制仍需后续实验进一步研究。
