一种肠类器官样本快速石蜡块的制作方法
2021-10-12包春娟周琪琪陈红英
李 丽,陈 菲,包春娟,周琪琪,陈红英
类器官于2009年由Sato等[1]首次报道,其能较好地模拟体内细胞三维生长的生理条件,目前已广泛应用于疾病的研究并成为最具前景的实验技术。肠道病理的药理学、毒理学或微生物研究中常采用人或小鼠肠道组织进行肠类器官培养[2]。肠类器官培养成为研究和治疗肠道疾病可行的方法[3],也是一种全新的消化道疾病体外研究模型。肠类器官在Matrigel三维基质胶内培养,通常被培养在24孔培养板内,由Matrigel基质胶包裹,基质胶直径5 mm,厚0.5~1 mm,培养2周左右弥散于基质胶内的肠类器官肉眼呈针尖大小。培养结束需借助病理技术手段,检测培养的肠类器官组织细胞的形态结构及与相关蛋白的表达情况,但目前对类器官的包埋技术仍有较高难度。本实验室采用快速脱水流程制作出适用于常规HE及免疫荧光双重染色的优质肠类器官石蜡切片,现介绍如下。
1 材料与方法
1.1 材料人结肠组织采用人肠类器官培养基IntestiCult Organoid Growth Medium(Stem Cell Technology公司,#06010)在基质胶Matrigel(Corning,#356237)内培养2周左右形成的肠类器官样本30例,10%中性缓冲福尔马林,无水乙醇,二甲苯,苏木精染液(贝索公司,BA4041),伊红染液(Thermo公司,7111),EDTA抗原修复液(福州迈新公司,MVS-0099),mouse anti-E-Cadherin抗体(1 ∶100,CST),rabbit anti-Ki-67抗体(1 ∶200,CST),Alexa Fluor 488 goat anti-mouse荧光抗体(1 ∶500,Invitrogen公司),Alexa Fluor 647 donkey anti-rabbit荧光抗体(1 ∶500,Invitrogen公司),Wash Buffer(Dako公司,DM831),DAPI(Sigma公司,D9542-5MG),增强型抗淬灭封片剂(佰诺全景0022001010),Super PAP Pen超级免疫组化油笔(福州迈新公司,PEN-0002),全自动脱水机(Thermo Excelsior AS),全自动封片仪(Thermo ClearVue),WSI全数字切片扫描仪(3DHISTECH Pannoramic SCAN),正置荧光显微镜(Leica DM4000B)。
1.2 方法
1.2.1进脱水机前处理 将培养在24孔板内的肠类器官样本用10%中性缓冲福尔马林固定2 h;双蒸水漂洗3次,每次1 min;将75%乙醇、85%乙醇、95%乙醇分别加入24孔板内脱水10 min;脱水后将有一定硬度的包裹肠类器官样本的基质胶用眼科镊轻轻取出,放入大小5 cm×5 cm的单层卷纸内且基质胶底面朝下放置,并在基质胶周围用铅笔画圈定位,折叠好后放入已打印好编号的包埋盒内。
1.2.2快速脱水 将包埋盒放入全自动脱水机进行脱水、透明、浸蜡流程,快速脱水程序设置如下:55%乙醇、65%乙醇、75%乙醇、85%乙醇、95%乙醇(Ⅰ、Ⅱ)、无水乙醇(Ⅰ、Ⅱ)分别5 min;二甲苯Ⅰ、Ⅱ、Ⅲ分别5 min,63 ℃石蜡Ⅰ、Ⅱ、Ⅲ各10 min,整个过程耗时不超过2 h。
1.2.3包埋与石蜡切片 打开卷纸,在铅笔划圈处找到肠类器官样本,用电热镊将样本迅速放入注满蜡液的热包埋模具[4]中央底部,转入包埋机小冷台轻压平,待底部凝固迅速放上包埋盒底盒再移至大冷冻台速冷。常规石蜡切片,肠类器官样本连续切片直至切完整个基质胶,避免再次切片时损失样本,切片厚度4 μm。
1.2.4常规HE及免疫荧光双重染色 (1)常规HE染色流程:石蜡切片常规脱蜡水化后入苏木精染液2 min,0.5%盐酸乙醇分化数秒,温水返蓝后入伊红染液20 s,梯度乙醇脱水,二甲苯透明,全自动封片仪封片,WSI全数字切片扫描仪扫片。(2)免疫荧光双重染色流程:石蜡切片常规脱蜡水化后,EDTA(pH 9.0)抗原修复液97 ℃修复30 min,山羊与驴混合血清[5]室温封闭30 min,滴加一抗混合液(E-Cadherin与Ki-67工作液1 ∶1混合)4 ℃孵育过夜,次日室温复温后Wash Buffer漂洗3次,避光滴加荧光二抗混合液(Alexa Fluor 488与Alexa Fluor 647荧光二抗工作液1 ∶1混合)37 ℃避光孵育30 min,甩掉二抗直接滴加DAPI工作液,2×SSC漂洗,双蒸水洗后用抗淬灭剂封片,正置荧光显微镜下观察。
2 结果
眼观可见培养在24孔培养板内呈类圆形,厚0.5~1 mm,直径5 mm的Matrigel基质胶,基质胶内弥散培养的肠类器官样本呈针尖大小。肠类器官样本石蜡切片HE染色可见典型的空腔样肠类器官结构及萌芽结构,上皮细胞核呈蓝色,细胞质呈粉红色(图1)。肠类器官样本石蜡切片行E-Cadherin与Ki-67免疫荧光双重染色,可见典型的空腔样肠类器官结构及萌芽结构上皮均高表达E-Cadherin蛋白,即几乎所有肠类器官上皮细胞膜显示绿色荧光,部分增殖上皮表达Ki-67蛋白,即部分肠类器官上皮细胞核显示红色荧光且与细胞核染料DAPI重叠,无明显背景荧光(图2)。
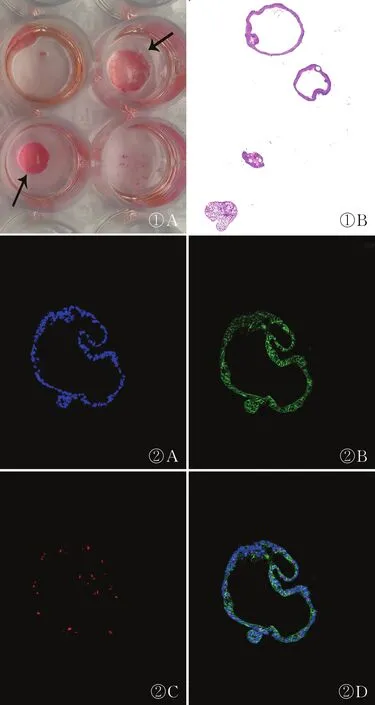
图1 肠类器官样本在基质胶内培养后大体及HE染色图:A.箭头所指两个类圆形区域为肠类器官用Matrigel三维基质胶培养固定后,滴染1滴伊红染液,基质胶内生长的肠类器官样本肉眼呈针尖大小;B.HE染色可见典型的空腔样肠类器官结构及萌芽结构,上皮细胞核呈蓝色,细胞质呈粉红色 图2 E-Cadherin与Ki-67免疫荧光双重染色:A.细胞核染料DAPI呈蓝色;B.肠类器官上皮高表达E-Cadherin蛋白,即几乎所有肠类器官上皮细胞膜显示绿色荧光;C.部分增殖上皮表达Ki-67蛋白,即部分肠类器官上皮细胞核显示红色荧光;D.E-Cadherin与Ki-67免疫荧光双重染色与细胞核染料DAPI重叠
3 讨论
类器官培养是一种三维空间培养,是过去10年干细胞培养较大的进展之一。除了肠类器官培养,近几年文献还报道肝类器官[6]、脑类器官[7]、肾类器官[8]等类器官培养技术,为体外研究相关组织器官疾病提供了全新的体外研究模型。培养的类器官样本通过常规HE染色观察类器官的组织细胞形态结构,利用免疫荧光染色技术分析类器官内蛋白定位及表达情况。肠类器官三维培养样本小且弥散于Matrigel基质胶内,基质胶固定前后用镊子夹取均易夹碎,从24孔板取出环节操作十分困难。作者经反复实验发现,基质胶固定后行短时间梯度乙醇脱水容易变硬,易从24孔板取出。由于大体观肠类器官样本只有针尖大小,石蜡包埋切片环节容易将肠类器官样本切掉,作者发现切片成功需注意以下几点:(1)进脱水机前处理环节,送检的肠类器官样本进脱水机前除使用10%中性缓冲福尔马林固定外[9],还需利用梯度乙醇脱水硬化的作用将24孔培养板内包裹肠类器官的基质胶处理变硬,利于眼科镊夹出变硬后的肠类器官样本。再用铅笔在卷纸上圈出样本放置的位置,经实践证实这样操作后期打开包埋纸时可快速找到样本。(2)脱水包埋环节:使用本实验室已有的快速细胞蜡块脱水流程[55%乙醇、65%乙醇、75%乙醇、85%乙醇、95%乙醇(Ⅰ、Ⅱ)、无水乙醇(Ⅰ、Ⅱ)分别5 min;二甲苯Ⅰ、Ⅱ、Ⅲ分别5 min,63 ℃石蜡Ⅰ、Ⅱ、Ⅲ各10 min,整个过程耗时不超过2 h)]处理的肠类器官样本质量好不发脆,石蜡切片无厚薄不均、裂痕、颤痕、褶皱现象,易于切出优质的连续切片。包埋环节参照罗添友等[4]报道的用热包埋模具包埋脱水后薄如纸的肠类器官样本,在此文献基础上改良包埋操作中的一个小细节,即一次性将热包埋模具填充满蜡液,避免二次充蜡改变肠类器官样本底面平整的位置,样本包埋平整可减少后续石蜡切片粗修次数,采用细修修出完整样本面,再一次性连续切片切完整个基质胶包裹的肠类器官样本,本实验每张防脱玻片捞3张石蜡切片,一个肠类器官石蜡块连续切片后可以捞片15张左右。(3)免疫荧光双重染色环节:本实验中两个抗体来源于不同宿主,通过间接法免疫荧光双重染色技术[5]可以将两种不同来源的一抗同时孵育,节约染色操作时间。为避免荧光串色,本实验选择Alexa Fluor 488荧光通道与Alexa Fluor 647荧光通道的激发波长与发射波长均无交叉。本实验还用抗淬灭封片剂有效避免荧光淬灭问题。
目前,本科室已顺利完成50余例肠类器官样本HE染色及免疫荧光双重染色实验,染色效果均良好,该肠类器官样本快速石蜡块的制作方法值得推广,也值得应用到肝、肾、脑及心脏等类器官培养样本的石蜡切片制作中。
