乳腺浸润性癌合并非霍奇金淋巴结内边缘区B细胞淋巴瘤6例临床病理分析
2021-10-12刘月平
王 续,刘月平
乳腺浸润性癌是女性常见的恶性上皮性肿瘤,其发病率和病死率均较高。乳腺浸润性癌的治疗已从传统的手术切除向个体化的靶向治疗迈进[1]。因此乳腺浸润性癌的病死率下降,其远期生存率亦逐年提高[1]。病理科医师在检查手术切除标本及所清扫淋巴结组织的同时,也会对淋巴结结构进行观察,从而发现了非霍奇金淋巴结内边缘区B细胞淋巴瘤(non-Hodgkin lymph node inner marginal zone B cell lymphoma, NHLNMZL)的存在,对于此类低侵袭性的淋巴瘤,并非所有患者均会表现出相应的B症状(如低热、盗汗、体重减轻),而是以乳腺肿物为主诉前来就诊[2-3]。因此,边缘区B细胞淋巴瘤(marginal zone B cell lymphoma, MZL)这种较为惰性的淋巴瘤与乳腺癌合并,却不以淋巴瘤的症状为首发表现。这两种肿瘤合并存在虽然是偶然事件,但在发病机制上可能存在一定的联系。本文收集6例乳腺浸润性癌伴发NHLNMZL的临床病理资料,在探讨其发病机制的同时,以期为相似病变的研究提供更多的理论依据,避免漏诊。
1 材料与方法
1.1 材料收集2007~2019年河北医科大学第四医院病理科诊断的36 961例乳腺浸润性癌,其中有6例乳腺浸润性癌合并NHLNMZL,占比0.016%。
1.2 方法标本均经10%中性福尔马林固定,石蜡包埋,3~4 μm厚连续切片,行HE及免疫组化MaxVision法染色(罗氏全自动免疫组化仪)。诊断淋巴瘤抗体中分别选用CD3和CD20作为T细胞及B细胞阳性对照,其他如CD21、B细胞淋巴瘤基因2、CD10、Cyclin D1、MNDA、CD38均为鼠抗(稀释比1 ∶50),Ki-67(稀释比1 ∶100),所有抗体均购自福州迈新公司。乳腺浸润性癌的21基因检测及非霍奇金B细胞淋巴瘤的Ig基因检测选用毛细管电泳一代测序法(PCR+一代测序),一代测序设备:AB3500xl。应用FISH法进行BCL-2、BCL-6、MYC基因检测,检测阈值为15%。
2 结果
2.1 临床特点6例患者均为女性,平均年龄52岁;病程为4~10个月,随访12~60个月。5例患者是由体检或存在乳腺症状而发现乳腺占位就诊,1例患者触及乳腺占位就诊。患者就诊前均无发热、盗汗、体重减轻等淋巴造血系统肿瘤的表现(B症状)。影像学检查:肿物大小4 cm×3 cm×4.5 cm~8 cm×8.5 cm×9 cm(图1)。术前CT示:2例患者发现淋巴结肿大,直径1.2~2.45 cm;其他均未发现浅表淋巴结肿大,且影像学未提示淋巴结异常表现(图2、3)。实验室检查:LDH、β-2微球蛋白等均无明显异常(表1)。超声引导下穿刺病理结果均为乳腺浸润性癌,明确病变性质后给予新辅助化疗,行肿瘤缩减,新辅助治疗后行根治性乳腺切除术。

2.2 病理特征及免疫表型6例患者均为乳腺浸润性癌合并NHLNMZL,但6例患者乳腺浸润性癌的类型不同,其中3例为非特殊类型乳腺浸润性癌,组织学表现为巢、团状分布,形成推挤状生长方式,其中2例可见浸润至周边脂肪组织,开放的腺管结构均不足30%,细胞胞质嗜酸性改变,细胞异型性中等,核分裂象为9~17个/10 HPF(即乳腺浸润性导管癌Ⅱ级)(表1,图4),其中1例明显伴有坏死。免疫组化标记E-cadherin阳性、p120胞膜阳性。1例为乳腺浸润性小叶癌,组织学形态:典型的缺乏黏附性的、小的一致性细胞浸润乳腺周围间质,呈列兵状排列,围绕腺管呈流水样分布,胞质呈窄环状,有的表现为胞质内空腔,核分裂象较少见(图5)。免疫组化标记E-cadherin阴性、p120胞质阳性。1例为乳腺浸润性黏液癌,镜下可见黏液湖中有成簇的癌细胞分布,癌细胞略呈腺样结构分布,表现并不密集,黏液湖周边可见丰富的纤维(富含毛细血管)间隔(图6),免疫组化标记E-cadherin阳性,Syn、CgA阴性(表2)。1例为浸润性微乳头状癌,镜下表现为立方或柱状细胞排列的中空或桑葚样实性巢团,周围环形分布有间质空隙,类似于淋巴管样脉管结构,但未见单层上皮(图7),EMA染色可显示该微乳头状结构极向翻转所形成的“内-外倒置”现象,占浸润性癌的40%,免疫组化标记E-cadherin阳性、EMA间质侧阳性;此例患者淋巴结中有2枚淋巴结发生癌转移。NHLNMZL典型特点:淋巴结结构已经毁损,其中有些病例可见变窄变薄的淋巴结内生发中心的套区;大量弥漫分布的单核样B细胞,细胞小至中等大小;细胞异型性中等,细胞胞质发空,略显透明状,可见病理性核分裂象;大量弥漫分布的单核样B细胞,细胞小至中等大小;细胞异型性中等,可见病理性核分裂象(图8、9)。免疫组化标记CD3散在阳性,CD20弥漫阳性(图10),CD21示FDC网扩大但较细(图11),BCL-2(图12)及MNDA阳性,CD10(图13)、Cyclin D1均阴性,Ki-67增殖指数约20%。
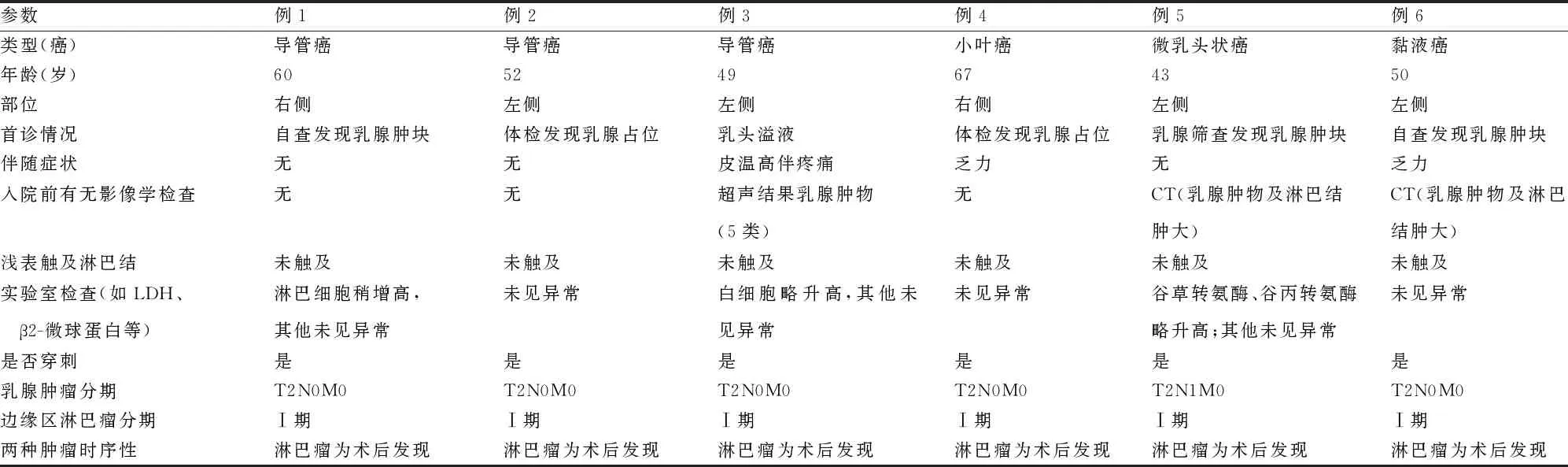
表1 6例乳腺浸润性癌合并NHLNMZL的临床特点

表2 6例乳腺浸润性癌合并NHLNMZL的免疫表型及基因检测结果
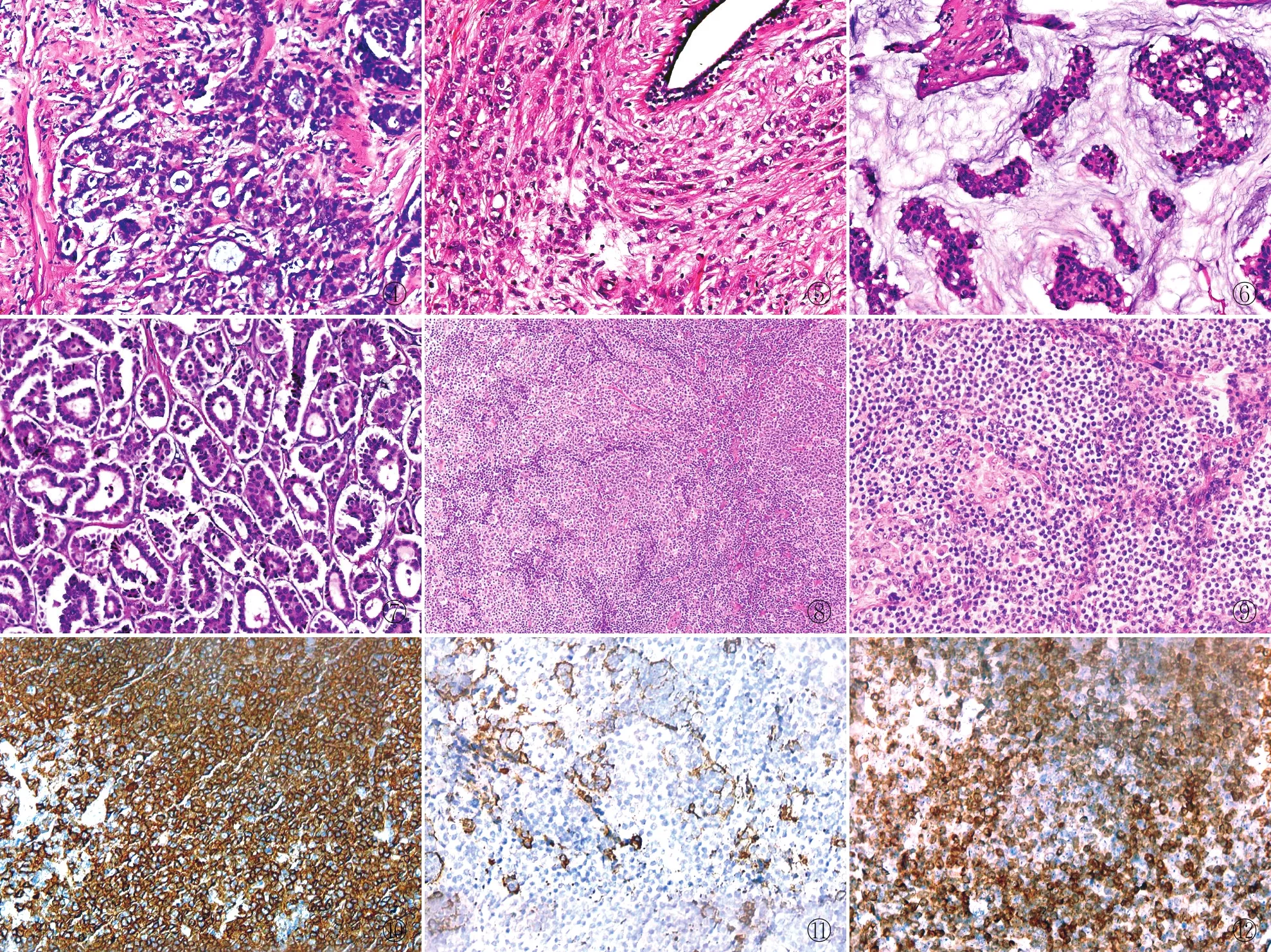
图4 肿瘤组织浸润性生长,形成推挤状的边缘,肿瘤细胞呈条索状、丛状、小梁状 图5 肿瘤细胞呈单行条索状排列浸润间质,浸润性条索围绕正常导管向心性排列 图6 肿瘤细胞巢漂浮在黏液湖中,并由纤细的富含毛细血管的纤维分割 图7 肿瘤细胞立方或柱状排列成中空或桑葚样细胞团,缺乏纤维血管轴心,周围环绕间质可见空隙 图8 增生活跃的不规则结节状结构,显著增生的单核样B细胞浸润其中,与小细胞混合 图9 淋巴结较高倍显示单核样B细胞呈弥漫分布,并具有结节状结构 图10 CD20弥漫阳性,MaxVision法 图11 CD21勾勒出FDC网扩大且不规则,MaxVision法 图12 BCL-2阳性细胞较为弥漫且进入到生发中心内,MaxVision法
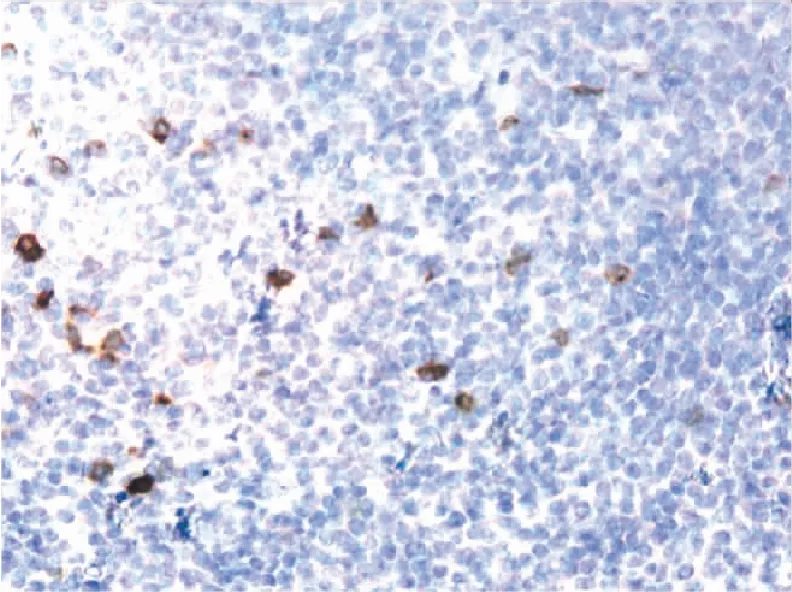
图13 CD10只在生发中心内散在的细胞阳性,肿瘤细胞阴性,MaxVision法
2.3 分子病理检测乳腺浸润性癌21基因检测:其中4例21基因复发风险评分(recurrence score, RS)为中危(RS=26.69),1例为高危(RS=34.21),1例为低危(RS=12.34)。NHLNMZL利用毛细管电泳一代测序法检测Ig基因H、K、L阳性(图14);FISH检测显示BCL-2、BCL-6、MYC均无重组。
3 讨论
3.1 乳腺浸润性癌的诊断乳腺癌的各种组织学类型不仅代表乳腺浸润性癌的病理类型,而且其组织学表现与患者的预后密切相关。对于所有类型的乳腺浸润性癌,均需行ER、PR、HER-2及Ki-67检测以明确其分子分型,准确应用合理的治疗方案[1]。本组6例患者均是查体发现乳腺占位,为进一步明确治疗而来院就诊。明确手术指征的同时,给予患者粗针穿刺活检,明确性质后患者接受了新辅助化疗,1例患者术前未接受完整化疗,在术后重新进行完整的化疗,手术采用全乳切除+腋窝淋巴结清扫,其中1例乳腺浸润性微乳头状癌患者术后还需接受胸骨上下的淋巴结放疗及化疗。6例患者ER、PR均呈80%以上强阳性,其中2例HER-2 2+行FISH检测,1例出现HER-2扩增,其余4例患者均为HER-2阴性(0、1+)。对于浸润性癌的病理类型及鉴别诊断相对较为明确,组织学表现包括肿瘤细胞的生长方式及免疫组化结果可以明确诊断。本组6例行21基因检测1例RS为高危,4例为中危,1例为低危。浸润性乳腺癌和非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)的发生是否显示有直接关系?有文献报道显示[3],药物治疗及放疗对诱发淋巴造血系统肿瘤的可能性加大[2]。本组乳腺浸润性癌患者合并NHLNMZL,临床罕见。然而,乳腺癌的21基因检测是针对乳腺癌的复发风险评估,这其中包括16个乳腺癌相关基因和5个参考基因之间的相互作用[1-2]。有文献报道乳腺浸润性癌的术后放、化疗确实可增加罹患淋巴造血系统肿瘤的风险[3]。因此,单纯的从乳腺癌基因检测及临床症状上很难确定乳腺浸润性癌和NHL的直接联系。这也需要更多的临床病例研究来进行揭示。
3.2 NHLNMZL的诊断本组乳腺浸润性癌合并淋巴瘤均为NHLNMZL,具有低侵袭性和惰性[4]。通常乳腺浸润性癌患者未进行全身影像学检查和PET-CT检查,粗针穿刺可诊断出乳腺浸润性癌,但易漏诊合并的惰性NHL[4-5]。NHLNMZL临床无淋巴瘤的临床症状如低热、盗汗、体重减轻等B症状[6],患者行乳腺全切术经高年资乳腺肿瘤病理诊断医师与淋巴造血系统肿瘤病理诊断医师联合检查才能明确NHLNMZL诊断。NHLNMZL细胞异质性为单核样B细胞或中等大小中心细胞样,这些小至中等大小的细胞通常混合在一起,且由小细胞向中等大小细胞进行性转化[4-5]。单核样B细胞胞核圆形到不规则形,核浓缩、核染色质深,核仁不明显,细胞质丰富淡染,有明显的细胞质膜。免疫表型:CD20弥漫阳性,CD21显示扩大不规则的FDC网,MNDA阳性[7];CD5、CD23、Cyclin D1等均阴性;基因检测显示Ig基因出现重组,BCL-2、BCL-6、MYC基因均无重组。文献报道[6-7]非霍奇金低级别B细胞淋巴瘤与乳腺浸润性癌不属于同一种类型和系统的肿瘤。目前,基因检测仅针对淋巴造血系统肿瘤进行检测[8]。有学者分析BCL-2凋亡基因的信号转导通路,对乳腺浸润性癌以及妇科肿瘤的发生、发展起预测作用[9]。
3.3 乳腺浸润性癌合并非霍奇金B细胞淋巴瘤乳腺癌是导致女性癌症相关死亡的常见原因,与其治疗相关的继发性癌症的发病率亦有所增加[1,10]。在血液系统恶性肿瘤中,淋巴瘤、急性髓系白血病与骨髓增生异常综合征相比,发病率较低[4,11]。本组6例乳腺浸润性癌的病理组织学特点典型,导管癌可见腺管样结构,癌巢浸润周围间质,癌细胞核异型性明显,胞质嗜酸性;浸润性小叶癌组织学形态亦经典,呈单形性条索排列的肿瘤细胞浸润纤维间质,免疫组化标记E-cadherin阴性、p120阳性可资鉴别;浸润性黏液癌与伴有黏液外渗的黏液囊肿样病变的鉴别较为困难,重要线索是后者发现导管因黏液样物质充填而扩张,以及黏液湖中漂浮的细胞团外附肌上皮细胞,而浸润性黏液癌镜下不存在肌上皮细胞;微乳头状癌的组织学特征是立方或柱状肿瘤细胞排列成中空或桑椹样细胞团,缺乏纤维血管轴心,免疫组化标记均显示极向翻转(即“内-外”倒置),导致肿瘤细胞的顶端面呈现出空隙,诊断也明确。对于合并MZL,淋巴结结构呈模糊的结节状,可见变窄变薄的淋巴结内生发中心套区;大量弥漫分布的单核样B细胞或中心细胞,细胞为小至中等大小;细胞异型性中等,胞质发空,略显透明状,可见病理性核分裂象;大量弥漫分布的单核样B细胞为其经典特点,主要表现为惰性,临床经过可以排除侵袭性淋巴瘤,另外免疫组化标记CD21显示变纤细和扩大不规则的FDC网,Cyclin D1、BCL-6、CD10阴性,CD23同样显示纤细和扩大不规则的FDC网,可以除外套细胞淋巴瘤、滤泡性淋巴瘤、小淋巴细胞淋巴瘤。乳腺浸润性癌与非霍奇金B细胞淋巴瘤究竟哪一个首发,尚不明确[12]。其可能原因:(1)烷基化剂通过与DNA交联引起5号和7号染色体长臂的基因突变和缺失[2,12]。这些基因突变影响IL-3、IL-4和其他活跃于细胞增殖的基因,另一种机制通路是可能激活RAS并触发肿瘤抑制基因突变[12],导致细胞过度增殖、分化,最终形成淋巴造血系统肿瘤,这其中以急性白血病最多见[12-13]。(2)文献报道乳腺浸润性癌患者合并非霍奇金B细胞淋巴瘤临床罕见,这与病理取材、外科医师淋巴结清扫的范围有关[14]。有大宗病例研究显示,盆腹腔的癌症患者合并或继发淋巴瘤属于小概率事件[15]。随着免疫治疗新时代的开启,在免疫治疗合并综合化疗的大背景下,癌症术后非原发部位的非霍奇金淋巴瘤能够揭示出更深层次的分子病理机制[4-5,16],尤其是低级别非霍奇金B细胞淋巴瘤:MZL、滤泡性淋巴瘤、小淋巴细胞淋巴瘤等[6,17]。(3)可能与亚洲淋巴瘤分类的流行病学研究关系密切[4,6,18],大多数亚洲地区淋巴瘤患者表现为惰性的症状,这也许可以解释为什么这些淋巴瘤患者在癌症手术之前没有被发现。那么基于对亚洲人淋巴瘤的流行病学研究,还需要积累更多资料进行验证[18]。因此,低级别非霍奇金B细胞淋巴瘤患者治愈率低,未经治疗且长期存活的病例较常见[19]。目前研究有局限性,需要肿瘤科医师在早期非霍奇金淋巴瘤患者无症状时能够确诊并对其进行治疗,避免其并发症[20]。因此,对于乳腺浸润性癌合并淋巴瘤患者,需要病理科、肿瘤科医师密切合作,在疾病早期阶段及时发现,为患者治疗赢得时间[1,5,19],避免遗漏。
