WNT7b促进黑素瘤细胞的迁移、侵袭与上皮间质转化
2021-10-12陈奕鹤马立文殷旭峰
陈奕鹤,马立文,殷旭峰,吴 迪,骆 丹*
1南京医科大学第一附属医院皮肤科,江苏 南京 210029;2南京大学附属鼓楼医院皮肤科,江苏 南京 210008
恶性黑素瘤是一种高度恶性的肿瘤,早期易发生转移,近年来黑素瘤的发病率和病死率日益增加,并呈现出年轻化趋势,尽管它的发病只占皮肤肿瘤的4%,但死亡人数却占75%[1]。WNT 信号通路在胚胎发育、组织内稳态和再生中起着重要作用[2],其功能异常与许多疾病的发生有关,包括胚胎畸形、退行性疾病和肿瘤发生[3-4]。WNT 信号通路被分为两种主要途径,包括β-catenin 依赖性途径和β-catenin非依赖性途径,前者被称为经典途径或WNT/β-catenin途径,而后者被称为非经典途径[5]。人类WNT家族由19 种不同的富含半胱氨酸的糖蛋白组成,一般来说WNT1、WNT2、WNT3、WNT3a、WNT8a、WNT8b、WNT10a和WNT10b是经典途径的激活剂,而WNT4、WNT5a、WNT5B、WNT6、WNT7a、WNT7b 和Wnt11 是非经典WNT 信号的常见激活剂,但也有研究表明,经典和非经典WNT 通路之间可能存在串扰[6]。报道证实WNT7b 在前列腺癌中高表达[7],在高分化乳腺癌中的表达也明显高于低分化乳腺癌,且其高表达可作为判断乳腺癌预后的标志[8];WNT7b还可以作为胰腺导管腺癌发生发展中Wnt/β-catenin 信号通路差异激活的主要决定因子[9];miR-505通过直接靶向抑制WNT7b而使Wnt/β-catenin信号通路失活[10]。然而WNT7b在黑素瘤中还未有深入研究。本研究探讨了WNT7b 在黑素瘤细胞中的表达情况,以及敲低WNT7b对人源黑素瘤细胞系A375分子生物学行为的影响,进而初步探讨WNT7b在黑素瘤发生发展中的作用,为黑素瘤的靶向治疗提供新的线索。
1 材料和方法
1.1 材料
DMEM 培养基、MEM 培养基(Gibco 公司,美国),胎牛血清(杭州四季清公司),胰蛋白酶-EDTA消化液、双抗、RIPA 蛋白裂解液、BCA 试剂盒(上海碧云天公司),细胞周期检测试剂盒(上海联科生物),siRNA、riboFECTTM CP reagent(广州锐博生物),TRIzol(Invitrogen 公司,美国),SYBR Green Master Mix(Applied Biosystems 公司,美国);WNT7b抗体(Abcam公司,美国),GAPDH、Vimentin、E-cadherin、N-cadherin 抗体(Cell Signaling Technology 公司,美国),Cyclin E1、Cyclin D1、c-MYC、Snail1、FOXC2、基质金属蛋白酶(matrix metalloproteinases,MMP)-2、MMP-3、MMP-7 抗体(Proteintech 公司,美国),MMP-9抗体(Affbiotech公司,美国),羊抗鼠、羊抗兔二抗(Cell Signaling Technology公司,美国);CO2培养箱(Thermo Fisher公司,美国),激光共聚焦显微镜(Olympus 公司,日本),实时定量PCR 仪(ABI 公司,美国),流式细胞分析仪(Becton-Dickinson 公司,美国)。
1.2 方法
1.2.1 细胞培养与转染
A375、SK-MEL-28、A875 细胞系由中国医学科学院皮肤病研究所病理实验室赠送;A375、A875 细胞使用含有1%双抗、10%胎牛血清的DMEM 培养基,SK-MEL-28 细胞使用含有1%双抗、10%胎牛血清的MEM培养基,培养于37 ℃、5%CO2培养箱。实验分为空载组(NC组)与实验组(WNT76-siRNA组),转染前24 h消化收集细胞并计数,按1×105个/孔铺于6孔培养板中,当细胞覆盖率达70%时进行转染(依照riboFECTTM CP reagent说明书),培养48 h后提取总RNA与总蛋白。敲低WNT7b的siRNA序列为5′-CAGACCTGGTGTACATTGA-3′。
1.2.2 RNA提取与qRT-PCR
用TRIzol 试剂提取细胞总RNA 并进行浓度测定,RNA 反转录为cDNA 后,使用SYBR Green Master Mix 的RT-PCR扩增cDNA并检测,最后根据PCR反应曲线记录的Ct值计算2-ΔΔCt值。引物设计见表1。
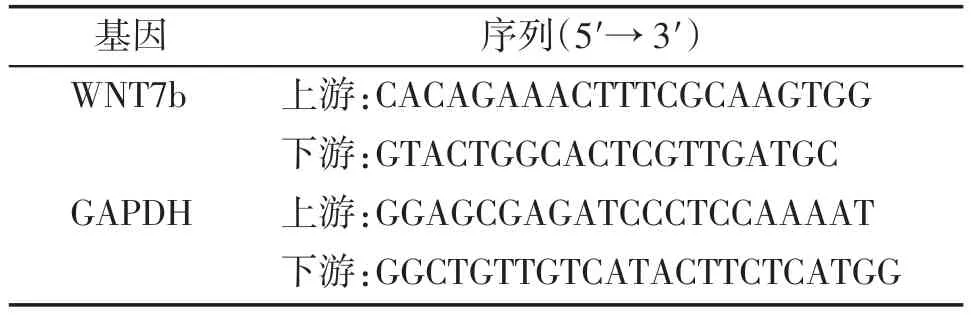
表1 qRT-PCR引物序列Table 1 Seguences of qRT-PCR primers
1.2.3 Western blot检测
使用含有蛋白酶抑制剂的RIPA 裂解液提取细胞总蛋白,使用BCA蛋白分析试剂盒测量蛋白浓度后加适量上样缓冲液100 ℃煮沸5 min 使其变性。每孔取蛋白提取物20 μg通过SDS凝胶电泳分离并转移到PVDF膜上。用含有5%脱脂奶粉溶液的TBS-T封闭1 h;4 ℃孵育一抗过夜;TBS-T 洗膜3 次,每次10 min;室温下孵育相应二抗1 h;TBS-T 洗膜3 次,每次10 min;然后使用ECL化学发光液在Bio-Rad分子成像仪上成像,并用Image J软件进行灰度分析。
1.2.4 免疫荧光分析
细胞计数后铺于共聚焦小皿中,转染48 h 后;PBS洗膜3次,每次10 min;4%多聚甲醛固定20 min;PBS 洗涤3 次,每次3 min;然后在室温下用0.5%Tritonx-100 渗透20 min;PBS 洗涤3 次,每次3 min;山羊血清封闭30 min;4 ℃孵育一抗过夜;PBST 洗涤3 次,每次3 min;37 ℃孵育荧光二抗1 h;PBST洗涤3次,每次3 min;DAPI染色5 min;PBST洗涤4次,每次5 min。图像使用激光共焦显微镜拍摄。
1.2.5 细胞周期分布的检测
细胞转染48 h 后用不含EDTA 的胰酶消化,收集各组细胞后-20 ℃固定于无水乙醇中。检测当天将固定细胞离心弃去乙醇,加入3 mL室温下的PBS放置15 min 使细胞再次水化,离心弃上清,加入1 mL DNA staining solution 涡旋振荡5 s 混匀,室温避光孵育30 min 后使用流式细胞分析仪检测细胞周期分布。
1.2.6 细胞划痕实验
将A375 细胞铺于6 孔板中,转染48 h,待细胞贴壁生长至80%时,用10 μL 无菌移液枪头沿孔中间轻轻划过,然后用PBS 洗涤细胞2 次去除漂浮细胞,分别于0、48 h拍照,观察划痕愈合情况。
1.2.7 Transwell实验
制备细胞悬液前先让细胞撤血清饥饿6 h,进一步去除血清的影响,消化后离心弃去培养液,用PBS 洗1~2 遍,用无血清培养基重悬。取细胞悬液100 μL(1×105个细胞)加入Transwell 小室;24 孔板下室加入500 μL 含30%FBS 的培养基,常规培养12 h。吸除小室培养基,4%多聚甲醛固定,用湿棉球擦去上表面细胞,0.1%结晶紫染色15 min,PBS洗掉多余染色,用镊子取下小室底膜,封片观察。
1.3 统计学方法
使用GraphPad Prism 5.0 分析从3 个独立实验中获得的数据,并以平均值±标准差()表示,多组间比较采用方差分析,两两比较采用SNK值,P<0.05为差异有统计学意义。
2 结果
2.1 WNT7b在不同黑素瘤细胞中的表达情况
qRT-PCR 及Western blot 结果显示,WNT7b 在人源黑素瘤细胞A375、SK-MEL-28、A875 中均有表达,A375较其他细胞系WNT7b表达量更高,差异有统计学意义(P<0.01,图1)。

图1 不同黑素瘤细胞系中WNT7b的表达水平Figure 1 Expression levels of WNT7b in melanoma cell lines
2.2 siRNA瞬时转染A375细胞WNT7b敲低效率检测
选取WNT7b表达量高的A375细胞系进行siRNA瞬时转染,qRT-PCR 及Western blot 结果显示与NC组相比,WNT7b-siRNA 转染组A375 细胞中WNT7b mRNA 及蛋白表达量均明显降低,敲低效率达60%,差异有统计学意义(P<0.001,图2)。

图2 A375 细胞中WNT7b 在mRNA 与蛋白水平敲低效率的检测Figure 2 Knockdown efficiency detection of WNT7b mRNA and protein in A375 cells
2.3 WNT7b敲低对A375细胞生长周期的影响
流式细胞分析检测细胞周期,结果显示,与NC组相比,WNT76-siRNA组G1 期细胞数量增加,说明敲低WNT7b 后,A375 细胞生长阻滞于G1 期,差异有统计学意义(P<0.01,图3)。

图3 敲低WNT7b对A375细胞周期的影响Figure 3 Effects of WNT7b knockdown on the cell circle of A375 cells
2.4 WNT7b敲低对A375细胞迁移、侵袭能力的影响
划痕实验结果显示WNT7b敲低后A375细胞迁移能力受到抑制,差异有统计学意义(P<0.01,图4A);Transwell实验结果显示WNT7b敲低后A375细胞侵袭性明显降低,差异有统计学意义(P<0.001,图4B)。

图4 敲低WNT7b对A375细胞迁移和侵袭能力的影响Figure 4 Effects of WNT7b knockdown on migration and invasion ability of A375 cells
2.5 WNT7b 敲低对A375 细胞上皮-间质转化(epithelial-mesenchymal transition,EMT)的影响
考虑到WNT7b敲低后A375细胞迁移和侵袭能力受到抑制,我们进一步评估了WNT7b 敲低后A375细胞的EMT过程。结果发现WNT7b-siRNA组表现出上皮细胞标志物E-cadherin 表达上调,间充质标志物N-cadherin 及Vimentin 的表达下调,调控黑素瘤细胞EMT 的关键因子Snail 也被同时下调(图5)。在细胞培养方面可观察到,WNT7b 敲低后A375 细胞由纺缍形的间质细胞形态转变成多角形的上皮细胞形态,免疫荧光分析显示WNT7b广泛分布于细胞质中,敲低WNT7b 后WNT7b-siRNA 组的细胞呈上皮细胞样改变(图6)。以上结果从EMT分子标志物以及细胞形态学改变两方面说明WNT7b参与了A375细胞的EMT过程。

图5 敲低WNT7b对A375细胞EMT相关标记蛋白表达的影响Figure 5 Effects of WNT7b knockdown on EMT markers of A375 cell
2.6 WNT7b敲低对A375细胞中MMP的影响
MMP 是介导细胞外基质降解的含锌内肽酶。MMP 在肿瘤细胞的迁移、侵袭、转移和血管生成过程中发挥着重要作用,同时也被认为是EMT的诱导因子[11-12]。因此我们通过Western blot 对NC 组与WNT7b-siRNA 组中与黑素瘤发生发展密切相关的MMP-2、MMP-3、MMP-7和MMP-9进行检测,结果发现MMP-2、MMP-7及MMP-9表达降低,其中MMP-9降低最显著(图6A),进而通过免疫荧光分析对MMP-9的降低进行了验证(图6B)。说明WNT7b可能通过MMP影响A375细胞的迁移、侵袭与EMT过程。
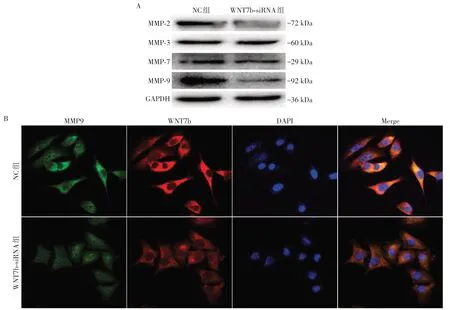
图6 敲低WNT7b对A375细胞MMP家族成员表达的影响Figure 6 Effects of WWT76 knockdown on MMP members of A375 cells
3 讨论
恶性黑素瘤进展极快,且对放疗及化疗不敏感。临床上早期恶性黑素瘤患者通过手术切除,其5 年总体生存率达95%以上,但对于中晚期黑素瘤患者来说,目前还没有有效的治疗方法能显著延长患者生存期[13]。近年来免疫治疗与基因靶向治疗手段发展迅速,主要包括免疫检查点抑制剂疗法[14-15]和MAPK/ERK 细胞信号通路抑制剂[16],但单一治疗效果欠佳。研究显示,联合两种及两种以上不同作用机制的方法或药物治疗的效果比单一治疗有明显提升[17-19]。因此,在深入探究恶性黑素瘤发病机制、寻找更有效的治疗靶点基础上,为患者提供精准的治疗方案成为未来发展的方向。
经典WNT信号通路也叫Wnt/β-catenin途径,通过调节LEF/TCF家族DNA转录来调节细胞的行为,其核心是胞质内β-catenin的稳定性,β-catenin水平低下时,Wnt 通路关闭;当其水平较高时,Wnt 通路开放。近年研究发现,恶性黑素瘤的高侵袭转移倾向与WNT 信号通路的异常激活有关[6]。在WNT 蛋白家族中,WNT3a 可减少黑素瘤细胞间的黏附,促进其迁移[20];WNT5a 可激活NF-κB 信号通路,并通过分泌细胞因子和趋化因子对黑素瘤产生免疫调节作用[21],还能诱导MARCKS蛋白磷酸化促进黑素瘤的转移[22]。然而,作为WNT蛋白家族中另一关键蛋白分子,WNT7b在黑素瘤发生发展中的功能未见报道。本研究首先检测了黑素瘤细胞系中WNT7b的表达情况,发现WNT7b 在人恶性黑素瘤细胞系A375、SK-MEL-28、A875中均有表达,其中A375细胞系表达量最高,这可能与A375细胞系较SK-MEL-28与A875细胞系,具有更强侵袭性与更短的成瘤时间有关[23-24]。通过流式细胞周期分析、划痕实验、Transwell实验发现敲低WNT7b使A375细胞生长阻滞于G1期,同时细胞的迁移与侵袭能力受到抑制。
EMT是黑素瘤发生发展过程中的现象,具体表现为细胞由多角形的上皮细胞转变成纺缍形的间质细胞,细胞极性丧失,细胞间黏附力下降,同时诱导血管生成,致肿瘤细胞迁移和侵袭能力大大增加[25]。WNT信号通路在黑素瘤EMT诱导中起重要作用[20],WNT 信号通路激活后可使E-cadherin 表达下调,Snail表达上调,E-cadherin的缺失释放钙黏蛋白结合的β-catenin,游离的β-catenin 可以迁移到细胞核并诱导促侵袭因子的转录[26]。我们通过Western blot检测EMT相关标志物蛋白,发现上皮标志物E-cadherin 表达上调、间充质标志物包括Ncadherin和Vimentin下调以及重要调节因子Snail下调,说明WNT7b可能参与A375细胞的EMT过程。
MMP作为EMT的诱导因子,促进肿瘤的发生发展、迁移侵袭与转移[27]。其中MMP-2和MMP-9作为明胶酶主要切割Ⅳ型胶原蛋白,在黑素瘤进展中起关键作用。MMP-2的高表达与结构损伤、异型性进展和血行转移密切相关;MMP-9在炎性细胞如巨噬细胞、嗜中性粒细胞和肥大细胞中表达较高,促进黑素瘤的放射状生长,因此可能与肿瘤侵袭的早期阶段有关。同时MMP-9 可通过增强血管内皮生长因子和成纤维细胞生长因子在恶性肿瘤中的表达,间接通过增加营养物质供应促进肿瘤侵袭发展[28]。因此我们进一步对MMP家族关键分子进行检测,发现WNT7b敲低后,A375细胞中MMP-2、MMP-7与MMP-9表达量降低,其中MMP-9 显著降低,进而通过免疫荧光分析对MMP-9 的降低再次进行了验证,认为WNT7b 可能通过抑制MMP 表达,诱导A375 细胞EMT的发生,从而促进细胞的迁移、侵袭。
综上所述,WNT7b可促进恶性黑素瘤细胞的转移与侵袭,MMP-9作为WNT7b下游重要蛋白调控分子,参与恶性黑素瘤细胞EMT 过程,但其中更多的分子间相互作用以及具体调控途径有待进一步研究。本研究可为恶性黑素瘤的精准基因靶向治疗提供新参考。
