齐墩果酸对酒精诱导的大鼠胃壁氧化损伤的保护作用
2021-10-12李宏伟孔德钦于卫华吴昊王钊刘瑞海春旭王欣刘江正李文丽
李宏伟,孔德钦,于卫华,吴昊,王钊,刘瑞,海春旭,王欣,刘江正,,李文丽,
(1.空军军医大学军事预防医学系军事毒理学与防化医学教研室,陕西省自由基生物学与医学重点实验室,教育部特殊作业环境危害评估与防治重点实验室,陕西西安710032;2.63710部队医院,山西忻州036301)
伴随着我国经济高速发展和人民生活水平的不断提高,酒精类饮品的消费量呈现逐年提高的趋势,部分人群有酗酒习惯,已经成为严重危害身心健康的公共卫生问题。长期或者大量摄入酒精可以导致胃壁的急性或慢性损伤,临床较为常见的是急慢性胃炎或者溃疡。酒精作为一种有机溶剂,极易通过生物膜,胃壁是重要的吸收途径之一,胃壁上皮细胞接触的酒精浓度往往较高,反复高剂量暴露容易导致胃壁损伤。针对酒精诱导胃壁损伤目前还缺乏有效的防治药物,从中医药中寻找安全有效的化学单体是解决这一难题的新思路与新途径。
酒精诱导胃壁损伤的发病机制较为复杂,可能与胃壁保护性和侵袭性因素之间的平衡紊乱有关,胃壁屏障功能降低、血管结构和功能紊乱、氧化应激损伤、过度炎症反应、胃酸分泌等可能参与了酒精性胃壁损伤的发生和发展过程。其中,酒精在代谢过程中通过细胞色素P450家族成员2E1(CYP2E1)等途径可以产生大量活性氧(reactive oxygen species,ROS)和自由基,氧化应激损伤被认为是核心机制之一。酒精暴露还能激活胃壁组织内炎症细胞和免疫细胞等,激活炎症通路,导致炎症损伤级联反应,诱导炎症性损伤,进而损伤胃壁。针对酒精诱导胃壁损伤的氧化应激与炎症机制,采用合理的抗氧化和抗炎药物干预可能对于减轻酒精诱导胃壁损伤具有良好保护作用。
齐墩果酸(oleanolic acid,OA)是一种广泛分布于植物体内的五环三萜类天然化合物(图1),是多种中药有效成分之一,同时也是人类饮食中不可缺少的组成部分。OA常温下为白色结晶性粉末,密度是1.1 g/cm,几乎不溶于水,可溶于酒精。OA已被证明具有较好的抗炎、抗氧化和免疫调节作用。但OA对酒精诱导胃壁损伤是否具有保护作用还未见报道。本研究旨在探讨OA对酒精诱导胃壁损伤的保护作用,并明确抗氧化和抗炎是否参与了上述保护作用,为临床上酒精性胃壁损伤的防治提供新的途径和思路。
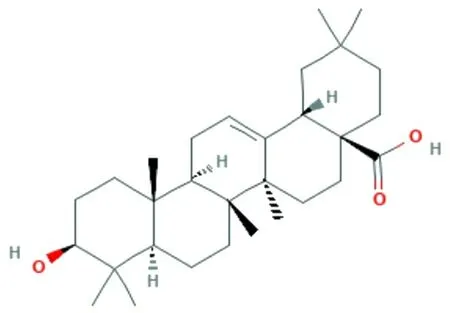
图1 齐墩果酸(C30H48O3)的化学结构式
1 材料与方法
1.1 实验动物
雄性清洁级SD大鼠24只,体质量(180±20)g,购于空军军医大学动物实验中心,饲养于本教研室SPF级动物房内,自由摄入水和普通饲料,适应性喂养一周。动物房内环境相对湿度(50±10)%,温度(25±2)℃,12 h/12 h交替昼夜循环,每日观察动物一般情况。
1.2 试剂与仪器
1.2.1 主要试剂
齐墩果酸(CAS号508-02-1)购于国药集团化学试剂有限公司,乙醇(CAS号64-17-5)购于美国Sigma公司。丙二醛(malondialdehyde,MDA)含量检测试剂盒、氧化型谷胱甘肽(oxidized glutathione,GSSG)和还原型谷胱甘肽(glutathione,GSH)含量检测试剂盒、蛋白提取试剂盒均购于南京建成生物技术研究所。RNA反转录试剂盒、SYBR Green一步法RTPCR试剂盒购于中国TIANGEN公司。BCA蛋白定量试剂盒购于美国Thermo Scientific公司。NF-E2相关因子(nuclear erythroid 2-related factor 2,Nrf-2)抗体、TNF-a抗体、IL-6抗体均购于美国Abcam公司。β-actin一抗购自美国Cell Signaling Technology公司。所有其他化学品均为化学纯以上级别。1.2.2 主要仪器
TE2000倒置显微镜系统购于日本Nikon公司;SCIENTZ-48高通量组织研磨器购于新芝公司;全自动高速冷冻离心机购于美国Sigma公司;Infinite M200 Pro全波段酶标仪购于瑞士Tecan公司;Mini-PROTEAN电泳系统、蛋白半干转装置及凝胶成像与分析系统均为美国Bio-Rad公司产品。1.3 方法
1.3.1 动物分组和处理
随机数表法将24只SD大鼠随机分为对照组、酒精暴露组、OA干预组共3组,每组8只。对照组,每天灌胃同等热量葡萄糖溶液,持续30 d;酒精暴露组,采取灌胃方式给予酒精(4 g/kg,50%,V/V
),持续30 d;OA干预组,采取灌胃方式给予溶解了10 mg/kg OA的酒精(4 g/kg,50%,V/V
)溶液中,持续30 d。末次处理6 h后,使用5%苯巴比妥钠腹腔注射麻醉大鼠,腹主动脉取血,然后取出胃,使用眼科剪小心剪开胃壁,展开后数码相机拍照。取部分胃中部组织于4%多聚甲醛溶液中,HE染色观察。其余胃组织用冰冷的生理盐水冲洗血水,取一部分胃组织在预冷生理盐水中制备5%的胃组织匀浆液,所有步骤均在冰浴条件下进行。剩余胃组织于-80℃条件下保存。
1.3.2 组织病理学检测
胃组织用4%多聚甲醛固定。将组织块包埋于石蜡中,并切成5 μm厚。苏木精-伊红(HE)染色后,使用倒置显微镜观察组织病理学改变。1.3.3 氧化损伤及抗氧化指标检测
用眼科剪将100 mg胃壁组织剪碎,置于4 mL EP管中,加入1.9 mL预冷的生理盐水,SCIENTZ-48高通量组织研磨器振荡匀浆(30 Hz频率,运行10 s,停止20 s,重复5次),制备成5%胃组织匀浆,以测定胃组织氧化损伤指标。严格按照MDA、GSSG和GSH含量检测试剂盒的说明书操作步骤完成。1.3.4 RT-PCR检测
使用Trizol试剂(TaKaRa)从大鼠胃壁组织中提取总RNA。收集RNA溶解在无DNase/RNase的水中。使用NanoDrop 2000分光光度计(Thermo,美国)分析RNA的浓度和纯度。使用EasyScript First-Strand cDNA合成超级混合试剂盒(Thermo Fisher SCIENTIFIC)对提取的总RNA(1 μg)进行反转录。反应条件如下:42℃、60 min,70℃、5 min。使 用QuantStudio 7 Flex实 时PCR系 统(Thermo Fisher SCIENTIFIC,美国)和SYBR premix Ex Taq试剂盒(TaKaRa)进行基因扩增,循环条件为95℃、15 s,60℃、20 s,72℃、20 s。cDNA引物(5′-3′)为:TNF-a(F:GCGTGTTCATCCGTTCTCTACC;R:TACTTCAGCGTCTCGTGTGTTTCT)。IL-6(F:CCC ACCAGGAACGAAAGTCA,R:GCGGAGAGAAACTT CATAGCTGTT。Nrf-2(F:GCTGATACTACCGCTGTTC;R:GTGGAGAGGATGCTGCTGA)。mRNA的相对定量值使用2方法,β-actin
基因作为内参基因。1.3.5 Western blot检测
通过组织蛋白提取试剂盒提取胃壁组织总蛋白质。使用BCA蛋白定量试剂盒定量样品蛋白,取30 μg蛋白在12.5% SDS-PAGE上分离(恒压120 V,电泳时间约1.5 h),半干转到PVDF膜上(甲醇浸泡),并在37℃下在5%脱脂奶粉中封闭2 h。TNF-a、IL-6、Nrf-2、Tubulin(1∶1 000)一抗4℃下孵育过夜,然后TBST清洗4次。二抗(1∶5 000)37℃下孵育1 h,使用Bio-Rad Quantity One软件对条带进行定量分析,采用Tubulin作为内参蛋白。1.4 统计学方法
实验数据采用x
ˉ±s
表示,运用Graphpad Prism分析软件进行统计分析,应用LSDt
检验进行组间的两两比较,以α
=0.05为检验水准。2 结果
2.1 OA干预对酒精诱导胃组织病理学损伤的影响
采用HE染色检查胃组织病理学变化,结果见图2。对照组表现为正常的胃壁颜色和结构。与对照组相比,酒精暴露组的胃壁颜色较深,HE染色可见胃壁表面黏液层受损,部分胃小凹消失,黏膜下层可见大量红细胞。OA干预组显著减轻了酒精导致的胃壁损伤性改变。以上结果表明,酒精暴露能够诱导大鼠胃壁组织结构发生损伤,OA干预具有保护作用。
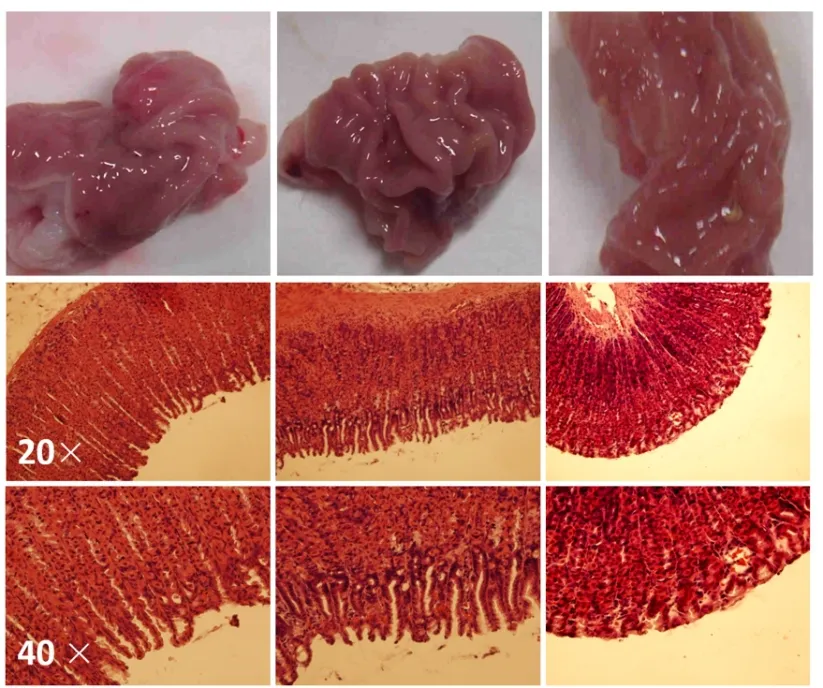
图2 OA干预对酒精诱导胃壁组织病理学损伤的影响
2.2 OA干预对酒精诱导大鼠胃壁组织氧化应激损伤的影响
MDA和GSSG检测结果见图3,可见与对照组比较,酒精暴露能够导致胃壁组织MDA和GSSG水平显著上升(P
<0.05),而与酒精暴露组相比,OA干预能够显著抑制酒精诱导的MDA和GSSG水平升高(P<
0.05)
。以上结果表明OA干预能够显著地减轻酒精诱导的胃壁组织氧化应激损伤。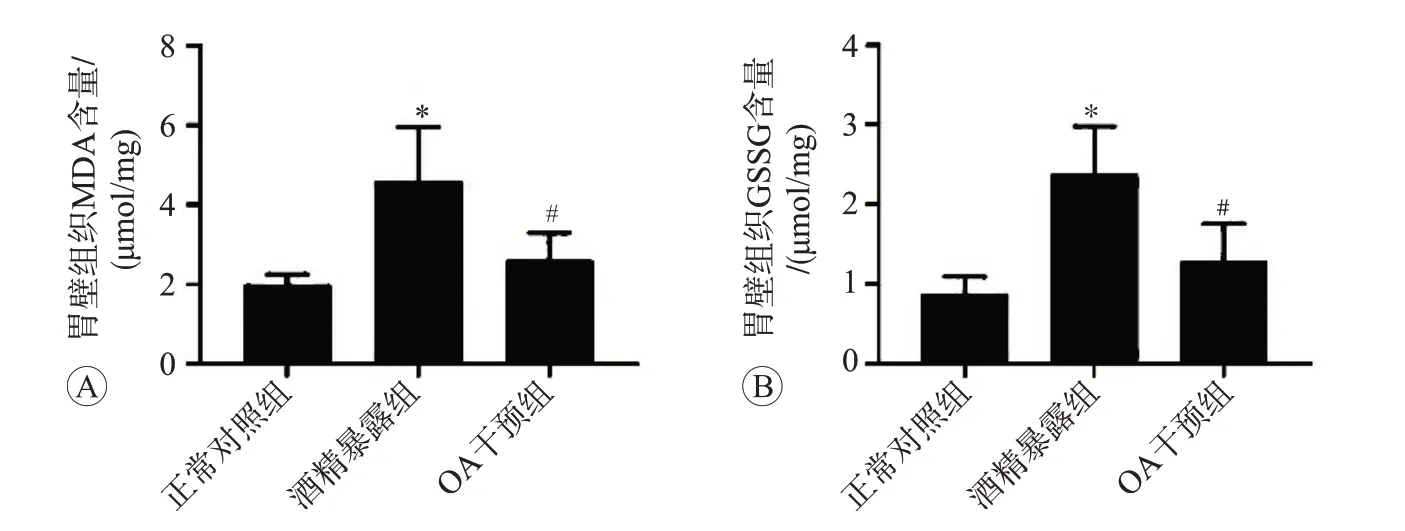
图3 OA干预对酒精诱导大鼠胃壁组织氧化应激损伤的影响
2.3 OA干预对酒精暴露后大鼠胃壁组织抗氧化功能影响
结果如图4所示。与对照组相比,酒精暴露组大鼠胃壁组织GSH水平和GSH/GSSG比值显著降低(P
<0.05),而与酒精暴露组比较,OA干预明显抑制了酒精诱导的GSH水平和GSH/GSSG比值的降低(P
<0.05)。为了进一步研究抗氧化酶的调控机制,我们检测了Nrf-2的mRNA和蛋白表达状况。RT-PCR和Western blot检测结果表明,与阴性对照组相比,酒精暴露导致Nrf-2的mRNA和蛋白表达均升高(P
<0.05)。与酒精暴露组相比,OA干预进一步增加了Nrf-2的mRNA和蛋白表达(P
<0.05)。以上结果提示,以Nrf-2为核心的抗氧化防御体系功能增强可能参与了OA处理对酒精诱导胃壁损伤的保护作用。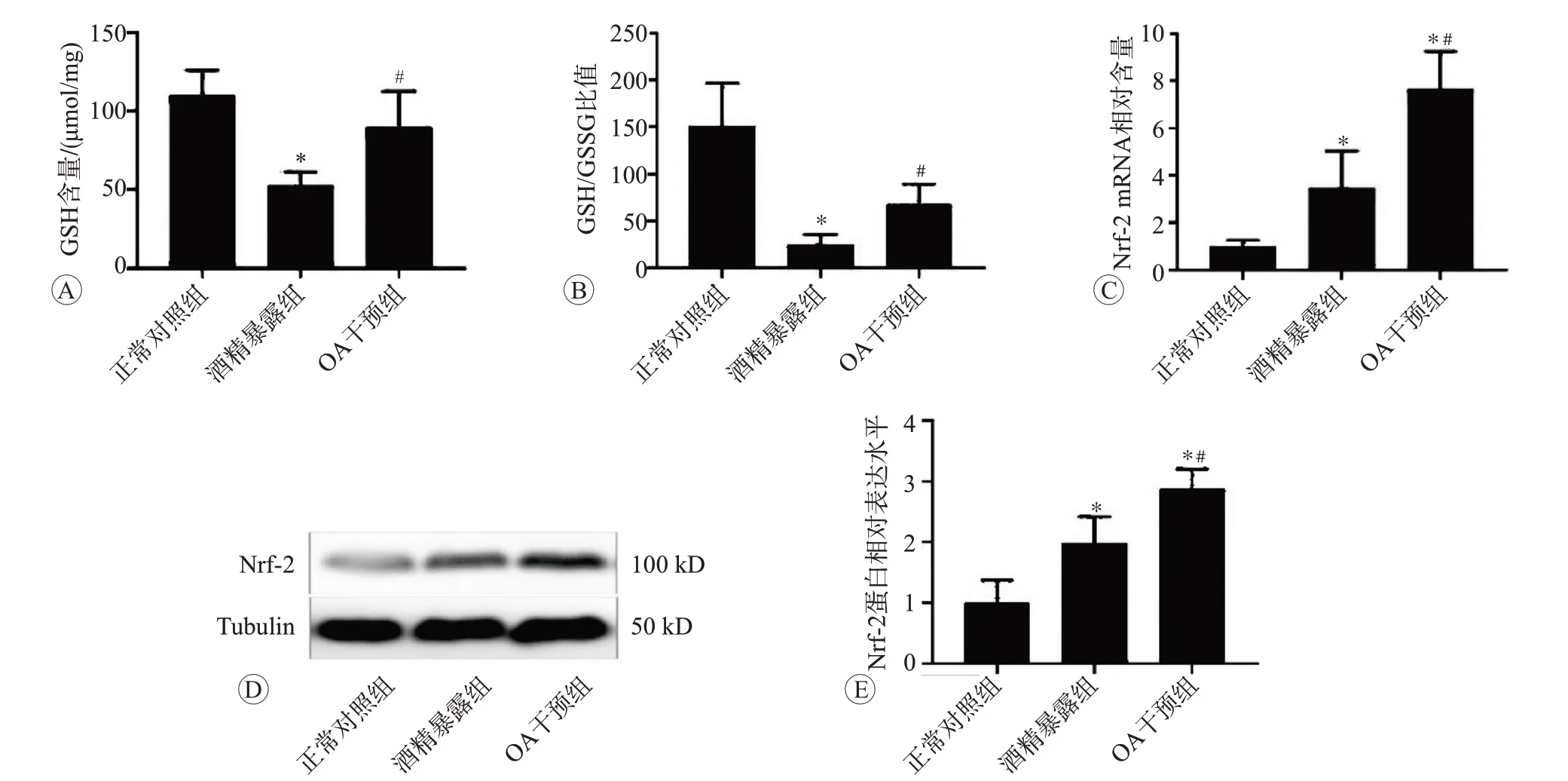
图4 OA干预处理对酒精暴露后大鼠胃壁组织抗氧化功能的影响
2.4 OA干预对酒精诱导大鼠胃壁组织炎症反应的影响
结果见图5。和正常对照组相比,酒精暴露导致大鼠胃壁组织TNF-α和IL-6的mRNA和蛋白水平均显著升高(P
<0.05)。而OA干预后,上述基因和蛋白表达受到显著抑制。这些结果表明OA可以通过抗炎通路抑制酒精诱导的胃壁损伤。
图5 OA共处理对酒精诱导大鼠胃组织炎症反应的影响(n=3)
3 讨论
本文通过给予大鼠经口灌胃高浓度酒精(4 g/kg,50%,V/V
)方式成功建立酒精性胃壁损伤模型,研究了OA干预后对大鼠胃壁损伤的改善作用。结果显示,OA降低大鼠胃壁表面黏液层受损状况,黏膜下层红细胞明显减少,降低炎症反应和脂质过氧化水平,具有显著的抗酒精性氧化应激损伤和抗炎作用。氧化应激是酒精性胃壁损伤的关键机制之一。过量酒精在体内不能及时代谢,会诱导大量超氧化物、羟基阴离子和过氧化氢等活性氧的产生,引起脂质过氧化反应,损害细胞结构,进一步造成机体功能障碍。MDA、GSH和氧化型谷胱甘肽(GSSG)在胃壁组织中的浓度以及MDA的血浆浓度被用作氧化应激的生化标志物。MDA是细胞脂质过氧化反应的终产物之一,引起蛋白质、核酸等生命大分子的交联聚合,具有细胞毒性。当DNA的双螺旋被交联而不能打开,致使细胞死亡,同样蛋白质被交联后形成沉淀物,蛋白质被破坏,细胞功能受到影响。机体正常状态时,ROS处于低水平,当ROS产生过量时可以使GSH转变为GSSG,发挥抑制ROS清除的作用。文献[8]报道Nrf-2是机体调节抗氧化应激反应的重要转录因子,可以从细胞质转移到细胞核,与抗氧化反应元件结合,正向调节II相解毒酶和抗氧化酶等靶基因的表达,从而有效改善氧化反应。在本研究中,OA干预能够显著降低MDA和GSSG水平,增加Nrf-2的表达水平,提示OA可以通过调节机体氧化应激作用来改善胃损伤。
众多研究表明,TNF-α、IL-6等多种炎症因子对急性胃溃疡发挥关键作用,TNF-α能引导中性粒细胞向胃壁组织浸润,IL-6通过STAT途径介导激活NF-κB信号通路,导致上皮细胞黏附分子、中性粒细胞的表达。本实验结果表明OA降低大鼠TNF-α、IL-6的表达水平,进而改善胃壁损伤。
综上所述,本研究表明OA对酒精诱导的大鼠胃壁损伤具有显著的保护作用,其保护机制可能与OA的抗氧化活性和抗炎作用有关。本研究提示OA可能是一种临床上缓解酒精中毒导致胃损伤的有效药物。OA治疗酒精诱导胃壁氧化损伤和炎症反应的机制研究尚处于初级认识阶段,以转录组学、代谢组学等高、新、尖的科研技术为研究手段,探索其作用机制任重道远。
