马尾松松材线虫病抗性无性系的筛选和遗传多样性分析
2021-10-10高景斌徐六一叶建仁
高景斌,徐六一,叶建仁
(1.安徽林业职业技术学院,安徽 合肥 230031;2.松材线虫病预防与控制技术国家林业和草原局重点实验室,安徽 合肥 230031;3.安徽省林业科学研究院,安徽 合肥 230031;4.南京林业大学,江苏 南京 210037)
松材线虫是20世纪80年代初由境外传入我国的一种重大的检疫性森林病害。1982年首次报道以来,已扩散到我国17个省721个县级行政区[1-2],自然感染至少16种松树[3],其中,马尾松是受松材线虫病的危害最严重的树种。安徽省是发生马尾松松材线虫病重灾区之一。因松材线虫病流行环节多,国内外至今无理想防治技术,松材线虫病抗病育种则有望成为解决松材线虫病发生的根本途径[4]。马尾松是我国重要的乡土树种,主要分布在长江流域,中国的西南部地区,淮河和汉水流域以南,以及长江中下游,是贫瘠山地造林重要的林木树种,具有较好的园林观赏价值[5],同时也是培育抗松材线虫病种质资源的重要树种之一[6]。目前抗松材线虫病马尾松培育主要有两种方式:一种是通过在健康母树采种,通过培育实生苗培育抗性松树苗[6-7],这是目前最主要的培育抗性松树的方法;另外一种则是通过组织培养技术繁殖抗性马尾松,目前技术还在继续完善[8]。笔者通过运用SCAR分子标记引物,运用MuPS(Multiplex-PCR of SCAR markers)反应体系技术分析安徽省马尾松抗性候选单株种质资源的遗传信息,从分子水平上揭示抗性候选单株在DNA序列上的差异性,分析抗性马尾松的遗传特性[9-13],测定马尾松抗性候选单株间的亲缘关系[14-18],旨在将研究结果反馈到马尾松抗性种子园管理中,及时调整和除去生长性状表现差和抗病性弱的建园无性系,指导抗性杂交亲本选定等,提高种子园抗病子代的水平,同时为抗性无性系的资源鉴定评价和良种繁育提供一定的理论依据,实现对抗性无性系的科学管理,为优良抗性种子园的建立奠定基础。
1 材料与方法
1.1 参试材料来源
2000年,安徽省实施马尾松抗松材线虫病育种项目,分别在安徽省广德县、潜山县等10个县、市的马尾松林分中选择具有潜在抗松材线虫病特征的马尾松母树,并按单株采种和按家系育苗,最终获得324个自由授粉家系在圃地作进一步的表型测定。通过2003—2004年松材线虫人工接种试验,从251个家系中初筛出1 201个对马尾松松材线虫病表型较好的候选单株(每个家系选择3~5个有抗性表型的单株),汇集种植在安徽省林业高科技中心,建立马尾松抗松材线虫病候选单株种植园。该种植园地貌系丘陵平原,土壤较肥沃,适宜多种树木生长,周边20多公里范围内无马尾松林分分布,具良好的自然隔离条件。
为检测这批入选家系及其单株抗马尾松松材线虫病的稳定性,采用湿地松为砧木嫁接方法,将初筛单株繁殖成嫁接无性系,用于再次接种松材线虫和进行抗性再评估。初选的1 201个无性系经再次抗性评价,筛选出110个高抗性无性系(来自初筛材料中的81个家系),分别用于马尾松抗松材线虫病种子园营建和进一步分子标记研究。
1.2 样品预处理
2008年5月,以上述具较强松材线虫病抗性表型的110个无性系为试验材料,进行分子标记分析。从每个马尾松抗性候选无性系采集2~3根发育正常的新鲜针叶装入锁口自封袋,记录试验材料编号。带回实验室后即用不锈钢剪刀将针叶剪碎,取30 mg针叶装入指形管置液氮中处理2 min,再在细胞破碎机中破碎,贮存于-80 ℃备用。
1.3 DNA的提取纯化
参照文献[19-20]中制备植物基因组DNA的CTAB方法,稍作改良。采用MagExtractor (TOYOBO)提纯,调整浓度后在-20 ℃冰箱中保存。
1.4 SCAR分子标记
1.4.1 引物设计
试验采用RAPD分子标记方法,以具有松材线虫病抗性表型的马尾松无性系的基因组DNA为模板,用98对随机引物进行扩增作引物的初步筛选,将部分多态性好的片段克隆、基因测序并且进行引物设计,筛选出SCAR分子标记引物。经过测定,其中14对引物根据SCAR分子标记的碱基大小和序列特征,既能够获得较好的扩增多态型,又避免引物间形成二级结构,将14对引物分成M1、M2两组(表1),各引物等比例混合后获得终浓度为0.2 μmol/L。

表1 马尾松遗传多样性研究用引物Table 1 Primers for genetic diversity of Pinus massoniana

表1(续)
1.4.2 MuPS反应
PCR扩增反应体系(10 μL):2 μL (40~50 ng) DNA模板,1 μL引物混合液,2 μL ddH2O和5 μL 2×Multiple PCR Master Mix (Qiagen)。上述SCAR反应体系的混合物,经过13 000 r/min离心5 min后置于Thermo Fisher Veriti 384型PCR仪上进行DNA扩增。扩增条件如下:95 ℃预变性15 min,94 ℃变性30 s,60 ℃退火90 s,72 ℃延伸60 s,共30个循环,72 ℃完全延伸10 min。扩增产物在2%琼脂糖凝胶上电泳20 min,制作凝胶片和电泳液中均加入1/20 000的SYBR Safe作为显色,并在UVP-GelDoc-It2 315成像仪上观察、拍摄扩增图谱。
1.5 遗传多样性分析
对扩增出来的条带进行计数,对应出现扩增多态位点的用“1”标记,没有的用“0”标记,形成由“0”和“1”组成的MuPS型,绘制矩阵图并转为数据,按照顺序编写出各抗性候选单株的SCAR分子标记图[21],统计每个引物扩增出的位点数和多态位点数。应用Popgene 32软件分析马尾松抗性候选无性系之间的系统关系[22-23],统计有效等位基因数(Ne)、Shannon多样性指数(I)、Nei’s基因多样度(H)。
1.6 马尾松抗松材线虫病候选无性系表型性状调查
2019年12月,对本试验参试的110个马尾松抗性候选无性系第18年的树高和胸径进行调查,测量3个生物学重复。按照平均实验形数法计算无性系单株材积(V),公式为V=(h+3)g1.3fЭ。式中:h为树高,g1.3为胸高断面积,fЭ为平均实验形数,马尾松平均实验形数fЭ为0.4[24]。
1.7 数据分析
试验数据整理使用Excel 2016,采用SPSS 20.0进行单因素方差分析。
2 结果与分析
2.1 引物的有效性和MuPS分型分析
2008年,试验随机选取16个样品,分两次提取针叶DNA,使用同样方法和相同引物组Pmscar-M1和Pmscar-M2扩增。结果显示,同一无性系在两次提取的DNA经MuPS反应获得相同扩增多态性分型(图1)。本试验参试的110个马尾松无性系样品,共获得92个MuPS分型,MuPS分型识别率为83.63%;其中具唯一性MuPS分型码的无性系数有79个,71.81%的无性系被完全准确识别(表2)。而其余31个无性系的MuPS分型情况则较特殊,分成3种情形:其一,涉及20个无性系属于两两结对形成10组,每一组的两无性系共享一个MuPS分型码,即两个无性系的MuPS分型码同型;其二,是3个无性系共享同一个MuPS分型码;其三,是有8个无性系分为2组,每一组均有4个无性系共享一个 MuPS分型。这31个无性系不能为唯一性的MuPS分型码所识别,原因可能比较复杂。

1.休32-4; 2.休31-5; 3.和1-2-5; 4.休8-4; 5.休11-1; 6.休32-4;7.广55-2;8.小3-5; 9.广57-4;10.广56-3;11.广54-1;12.广52-1;13.广33-4;14.广33-5;15.休2-4;16. 小1-5。图1 14对引物对部分马尾松无性系的电泳谱带Fig.1 The electrophoretic patterns of partial clones of P. massoniana with 14 primers
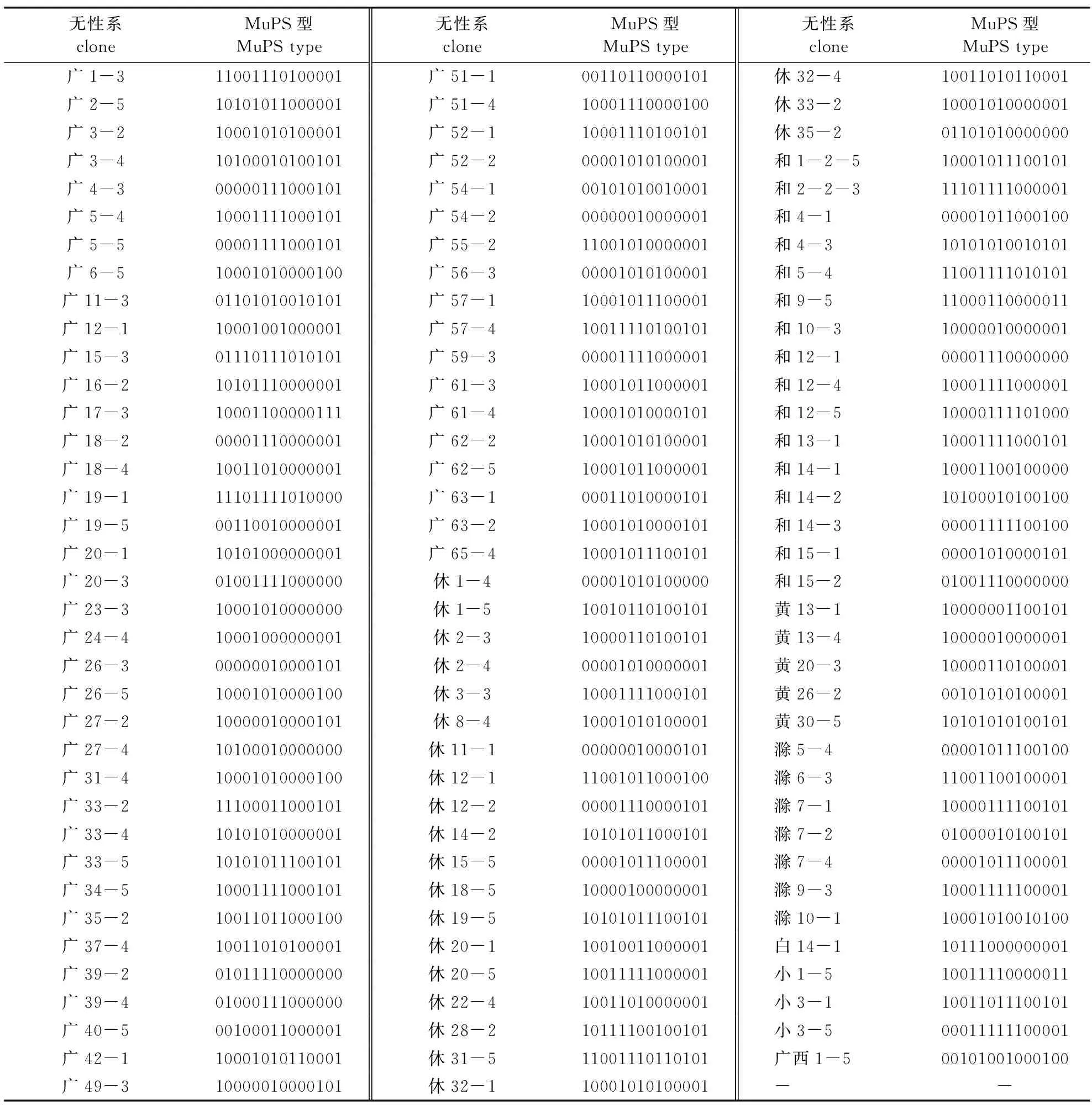
表2 110个马尾松无性系的MuPS型Table 2 The MuPS patterns of 110 clones of P. massoniana
2.2 筛选引物对参试无性系的识别率分析
通过对引物识别能力及多态位点出现率分析可见,本试验筛选的14对引物对识别率变动为0.90%~90.00%,不同引物对于该批马尾松无性系辩识率的差异十分显著。其中,引物053和引物025对区分马尾松的不同无性系有很高的辩识率,分别达到90.00%和78.18%。同时,这两个引物检测到的多态位点出现率也相对较高,分别为16.63%和14.45%,而引物039的识别率和多态位点的检出率均最低(表3)。

表3 不同引物对马尾松无性系的识别率和多态位点检出率Table 3 The percentage of identification and polymorphic sites detected by 14 primers for 110 clones of P. massoniana %
2.3 抗松材线虫病候选无性系遗传多样性分析
利用Popgene 32软件对参试的110个无性系中具有单一MuPS型的79个无性系进行遗传多样性参数分析表明(表4),Ne的最大值为1.998 1,最小值为1.012 8;H的最大值为0.499 5,最小值为0.012 6;I的最大值为0.692 7,最小值为0.038 5。各位点的Ne值均大于I值,且I值均大于H值,但这3个遗传指标在各位点的大小顺序基本一致。所有位点的Ne为1.508 1,H为0.302 3,I为0.459 1。这3个遗传多样性参数均表明,虽然本试验经两轮松材线虫接种筛选,家系数量由251个降到81个,用于群体遗传参数估算的初选无性系(家系内单株)数量也由1 201个降低到79个无性系(具单一的MuPS分型),即仅用了初选无性系中6.5%的无性系(松材线虫接种和自然死亡淘汰了93.5%的无性系)用于遗传多样性分析,结果显示该经松材线虫接种筛选后保留下来的人工群体中仍然具有相对较高的遗传多样性,在未来的马尾松抗松材线虫病育种方面具有潜在的应用价值。
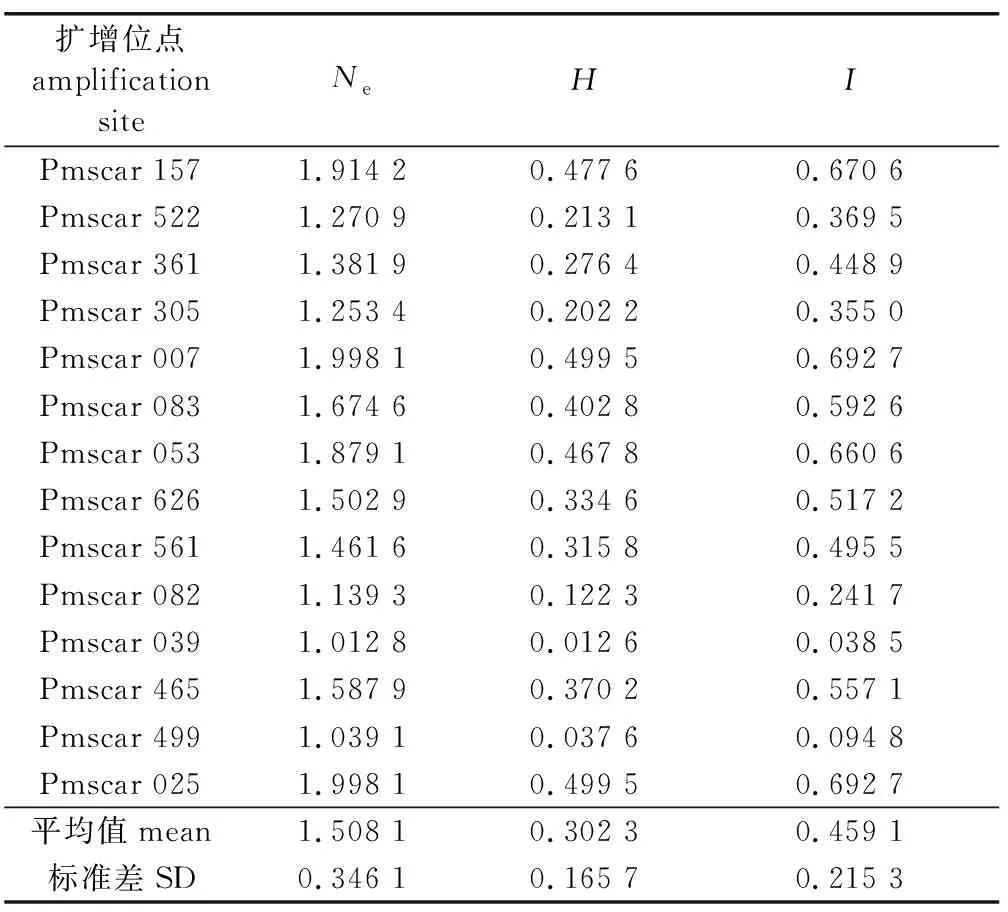
表4 79个马尾松抗松材线虫病候选无性系的遗传多样性分析Table 4 Analysis of genetic diversity of 79 clones of P. massoniana with phenotypic resistant to pine wilt disease
2.4 马尾松抗性候选无性系生长性状和接种松材线虫后的保存率
2019年,对110个马尾松抗性候选无性系的生长和保存率调查结果见表5,方差分析结果如表6所示。结果显示,通过两次松材线虫接种15 a后,110个马尾松抗性候选无性系中保存下来且正常生长的无性系有83个,死亡的无性系有27个,保存率为75.46%。在正常生长的抗性候选无性系间的树高生长变异幅度为4.6~10.7 m,平均树高为6.07 m;胸径生长变异幅度为6.7~21.7 cm,平均胸径为10.63 cm;单株材积的变异幅度为0.012 3~0.189 4 m3,平均值为0.071 8 m3。参试马尾松抗性候选无性系间的树高、胸径和材积生长差异均达到极显著水平,说明保存下来的马尾松抗性候选无性系间,在显示对松材线虫病具有抗性的同时,树高、胸径和材积生长上也存在显著差异。其中,材积生长量排在前10位的无性系分别为休3-3、休20-5、和12-5、和9-5、广34-5、广18-2、广17-3、休2-4、广54-2和广33-5(表5)。本试验中生长量最好的休3-3无性系的单株材积(0.189 3 m3)为材积生长最低无性系广27-2(0.012 3 m3)的15倍以上。这一结果说明,这批资源不仅具有抗松材线虫病的潜在优势,而且还保持了较好的材积生长优势,是马尾松抗松材线虫病育种的重要储备遗传资源。

表5 马尾松抗松材线虫病候选无性系18年生树高、胸径和材积生长情况Table 5 Tree height, DBH and single tree volume growth of 110 clones of P. massoniana with phenotypic resistant to pine wilt disease

表6 马尾松抗松材线虫病候选无性系生长性状方差分析Table 6 Analysis of variance of growth traits in resistant of P. massoniana with phenotypic resistant to pine with disease
3 讨 论
无论是自然选择压力的天然群体,还是经历人工选择压力下形成的人工群体,遗传多样性参数,是林木遗传育种工作者制定育种策略,开展林木遗传改良的重要依据。针对种内不同天然群体或人工群体(不管是由天然群体中选择形成的,还是通过人工杂交创制人工群体)的遗传参数、遗传变异分布格局和变异程度,都是有效开展某一树种,或一个树种中某一特殊性状进行改良,以及更好地开展育种创新研究的重要基础资讯[25]。利用分子遗传标记研究树种内群体的遗传多样性,在松属树种上得到了广泛应用,如云南松(P.yunnanensis)、马尾松、黄山松(P.taiwanensis)、红松(P.koraiensis)、油松(P.tabulaeformis)和樟子松(P.sylvestris)等[26-28]。这些松树天然林群体分子水平遗传变异的特点及其形成原因的分析,以及对种子园构建过程中的遗传增益的影响等研究在松属树种的种质资源收集和保存、种群重建,以及进一步遗传改良策略的制定等方面有发挥了重要作用[29-30]。但有关马尾松的人工选择群体,在多次人工接种松材线虫的人工选择压力下遗传参数的研究的报道不多。
本研究在2000年启动的马尾松抗松材线虫病育种研究基础上,从皖南、皖西和皖中地区低山丘陵马尾松资源集中分布区林分中选择324个优良个体,分系采集种子育苗,最终获得251个家系在圃地进行生长和对松材线虫病抗性测定。结果表明,筛选的14个SCAR标记引物能够较好覆盖马尾松基因组。其中,引物Pmscar 053和引物Pmscar 025对区分马尾松的不同无性系有很高的辩识率,分别达到90.00%和78.18%。同时,这两个引物检测到的多态位点出现率也相对较高,分别为16.63%和14.45%。说明运用SCAR标记的MuPS反应技术体系,对具有抗松材线虫病表型的马尾松无性系进行识别和用于马尾松抗性种子园的建园无性系亲本的管理是可行性。
但是,在采用引物Pmscar 053和引物Pmscar 025引物进行马尾松抗性无性系MuPS分型还存在一些不足,如还有31个抗性无性系不能为唯一的MuPS分型所识别。分别存在2个或3个甚至是4个无性系共享同一种MuPS分型的情况。除了使用的引物数量,组成入选材料的原群体遗传结构(如同胞亲缘关系或近交率),也会影响分子标记分型的识别率和不同无性系的检出率。本研究的10组两两共享一个MuPS分型码的(20个)无性系中,有一组MuPS同型无性系广62-5和广62-3,均是从家系广62中选出的(有半同胞亲缘关系);另有3组两两共享1个MuPS分型的6个无性系(广63-2和广61-4、广49-3和广27-2、广56-3和广52-2),以及3个无性系(广6-5、广31-4和广26-5)共享同一MuPS分型的组中的无性系均来组广德种源区;在4个无性系共享一个 MuPS分型的2组无性系中(组1为休8-4、休32-1、广5-4和广34-5;组2为休8-4、休32-1、广62-2和广3-2),来自休宁和广德种源区的各占一半。这些数据显示,谱系关系或自然群体内的近交率(或自交)引起的亲缘关系改变,在使用引物较少时会导致遗传多态性位点的检出率和无性系分型的识别率降低。因此,无论试样材料的群体遗传结构怎样变化,适当增加SCAR扩增引物的数量,提高分子标记多态性位点的检出率和无性系的识别率,对于提高马尾松抗性种子园亲本的遗传多样性、降低种子园自(近)交率等核心技术管理水平,都是有益的。
值得指出的是,本研究揭示的马尾松人工选择群体在两轮接种松材线虫的选择压力下遗传多样性主要参数的动态变化信息,是具有重要参考价值。虽然由于接种松材线虫致死和不明原因的自然死亡等因素,初选无性系的原始群体的遗传信息无法系统追踪和进行纵向比较。但通过报道的同类研究结果横向比较[31-32],可以发现本研究结果中蕴含的重要信息。初选材料经两次松材线虫接种试验抗性筛选,家系数量由251个减少到81个,初选无性系(家系内单株)数量也由1 201个降低到79个MuPS分型确切识别的无性系。参与遗传多样性分析的79个无性系仅占初选无性系的6.5%(即松材线虫接种和自然死亡淘汰了93.5%的初选无性系),但其遗传多样性参数(Ne=1.508 1,H=0.302 3,I=0.459 1),仍高于陈雪莲[33]、朱必凤等[34]和张恒庆等[35]报道的黄山松抗性候选个体、马尾松种子园和红松人工林群体的遗传参数水平。这说明,本研究从皖南、皖西和皖中马尾松主要栽培区选择的优良个体培育成的家系后代群体,经接种松材线虫逆境胁迫保留下来的无性系人工群体,仍然保留了相对较高的遗传多样性。同时,本研究在初选材料接种松材线虫进行抗性筛选15年后进行无性系生长量和保存率调查表明,经110个候选材料二次接种松材线虫筛选保存下来的83个无性系间,树高、胸径和单株材积生长性状上均达到极显著差异水平。其中,生长量最高的无性系休3-3的单株立木材积(0.189 3 m3)超过材积生长最小的无性系广27-2(0.012 3 m3)的15倍以上。结果说明,这批经松材线虫接种筛选成活下来的马尾松无性系,不仅是抗松材线虫病育种的重要基因资源,而且也可能是抗松材线虫病和材积生长两个性状得到联合改良有潜力的宝贵遗传资源,值得在马尾松抗松材线虫病种质创新和新品种培育中加以深入研究和开发利用。
