白桦BpGRAS1基因的克隆及耐盐功能分析
2021-10-10及晓宇贺子航王智博田增智
张 群,及晓宇,贺子航,王智博,田增智,王 超
(林木遗传育种国家重点实验室(东北林业大学),黑龙江 哈尔滨 150040)
盐胁迫是不利于植物生长和发育的主要非生物胁迫之一,处于逆境中的植物其生长发育会受到不同程度的影响,严重时甚至导致植物死亡。为了减少这些条件的不利影响,植物已经进化出多方面的策略,包括形态、生理和生化适应。在对各种非生物胁迫的响应和适应过程中,诱导了许多与胁迫相关的基因,并且积累了多种与胁迫抗性相关的功能蛋白[1]。因此,了解盐胁迫响应的生物分子基础和耐受机制对于植物耐盐和基因工程育种非常重要[2]。
GRAS蛋白是植物转录因子(transcription factor,TF)的一个重要家族,GRAS 家族的名字源于3个最初发现分离出来的成员 GAI [GA (GIBBERELLIC ACID)INSENSITIVE]、RGA(REPRESSOROFGAI)和SCR(SCARECROW)[3]。GRAS在调控植物生长、发育和胁迫反应中发挥重要作用。该蛋白一般由400~800个氨基酸残基组成,其C端高度保守,N端为高度变异区,该蛋白家族的成员具有其特有的GRAS 结构域,该结构与植物的抗逆机制有着密切的联系,其中部分成员还具有 DELLA 蛋白结构[4]。DELLA蛋白不仅是纵向根系生长抑制因子,而且还是皮层径向细胞扩张的积极调节因子[5],在调控植物根冠发育中发挥着极其重要的作用,可以提高植物对非生物胁迫的抗性[6]。研究表明,GRAS转录因子参与了植物生长发育及形态建成(如赤霉素信号转导[7]、根的发育[8]、分生组织的形成[9]),以及植物抗病性[10]和非生物胁迫反应[11]。
近些年来陆续有不同植物种的GRAS转录因子家族被鉴定出来,GRAS家族全基因组分析显示:梅花(Armeniacamume)中有46个GRAS基因[12],白菜(Brassicapekinensis)中有48个[13],杨树(Populusspp.)中有106个[14],葡萄(Vitisvinifera)中有52个[11];甘蓝型油菜(Brassicanapus)基因组中87个GRAS基因分属13个亚家族,有24个BnGRAS基因在根部高特异性表达[15];番茄(Lycopersiconesculentum)中有53个GRAS家族成员[16];水稻(Oryzasativa)中至少有57个GRAS基因[17];SHR也是一种GRAS转录因子,在毛果杨(Populustrichocarpa)中鉴定出3个SHR样基因[18],在茶树(Camelliasinensis)中鉴定出52个编码GRAS蛋白的CsGRAS基因[19]。目前已经发现和鉴定了多种非生物胁迫应答的GRAS转录因子。
此外,通过各种分子生物学实验也证实了GRAS转录因子在植物抗逆方面的调控作用。BrLAS编码一种干旱反应型GRAS转录因子,BrLAS主要参与ABA介导的信号传导途径,其过表达的拟南芥(Arabidopsisthaliana)在营养生长期和生殖生长期表现出对外源ABA的超敏和多效性,对植物的耐旱性有积极的调节作用[20]。山葡萄(Vitisamurensis)PAT1作为一个受胁迫诱导的GRAS基因,通过调控一系列抗逆相关基因的表达,增强了过表达转基因拟南芥的耐寒、耐旱和耐盐能力[21]。OsGRAS23过表达水稻表现出极高的抗旱性和抗氧化性[17]。SlGRAS40能够调控西红柿的抗旱、耐盐能力,通过调节叶片的气孔缩小,从而保留了更多的水分[22]。JrGRAS能够特异性结合Dof元件,以改善JrGRAS的高温应激反应,在一定程度上控制了HSPs的表达,提高核桃耐高温能力[23]。GRAS基因在铁皮石斛(Dendrobiumcatenatum)的不同组织中广泛分布并表达,通过鉴定发现有8个基因经受高温和盐胁迫后在不同组织中表达上调[24]。利用大麦条纹花叶病毒(BSMV)诱导小麦(Triticumaestivum)TaSCL14基因沉默(VIGS),发现TaSCL14的沉默导致植株生长受到抑制,光合能力下降,对光氧化胁迫的耐受性降低[25]。以上研究仅仅鉴定出GRAS对非生物胁迫有响应,对其抗逆调控机制研究较少。在拟南芥、水稻的全基因组分析较为透彻,且多为某一亚族分支的相关性研究为主。
白桦(Betulaplatyphylla) 在我国东北地区广泛分布,因其对环境适应能力强、生长迅速,具有重要的生态、观赏和应用价值等特点被列为国家科技计划研究的重要树种之一,因此研究其响应非生物胁迫的生物分子基础和耐受机制具有重要意义[26]。目前,关于白桦响应盐胁迫的分子机制及耐盐白桦分子育种开展了一些研究,BpmiR156基因过表达白桦株系与对照株系相比,在盐胁迫后盐害指数增加、生长速度变慢、膜系统损伤更严重,在一定程度上降低了白桦的耐盐性[27]。而外源TabZIP的表达能够提高TB4转基因白桦株系的耐盐能力[28]。张宇等[29]研究发现过表达BpMYB4 能使白桦超氧比物歧化酶(SOD)的活性增加,消除植株体内新陈代谢过程中产生的有害物质,进而提高白桦抵御低温的能力。关于白桦GRAS家族全面的生物信息学分析以及逆境胁迫相关性研究还鲜见报道。本研究通过白桦转录组数据,鉴定出一条响应盐胁迫的GRAS转录因子基因,将其命名为BpGRAS1。对BpGRAS1在盐胁迫下的表达水平及其耐盐功能进行分析,以期为研究木本植物中GRAS转录因子的抗逆分子机制提供基础理论数据。
1 材料与方法
1.1 试验材料
白桦无性系组培苗由东北林业大学林木遗传育种国家重点实验室保存。组培苗培养条件:温度为25 ℃,光周期为12 h光照/12 h黑暗。
大肠杆菌(Escherichiacoli) Top10、根癌农杆菌 (Agrobacteriumtumefaciens) EHA105、植物表达载体pROKⅡ、pFGC5941 由东北林业大学林木遗传育种国家重点实验室保存。
1.2 BpGRAS1基因的克隆
取4周苗龄白桦幼苗,使用植物总RNA提取试剂盒(百泰克生物技术有限公司,北京)提取白桦的总RNA,并利用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMIX(全式金生物技术有限公司,北京)反转录试剂盒合成第 1 链 cDNA,作为模板为后续实验备用[30]。
通过白桦盐胁迫转录组数据分析筛选获得1条差异表达的GRAS基因,命名为BpGRAS1(GenBank number: MN117546.1)。根据基因序列设计引物BpGRAS1-F 和BpGRAS1-R(表1),以白桦cDNA为模板克隆BpGRAS1基因。
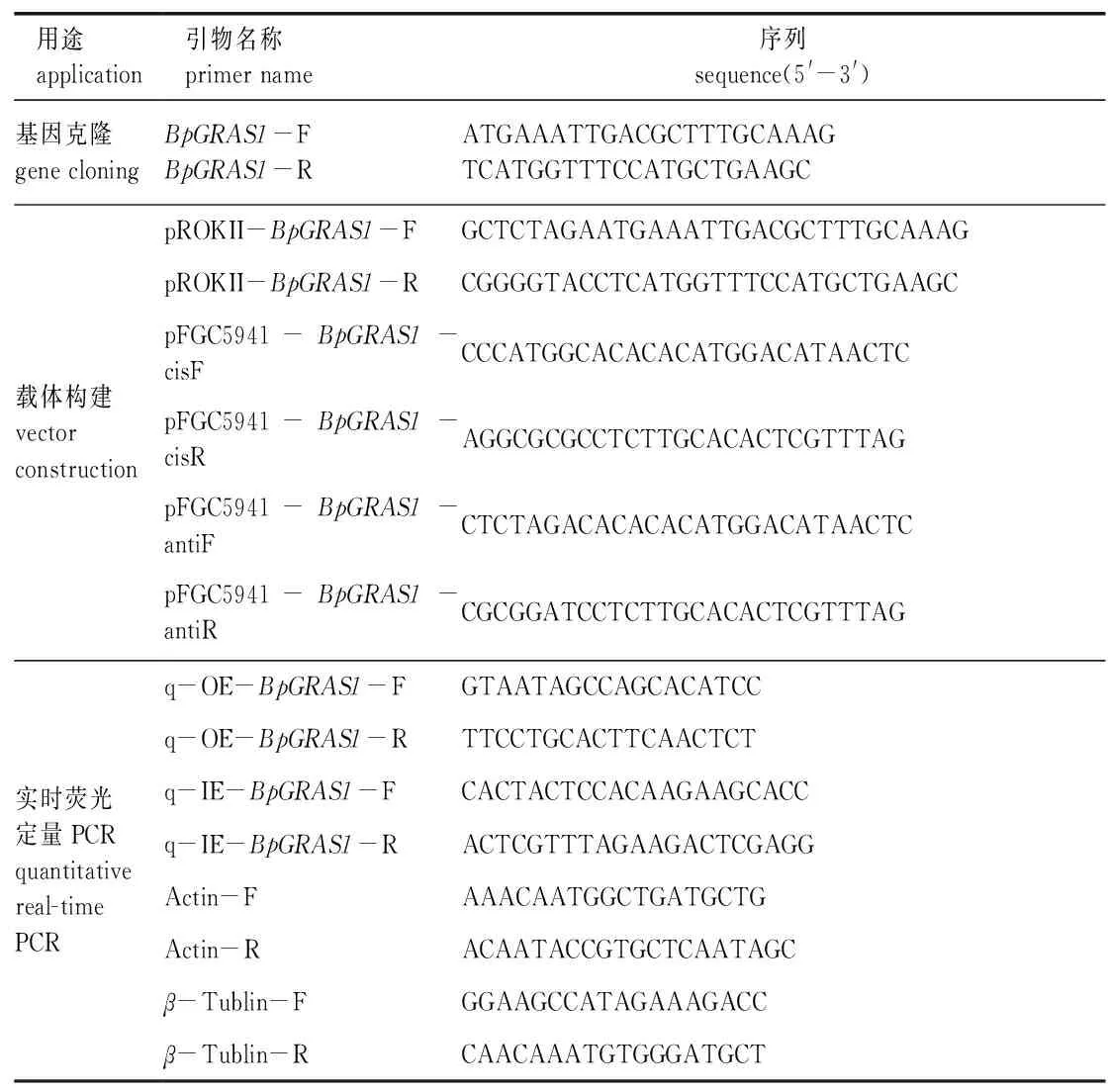
表1 试验所用引物Table 1 Primers used in this study
1.3 多序列比对及系统进化树分析
通过NCBI(https://www.ncbi.nlm.nih.gov/)网站,获得8个不同物种的GRAS序列数据,利用DNAMAN软件进行多序列比对分析。将6条辐射松(Pinusradiata)GRAS蛋白序列、20条毛果杨GRAS蛋白序列、在Tair (https://www.arabidopsis.org/) 网站上获得的拟南芥32条 GRAS 家族序列数据与白桦基因组中获得的40条白桦GRAS家族蛋白序列,用 MEGA6. 0构建系统进化树。
1.4 pROKⅡ-BpGRAS1过表达载体的构建
根据BpGRAS1序列分别设计引物pROKⅡ-BpGRAS1-F和pROKⅡ-BpGRAS1-R(表1),引入XbaI 和KpnI 酶切位点,以白桦 cDNA 为模板进行 PCR 扩增,用XbaI和KpnI 对pROKⅡ质粒和纯化的BpGRAS1基因进行双酶切,将BpGRAS1连接到pROKⅡ载体上转化大肠杆菌,以单克隆菌落为模板,使用pROKⅡ载体引物进行菌落PCR,挑取条带长度正确的菌落摇菌并进行测序验证。提取测序正确的重组pROKⅡ-BpGRAS1载体质粒,将其转化为农杆菌 EHA105 感受态,保存菌种备用。
1.5 pFGC5941-BpGRAS1抑制表达载体的构建
根据BpGRAS1序列分别引入NcoI 和AscI 酶切位点设计引物 pFGC5941-BpGRAS1-cis-F 和 pFGC5941-BpGRAS1-cis-R (表1),以白桦 cDNA 为模板,通过PCR 扩增获得BpGRAS1 cis端干扰片段,利用NcoI和AscI对 pFGC5941 载体质粒以及纯化后的BpGRAS1基因片段进行双酶切,将BpGRAS1cis端干扰片段正向连接到线性化的pFGC5941 载体上。通过转化大肠杆菌获得单克隆菌落,以单克隆菌落为模板,使用cis端载体引物进行菌落PCR检测。将条带长度正确的菌落摇菌送测序,经测序比对正确后提取重组载体质粒,将其命名为 pFGC5941-BpGRAS1-cis。通过引入XbaI 和BamHI 酶切位点分别设计引物 pFGC5941-BpGRAS1-anti-F 和 pFGC5941-BpGRAS1-anti-R。依照上述方法将BpGRAS1anti端干扰片段反向构建到 pFGC5941-BpGRAS1-cis 载体上。测序验证重组载体质粒,并命名为 pFGC5941-BpGRAS1,转化农杆菌 EHA105 感受态,保存菌种备用[30]。
1.6 BpGRAS1基因瞬时表达白桦的获得及胁迫处理
将pROKⅡ-BpGRAS1-EHA105、pFGC5941-BpGRAS1-EHA105 和 pROKⅡ-EHA105 按照农杆菌介导的高效瞬时转化系统[31]瞬时侵染培养4周大小的白桦组培苗,获得BpGRAS1基因瞬时过表达(OE)、抑制表达(IE) 及转空载体对照(WT) 植株。BpGRAS1基因瞬时过表达、抑制表达及对照白桦植株在1/2 MS 培养基中培养48 h后,将部分植株移至含有 150 mmol/L NaCl 的 1/2 MS 培养基中再进行胁迫处理 24 h。
1.7 BpGRAS1基因瞬时转化白桦植株的实时荧光定量PCR检测
为验证BpGRAS1基因在瞬时表达白桦植株中的表达情况,分别提取盐胁迫及非胁迫下过表达、抑制表达及对照白桦植株的总RNA(同生理指标分析为同一批材料),并反转录为cDNA,每20 μL体积反应混合物包括10 μL SYBR Green实时PCR预混液(Toyobo,日本),2 μL cDNA模板(100 ng)和0.5 μL特异性引物(10 μmol/L)。使用以下反应步骤进行扩增:预变性94 ℃ 30 s,然后再变性94 ℃ 12 s,退火58 ℃ 30 s,延伸72 ℃ 45 s进行45个循环,82 ℃读板1 s。使用qTOWER3PCR仪(Analytik Jena AG,德国耶拿)进行qRT-PCR,选取白桦Actin和β-tubulin为内参基因[32],引物序列见表1,进行了3次独立的试验。基因表达量分析采用2-△△Ct法[33]。
1.8 BpGRAS1基因瞬时表达白桦的抗逆生理指标分析
分别测定盐胁迫处理(150 mmol/L)及水处理(对照)中过表达、抑制表达及转空载体对照各植株内的电解质渗透率、失水率(分别在盐胁迫处理24 h结束后测定0. 5、1、1. 5、2、3、4 h 时的失水率)、丙二醛(MDA)含量、过氧化物酶(POD) 及超氧化物歧化酶(SOD) 活性,测定方法与算法详见文献[34]。每种测定每种处理3次重复,每次重复3棵植株。
1.9 数据处理
为避免试验误差,保证数据准确性,所有试验均进行3次生物学重复。数据用SPSS 21.0进行分析处理,采用Tukey法[34]来判断差异显著性。
2 结果与分析
2.1 BpGRAS1保守序列鉴定及其系统进化分析
本研究前期分别以盐胁迫及水浇灌处理不同时间(3、6、12、24和48 h)白桦为材料构建转录组,经DEG分析,获得了17个响应盐胁迫的GRAS转录因子,选择其中表达差异最显著的基因BpGRAS1进行后续实验。BpGRAS1基因的开放阅读框为1 425 bp,编码474个氨基酸。在NCBI网站上对BpGRAS1cDNA编码的氨基酸序列进行同源性BLAST搜索,发现该序列与川黔千金榆(Carpinusfangiana)的相似性最高,为87.31%。对BpGRAS1与其他8个物种的 GRAS 蛋白相似性进行保守序列分析,结果显示:BpGRAS1具有GRAS家族的序列特征,在C端的氨基酸序列相似度较高(图1)。由40条白桦GRAS蛋白与32条拟南芥GRAS蛋白、6条辐射松GRAS蛋白、20条毛果杨GRAS蛋白构成的进化树分析结果显示,可分为8个亚家族,BpGRAS1与AtSHR蛋白质序列亲缘关系较近,同属于Ⅳ亚家族(图2)。

JrGRAS.胡桃Juglans regia(XP_018813105.1);PaGRAS.欧洲甜樱桃Prunus avium(XP_021825482.1);CfGRAS.川黔千金榆Carpinus fangiana(KAE8076562.1); ZjGRAS.枣Ziziphus jujuba(XP_015886865.1);QsGRAS.欧洲栓皮栎Quercus suber (XP_023909161.1);MdGRAS.苹果Malus domestica(XP_008369183.2); HuGRAS.哥伦比亚锦葵Herrania umbratica (XP_021290978.1);EgGRAS.大叶桉Eucalyptus grandis (XP_010047409.1)。图1 不同物种GRAS蛋白多序列比对Fig.1 Multiple alignment of GRAS proteins from different species

图2 GRAS系统进化树分析Fig.2 Phylogenetic tree analysis of GRAS
2.2 瞬时转化植株的获得
对植物表达载体pROKⅡ-BpGRAS1进行检测,结果显示目标条带正确扩增,载体构建成功(图3A)。对植物表达载体pFGC5941-BpGRAS1进行检测,结果显示,抑制表达载体构建成功(图3B)。最终通过测序分析比对,分别保存菌种备用。
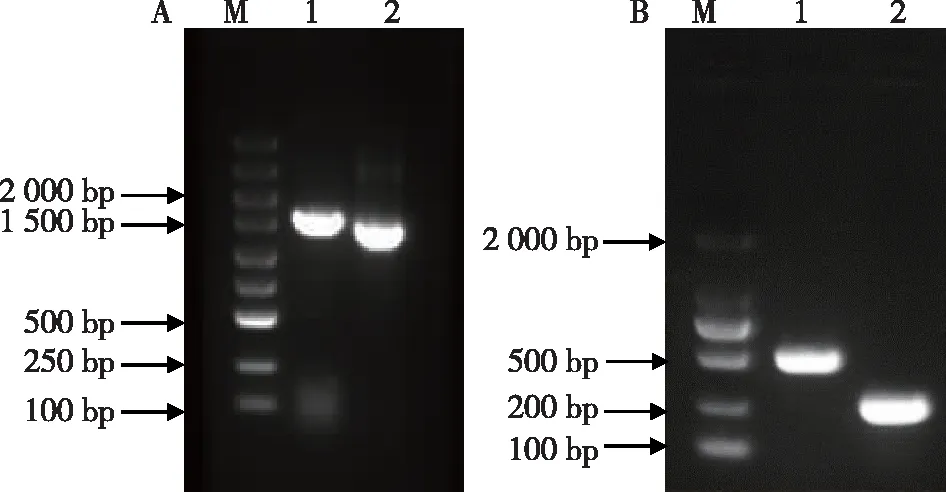
A: M. DL5000 Marker; 1. pROKⅡ载体引物单菌落PCR产物 PCR product of pROKⅡ vector primer single colony; 2. 基因引物巢式PCR产物PCR product of gene primer nested. B: M. DL2000 Marker; 1. pFGC5941cis端载体引物单菌落PCR产物PCR product of pFGC5941 cis end vector primer single colony; 2. cis端基因引物巢式PCR产物Nested PCR products of cis end gene primer。 图3 植物表达载体pROKⅡ-BpGRAS1及pFGC5941- BpGRAS1的构建Fig.3 Construction of plant expression vector pROKⅡ-BpGRAS1 and pFGC5941- BpGRAS1
通过农杆菌介导的高效瞬时转化系统,获得BpGRAS1基因瞬时过表达(OE)、抑制表达(IE) 及对照(WT) 植株。
2.3 BpGRAS1基因瞬时转化白桦植株的实时荧光定量PCR检测结果
对3种植株进行盐胁迫处理后,实时荧光定量PCR分析结果显示,在正常条件下,过表达转基因植株中BpGRAS1的表达量最高,抑制表达植株中表达量最低。盐胁迫处理后,pROKⅡ-BpGRAS1-EHA105植株表达量最高,pFGC5941-BpGRAS1-EHA105表达量最低,并且过表达植株中的表达量高于非胁迫处理,抑制表达植株中的表达量低于对照(图4)。以上结果证实已经获得了BpGRAS1过表达和抑制表达瞬时转化白桦植株,可用于后续试验。

*.P<0.05。下同。The same below.图4 BpGRAS1基因瞬时转化白桦植株qRT-PCR检测Fig.4 qRT-PCR detection of B. platyphylla transiently transformed with BpGRAS1 gene
2.4 BpGRAS1基因瞬时表达及对照白桦植株电解质渗透率、失水率及丙二醛含量分析
对转化植株及野生型对照盐胁迫下的电解质渗透率测定结果表明:非胁迫条件下,OE、IE和WT植株的相对电导率基本一致;盐胁迫处理后,WT及IE植株的相对电导率数值显著高于OE植株,且IE植株的电解质渗透率数值最高。该结果说明在白桦中过表达BpGRAS1基因可以降低白桦在盐胁迫下的电解质渗透率,从而保护植物细胞膜结构完整性(图5A)。
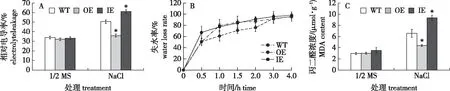
图5 盐胁迫下瞬时过表达、抑制表达及对照白桦植株电解质渗透率、失水率及MDA含量分析Fig.5 Analysis of electrolyte permeability, water loss rate and MDA content of B. platyphylla plant transiently OE, IE and WT under salt stress
瞬时表达以及对照组白桦叶片(3次重复)失水率测定结果显示:在0.5 h之内抑制表达的失水率高于对照组及过表达植株;在1~3 h内,抑制表达植株与对照组白桦的失水率远远高于过表达植株的失水率;在3~4 h内,过表达植株的失水率仍最低。结果表明,BpGRAS1基因的过表达可以降低植物在盐胁迫下的失水率,从而增加白桦的抗逆功能(图5B)。
OE、IE以及WT白桦叶片(3次重复)MDA含量测定结果显示:1/2 MS培养条件下,OE、IE植株和WT白桦植株的MDA含量基本一致;但在盐胁迫条件下,OE植株的 MDA 含量为最低,IE植株的MDA 含量最高。由此说明BpGRAS1基因的过表达可以显著降低白桦在盐胁迫条件下 MDA 含量的积累,进而增强其抗逆能力(图5C)。
2.5 BpGRAS1基因瞬时表达及对照白桦植株POD、SOD酶活分析
对转化植株及野生型对照盐胁迫下的POD及SOD酶活性测定结果(图6)表明,在正常生长条件下,BpGRAS1基因过表达及对照植株的 POD 活性略高于抑制表达植株的POD值;在盐胁迫条件下,BpGRAS1基因过表达植株的 POD活性明显高于对照及抑制表达植株。同样在盐胁迫条件下,OE植株的 SOD的活性明显高于WT及IE植株。该结果表明BpGRAS1基因的过表达增强了 POD 和 SOD 的活性,增强其清除溶液中产生的过氧自由活性基团的能力,进而提高了白桦的耐盐能力。

图6 盐胁迫下瞬时OE、IE及WT白桦植株POD、SOD活性分析Fig.6 Analysis of POD and SOD activities in transient OE, IE and WT B. platyphylla under salt stress
3 讨 论
转录因子在植物抵抗非生物胁迫中具有重要作用,发掘抗非生物胁迫相关转录因子,研究其抗逆分子机制,能够为林木抗逆分子改良提供重要数据和材料。已有研究显示,GRAS转录因子参与植物抵抗非生物胁迫[17,20-24]。本研究前期,在白桦盐胁迫转录组数据分析中发现,GRAS基因响应盐胁迫的诱导,从中筛选上调表达倍数最高的1条GRAS基因,对其进行克隆,命名为BpGRAS1。利用生物信息学工具将其与其他8种植物的GRAS蛋白进行多序列比对,多序列比对结果显示:BpGRAS1在C端的氨基酸序列相似度比较高,具有GRAS家族的序列特征[35],说明该保守区对GRAS基因家族功能具有重要作用。为了进一步分析该基因的潜在抗逆功能,将其蛋白序列与拟南芥32个GRAS蛋白、6个辐射松GRAS蛋白、20个毛果杨GRAS蛋白以及40个白桦GRAS蛋白进行进化树分析,结果显示,BpGRAS1与AtSHR蛋白亲缘关系较近,同属于Ⅳ亚家族。Yuan[36]研究发现SHR在盐诱导的幼苗发育抑制中发挥重要作用。因此推测BpGRAS1在白桦中具有一定的耐盐功能。
为了验证BpGRAS1基因耐盐功能,分析耐盐响应的生理生化变化,分别构建植物过表达(pROKⅡ-BpGRAS1) 及抑制表达(pFGC5941-BpGRAS1) 载体,通过农杆菌介导的高效瞬时遗传转化系统获得了BpGRAS1基因瞬时OE、IE及WT白桦植株。qRT-PCR 结果发现:BpGRAS1基因的表达量在OE植株中显著上升,在IE植株中显著下降,证明在上述试验中获得的瞬时表达白桦植株可用于后续抗逆功能获得或缺失的研究。
细胞膜对维持细胞的微环境和正常的代谢起着重要的作用。植物组织在受到各种非生物胁迫时,细胞膜透性增大,电解质外渗,因此电解质渗透率是判定细胞受损的一个重要生理指标[37]。在逆境生长条件下失水率是衡量植物抗逆能力的重要的生理指标之一,植物抗逆能力越强,失水率越低[38]。在植物衰老生理和抗性生理研究中丙二醛 (MDA) 含量是一个常用指标。在经历衰老、凋亡或逆境条件下,植物通常发生膜脂过氧化作用,其最终分解产物MDA含量越高说明植物所遭受逆境伤害越大[39]。为此,本研究分别对胁迫条件下BpGRAS1基因过表达、抑制表达及对照白桦植株的抗逆生理指标进行了测定。结果表明,过表达BpGRAS1基因可以降低白桦在盐胁迫下的电解质渗透率、失水率及MDA含量,说明BpGRAS1基因能够保护细胞膜,避免膜损伤,具有一定的抗非生物胁迫功能。
研究表明VaPAT1、SlGRAS40等基因的表达能够通过提高保护酶活性增强植物对干旱和盐的抗性[21-22]。为了分析BpGRAS1基因提高转基因白桦耐盐性的作用机制,对盐胁迫下OE、IE及WT植株的POD、SOD 酶活性进行测定,结果发现过表达植株的POD、SOD 活性显著高于对照和抑制表达植株。由此推断盐胁迫后BpGRAS1基因的表达能够调控与POD、SOD 相关基因的表达,通过增加 POD 和 SOD 的活性进而提高白桦的耐盐能力。
综上所述,本研究利用PCR技术克隆白桦BpGRAS1基因,其开放阅读框为1 425 bp,编码474个氨基酸。BpGRAS1转录因子具有 1 个保守的C端 DNA 结合结构域,并具有GRAS家族的序列特征。BpGRAS1与AtSHR 蛋白的亲缘关系较近,同属于Ⅳ亚家族。盐胁迫下过表达BpGRAS1基因通过增强 POD 和 SOD 活性减少细胞受损或死亡,从而提高白桦的耐盐能力。在后续的研究中,将对BpGRAS1调控的靶基因及靶基因调控的抗逆生理学途径进行系统的研究,拟为研究白桦GRAS转录因子的抗逆调控机制奠定理论基础。
