血清N-MID在原发性肺癌患者骨转移辅助诊断和疗效监测中的应用分析
2021-10-10卢仁泉孙佳俊
陆 立,卢仁泉,孙佳俊,陆 凝,郭 林
复旦大学附属肿瘤医院检验科,复旦大学上海医学院肿瘤学系,上海 200032
原发性肺癌是中国常见的恶性肿瘤之一,发病率和死亡率均位居各类癌症首位,其发病隐匿,约50%的患者确诊时为晚期[1-2]。骨骼是肺癌主要的转移部位之一,首诊肺癌晚期患者中骨转移发生率为30%~40%,其中80%以上位于躯干骨中,包括脊柱、肋骨和骨盆[3-5]。骨转移往往预示着患者的生存期缩短,其引起的严重骨痛、病理性骨折、脊髓压迫综合征等骨相关事件(skeletal-related events,SRE)及相关治疗带来的痛苦,严重影响患者的生活质量[6]。临床数据表明,肺癌合并骨转移患者在发生首次SRE后,中位生存时间仅为4.1个月[7]。因此,如何早期诊断骨转移,进行疗效的监测评估,对延长肺癌患者的生存期及改善预后意义重大。目前,骨转移的诊断主要依赖影像学检查,如发射型计算机体层成像(emission computed tomography,ECT)和正电子发射计算机体层显像(positron emission tomography and computed tomography,PET/CT)检查等。这些检查部分存在特异度较低、易出现假阳性结果、价格相对昂贵、难以反复检查等缺点[8-9]。而临床常用的肿瘤标志物,如癌胚抗原(carcinoembryonic antigen,CEA)、神经元特异性烯醇化酶(neuronspecific enolase,NSE)、细胞角蛋白19片段(cytokeratin 19 fragment,CYFRA21-1)等,主要用于肺癌患者的鉴别诊断。有研究[10-11]表明,上述肿瘤标志物也可应用于肿瘤分期、疗效判断和预后评估,但并未证实其与骨转移相关。
肺癌骨转移的病理学基础主要是肿瘤细胞与破骨细胞及成骨细胞间的相互作用,肿瘤细胞释放的可溶性介质能够激活破骨细胞和成骨细胞,而破骨细胞释放的细胞因子又能进一步促进前者释放介质,从而形成恶性循环,破坏正常骨组织中骨吸收与骨形成的动态平衡[12-13]。骨代谢紊乱使得骨代谢指标发生变化。已有相关研究[14-16]表明,检测血清中骨代谢指标的表达水平对肺癌骨转移的诊断和监测具有潜在价值。本研究对231例原发性肺癌患者及69名健康体检者的N端中分子片段(N-terminal mid-frament,N-MID)表达水平进行测定,探索其在临床应用中的价值。
1 资料和方法
1.1 一般资料
选取2017年3月—2018年2月复旦大学附属肿瘤医院收治的原发性肺癌患者231例,中位年龄61岁(21~82岁),其中97例为肺癌合并骨转移的患者,134例为未骨转移的肺癌患者。肺癌的确诊以活检或组织细胞学检查结果为准,骨转移的确诊以ECT或PET/CT检查结果为准[17-19]。选取69名同期健康体检者作为健康对照组,中位年龄60岁(22~87岁),所有健康体检者均无影响骨代谢的相关疾病。3组人群的基本资料见表1,各组的性别、年龄间差异无统计学意义(P>0.05)。本研究通过复旦大学附属肿瘤医院伦理委员会审查,所有患者均由本人或家属签署知情同意书。
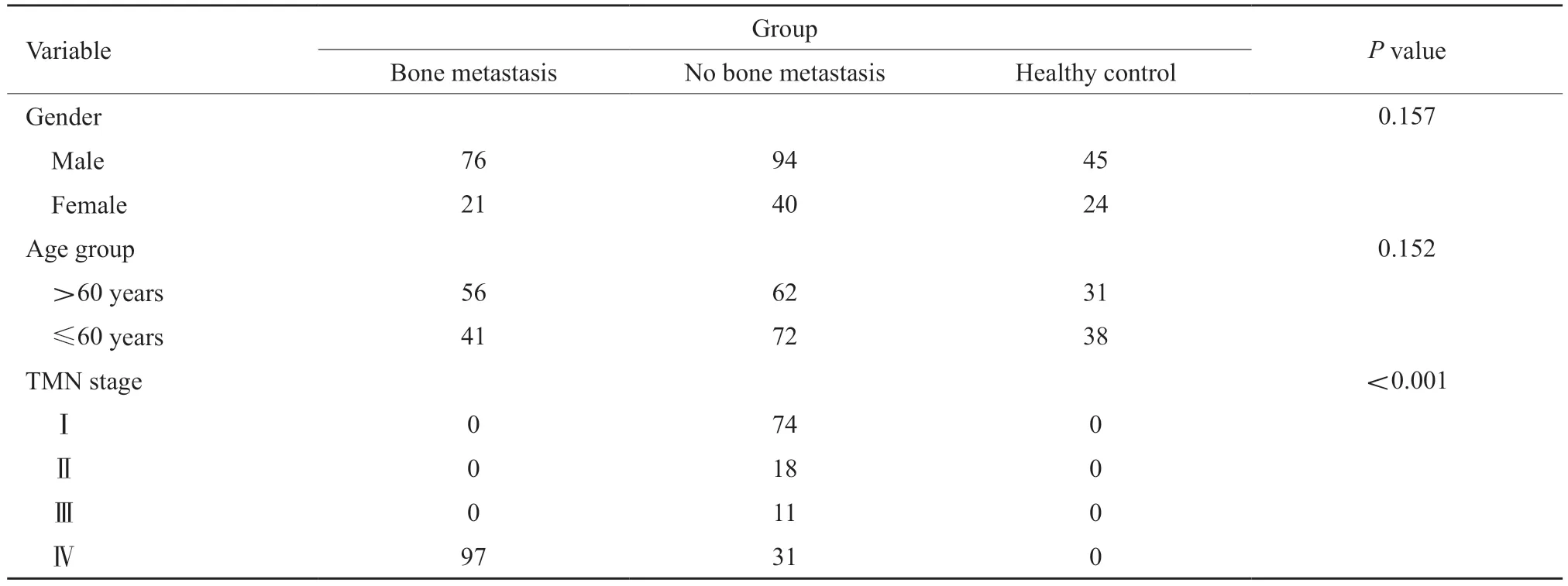
表1 研究人群一般资料比较Tab.1 General information of study population(n)
1.2 入组与排除标准
入组标准:所有肺癌患者均为未经治疗的初发患者;Karnofsky评分(Karnofsky performance score,KPS)≥70分[18]。排除标准:患有骨代谢性疾病;有风湿性关节炎或骨关节炎病史;患有骨质疏松、甲状腺功能亢进,或由甲状旁腺功能亢进和皮质醇增多症等引起的继发性骨质疏松;合并严重的基础疾病。
1.3 标本采集与检测方法
采集患者及健康体检者静脉血3~4 mL,以4000 r/min的速度离心10 min,取上层血清,立即检测或置于-80 ℃冰箱内冻存,1周内检测。血清N-MID水平测定采用嘉兴行健生物科技有限公司的N-MID测定试剂盒(酶联免疫法)。将校准品、质控品和待测样品加入链霉亲和素包被的微孔板中,随后加入生物素标记的N-MID抗体和辣根过氧化物酶(horseradish peroxidase,HRP)标记的N-MID抗体混合物,进行温育形成“双抗体夹心”结构。洗涤后加入HRP基质溶液,再次温育。微孔板内壁的免疫复合体的酶活性与血清N-MID的浓度成正比。加入终止液后,使用酶标仪在450 nm处测定吸光度(D)值。血清CEA、NSE、CYFRA21-1水平测定采用瑞士Roche公司的cobas8000-e801自动化学发光免疫分析仪。血清碱性磷酸酶(alkaline phosphatase,ALP)、血清钙(calcium,Ca)水平测定采用瑞士Roche公司的cobas8000-c702全自动生化分析仪。
1.4 随访
研究截止时间为2021年1月,随访终点为研究截止时间、患者骨转移病灶发生进展或患者死亡,所有患者均采用含铂双药联合化疗,同时联合唑来膦酸治疗。记录患者的无进展生存期(progression-free survival,PFS)[19]。另检测50例肺癌合并骨转移患者治疗3、6个月后的血清N-MID水平。
1.5 统计学处理
采用SPSS 23.0软件进行统计分析。计量资料以表示,采用单因素方差分析进行3组间差异比较,方差分析有意义则采用LSD-t检验进行组间两两比较。计数资料以率表示,采用χ2检验和Fisher精确概率法进行各组间率的比较。采用logistic回归模型分析肺癌患者发生骨转移的危险因素。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估N-MID对肺癌患者骨转移的诊断价值。采用Kaplan-Meier法绘制生存曲线,比较采用log-rank检验。采用重复资料方差分析比较肺癌合并骨转移患者治疗期间血清N-MID水平的变化差异。P<0.05为差异有统计学意义。
2 结果
2.1 3组研究人群治疗前血清N-MID表达水平比较
治疗前骨转移组的肺癌患者血清N-MID水平明显高于无骨转移组和健康对照组(P均<0.001)。而无骨转移组与健康对照组间N-MID水平差异无统计学意义(P>0.05,图1)。
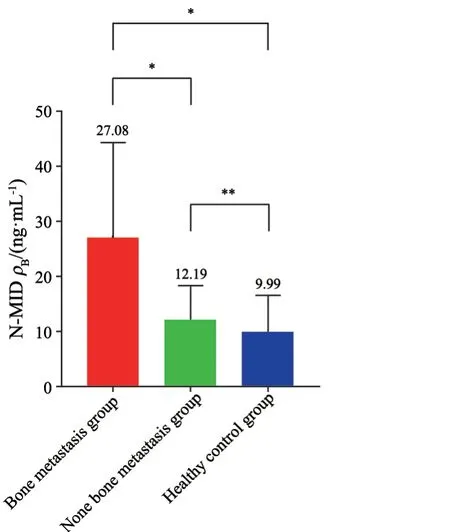
图1 3组研究人群治疗前血清N-MID表达水平比较Fig.1 Serum N-MID levels of three groups before treatment
2.2 肺癌患者发生骨转移的危险因素分析
采用logistic回归模型进行分析。首先分别对患者的性别、年龄、Ca、CEA、NSE、CYFRA21-1、ALP和N-MID进行单因素分析,结果显示,CEA(OR=2.448)、NSE(OR=3.308)、CYFRA21-1(OR=2.125)、ALP(OR=4.247)、N-MID(OR=10.027)是肺癌患者发生骨转移的危险因素。综合上述单因素分析中有意义的因素进行多因素联合分析,结果显示,血清N-MID(OR=9.265)和NSE水平(OR=2.688)是肺癌患者发生骨转移的危险因素(表2)。
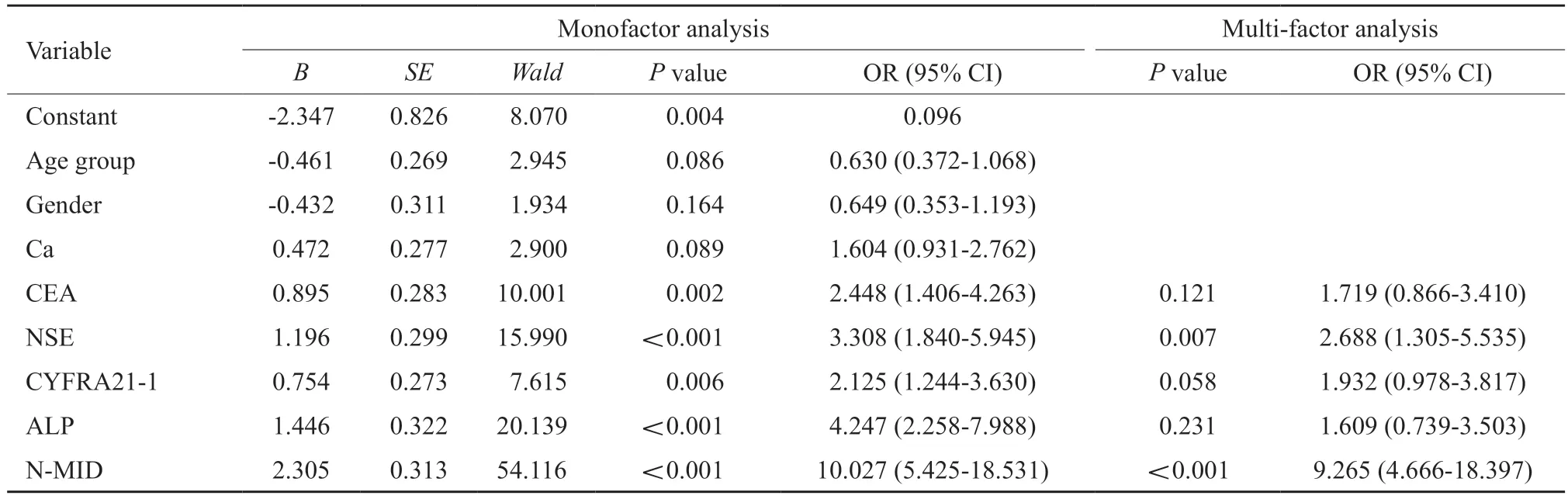
表2 肺癌患者发生骨转移的危险因素分析Tab.2 The risk factors of bone metastasis in patients with lung cancer
2.3 血清N-MID表达水平对肺癌患者骨转移的诊断价值
依据治疗前3组研究人群的血清N-MID检测结果绘制ROC曲线,曲线下面积(area under curve,AUC)为0.849(图2)。选择约登指数最大的切点为临界点,确定N-MID的最佳临界值为14.96 ng/mL,此时血清N-MID对肺癌患者骨转移诊断的灵敏度为77.32%,特异度为78.33%,阳性预测值为63.0%,阴性预测值为87.8%。
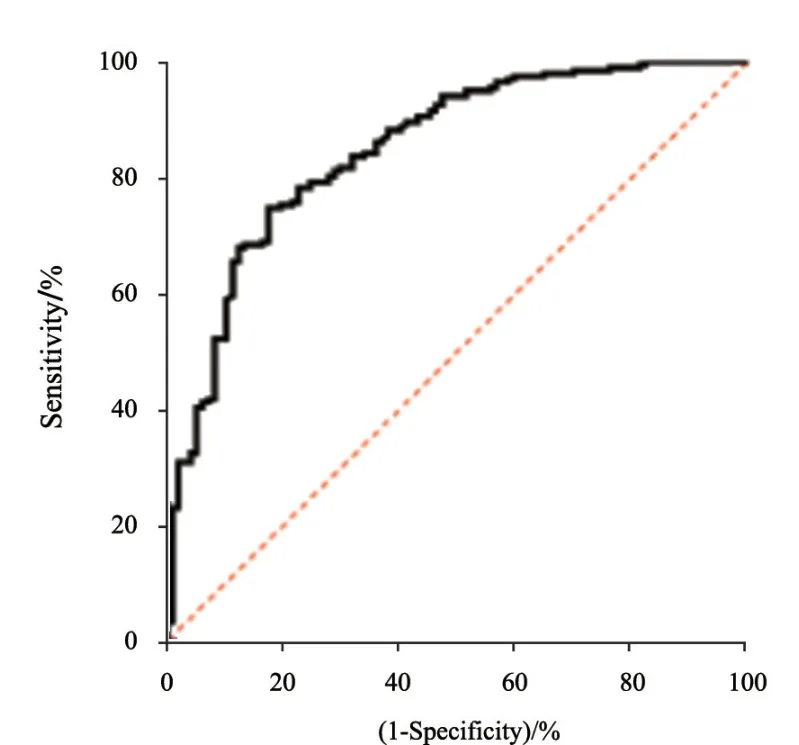
图2 血清N-MID诊断肺癌患者骨转移的ROC曲线Fig.2 ROC curve of serum N-MID for the diagnosis of bone metastasis in patients with lung cancer
2.4 肺癌患者骨转移的PFS分析
依据最佳临界值,将肺癌患者分为N-MID>14.96 ng/mL组和N-MID≤14.96 ng/mL组,绘制生存曲线,结果显示,N-MID>14.96 ng/mL组患者的PFS明显低于N-MID≤14.96 ng/mL组患者(HR=2.040,P=0.021,图3)。

图3 不同N-MID水平患者的PFSFig.3 PFS of patients with different N-MID levels
2.5 血清N-MID表达水平对肺癌合并骨转移患者的疗效监测
对50例肺癌合并骨转移患者治疗3、6个月后的血清N-MID水平进行检测。根据患者是否发生SRE、疼痛缓解情况及活动受限改善情况分为疾病缓解组和疾病未见缓解或加重组,其中疾病缓解组有33例患者,疾病未见缓解或加重组有17例。治疗后疾病缓解患者在治疗3、6个月后的血清N-MID水平较治疗前明显下降,且治疗6个月后的N-MID水平较治疗3个月后也明显下降(P均<0.001)。治疗后疾病未见缓解或加重组患者的血清N-MID水平较治疗前差异无统计学意义(P>0.05,图4)。

图4 治疗后不同疗效患者的N-MID表达水平变化Fig.4 Changes of N-MID levels in patients with different therapeutic effects after treatment
3 讨 论
以ECT和PET/CT为主的影像学检查目前仍是肺癌患者骨转移主要的诊断方法[20]。影像学检查能够对骨转移病灶的部位、数量和大小进行分辨和显示,但存在费用昂贵、检测条件苛刻和特异性不高等问题,难以应用于人群筛查、短期多次复查及长期疾病监测[21-22]。因此,临床上仍需探究更高效便捷的骨转移评估方法。
骨钙素(osteocalcin,OC)是主要由非增殖期成骨细胞合成并特异性分泌的一种小分子球状蛋白质[23]。OC的羧化谷氨酸在钙离子存在的条件下能够促进其与羟磷灰石结合并沉积于细胞外骨基质,从而促进骨骼发育,有研究[24-25]表明,OC具有趋化和激活破骨细胞的能力,其羧化末端对破骨细胞的前体有化学诱导作用,进而调节骨吸收。部分OC会释放入血,完整的OC在外周血中不稳定,经过蛋白酶水解后,血清中约1/3为完整OC,1/3为氨基酸短肽,1/3为裂解后的N-MID[26]。N-MID在血清中具有良好的稳定性,能够反映骨中的OC水平,继而反映成骨细胞的活性以及骨形成和骨吸收的情况,是一项灵敏度和特异度均较高的骨代谢指标。多项研究[27-29]表明,血清N-MID水平可作为诊断乳腺癌、前列腺癌等恶性肿瘤骨转移的敏感指标,在骨转移患者中其水平显著升高。本研究结果显示,治疗前骨转移组的肺癌患者血清N-MID水平明显高于无骨转移组和健康对照组,而无骨转移组与健康对照组间的N-MID水平差异无统计学意义,表明肺癌患者N-MID水平升高与发生骨转移相关。本研究发现,N-MID(OR=9.265)和NSE(OR=2.688)是肺癌患者发生骨转移的危险因素。NSE作为肺癌诊断和监测的敏感指标,可提示肺癌患者的临床分期和疾病进展,在患者发生骨转移后易产生波动,而N-MID与骨转移的相关程度最高。ROC曲线显示,血清N-MID诊断肺癌患者骨转移的AUC为0.849,具有较高的诊断价值。以上结果表明,血清N-MID可作为肺癌患者骨转移辅助诊断的有效指标,这与相关研究[30-32]的结果一致。
在肺癌合并骨转移患者的治疗过程中,对疾病进展和疗效的监测,以及对预后的评估,是指导临床选择合理治疗方案,提高患者生活质量的关键,也是临床医师关注的重点[33-35]。肺癌骨转移的临床治疗主要采用含铂双药联合化疗,同时联合双磷酸盐治疗,必要时应用镇痛类药物或放疗,唑来膦酸是目前使用最广泛的双磷酸盐类药物[36-37]。唑来膦酸能够抑制破骨细胞的成熟和聚集,也可以抑制成熟破骨细胞的活性和功能,从而减少骨吸收,使得因骨转移而紊乱的骨代谢水平趋于稳定[38-39]。因此,通过比较N-MID等骨代谢标志物的浓度变化,可以观察肺癌患者的疗效和预后。本研究通过对疗效和预后进行随访评估,依据最佳临界值对患者进行分类,记录不同血清N-MID水平下患者的PFS,发现N-MID>14.96 ng/mL组患者的PFS明显低于N-MID≤14.96 ng/mL组患者(HR=2.040),说明N-MID水平越高,患者疾病进展越快,预后越差。本研究发现治疗后疾病缓解患者的N-MID水平降低,而疾病未见缓解或加重患者的N-MID水平无明显变化。由此可见,血清N-MID水平在肺癌合并骨转移患者的疗效监测和预后评估中有指导作用。
本研究的局限性在于病例数有限,尤其是肺癌合并骨转移患者的随访例数少,随访时间较短,仍有待大样本前瞻性研究进一步分析血清N-MID水平在患者随访中的应用,证实N-MID在肺癌患者骨转移辅助诊断和疗效监测方面的作用。
