除草剂对桉树人工林下植物及土壤微生物群落的影响
2021-10-09周晓果左晓庆温远光朱宏光梁宏温邵文哲陈秋海张彧娜
周晓果,左晓庆,温远光,2,3,*,王 磊,朱宏光,3,梁宏温,邵文哲,陈秋海,张彧娜
1 广西大学林学院,广西森林生态与保育重点实验室, 南宁 530004 2 广西科学院生态产业研究院, 南宁 530007 3 广西友谊关森林生态系统定位观测研究站, 凭祥 532600
桉树具有生长快速、适应性强、产量高、效益好等特点;其用途广泛,多数是全球著名的硬木资源,是制浆造纸的主要原料,是旋切单板、胶合板、纤维板、刨花板、家具制造业的主要用材,是优质可再生的生物质能源[1]。自18世纪90年代以来,桉树逐渐成为全球热带和亚热带地区重要的造林树种,在木材资源供给和应对气候变化等方面扮演着越来越重要的角色[1- 2]。目前,全球桉树人工林的面积已超过2500万hm2,我国桉树人工林的面积为450万hm2,仅次于巴西,而广西的桉树人工林面积已达256万hm2,居全国首位[1]。在我国,桉树每年提供3000万m3的木材,约占全国木材产量的30%[3],发展桉树人工林对保障国家木材安全、生态安全,应对全球气候变化以及实现林业高质量发展均具有重要的意义[1]。然而,桉树人工林通常采用短周期纯林连栽的经营方式,经营措施包括皆伐、全树利用、炼山、机耕整地、施肥和喷施化学除草剂进行林下植被抚育等,对林地造成高强度的干扰,导致生物多样性降低、土壤质量退化、木材产量下降等负面影响,从而引发一系列的生态问题[4-5],引起社会各界及各国学者的广泛关注[6-7]。然而,除草剂施用是导致上述系列生态问题的重要驱动因素之一。
化学除草剂因作用迅速、使用方便、易于大面积使用,而成为人工林林下植被抚育的主要方式[8-9]。近10余年来,除草剂在桉树人工林中的应用越来越普遍[10]。关于除草剂对生物多样性的影响也逐渐成为学者们关注的焦点[11]。有研究表明,除草剂可以改变植物群落的组成[10]、降低植物覆盖和碳输入[8];降低土壤微生物多样性[12]、影响根际土壤微生物多样性及群落组成[13]、降低微生物群落碳源利用能力[14]及酶活性[15]。然而,除草剂对植物群落和土壤微生物群落的影响会随施药剂量、频率、施用时间的延长而发生变化[16],但这些变化对林下植物和土壤微生物群落的影响机制尚缺乏研究。在森林生态系统中,植物、土壤微生物群落关联紧密[17],植物可以通过凋落物和根系分泌物等向土壤中的微生物提供生长和繁殖所需的营养,不同植物功能群具有不同的凋落物质量和根系分泌物组成,因此,地上植物多样性和功能群组成的差异必将影响地下微生物群落的组成,从而影响生态系统功能[18]。本研究基于4年来在桉树人工林中开展的不同剂量、不同频率除草剂喷施试验,旨在揭示低浓度高频率、中浓度中频率和高浓度低频率施用除草剂条件下,植物和土壤微生物群落的响应机制及作用规律,为除草剂的安全施用和林下植被管理提供科学建议。
1 材料与方法
1.1 研究区域概况
研究区域位于广西钦州市钦南区大番坡镇(地处北纬21°49′,东经108°38′),丘陵地貌,南邻北部湾,主要受海洋气候影响,是我国湿热多雨的地区之一。该地区年平均气温21.7—22.8℃,极端最低温-2.0—1.9℃,极端最高温34.0—41.0℃,全年≥10℃的年积温7220—7812℃;历年平均降雨量为2104.2 mm,由于季风所致,降雨分布不均,干湿季分明;每年4—9月为雨季,降雨集中,占全年降雨量的80%;10月至次年3月为干季,降雨量少,占20%。空气潮湿,年均相对湿度达80%。土壤类型为砖红壤。原生植被几无残存,20世纪90年代主要是马尾松低产林,1997年开始大面积营造桉树人工林。
1.2 试验林的营造与试验设计
2014年10月对试验地进行人工整理,2015年4月完成试验林营造。桉树造林的株行距为1.25 m×4 m,密度为2000株/hm2。造林前,每株桉树施基肥550 g,造林后前2年,每年春季追施桉树专用肥250 g/株。2015年5月采用随机区组实验设计,在林地中立地条件、林下植被组成相似的典型区域随机设置4种林下植被抚育方式,即连续3年人工除草抚育(Manual tending,MT)、连续3年低剂量高频率化学除草抚育(Low-dose high-frequency,LHF)、连续2年中剂量中频率化学除草抚育(Medium-dose medium-frequency, MMF)、造林当年高剂量低频率化学除草抚育(High-dose low-frequency, HLF),每处理3次重复,共设置12个30 m×20 m研究样方。在不同处理之间保留有10 m以上的隔离带。
试验中,除草剂为41%草甘膦(异丙胺盐水剂),3种剂量的除草剂总用量相同,均为1200 mL/667m2。其中:低剂量每次使用的浓度为200 mL/667m2(即每667m2采用200 mL 41%草甘膦兑纯水15 kg进行喷施),每年喷施2次,连续喷施3年(2015—2017年);中剂量为生产中使用的浓度,每次使用的浓度为300 mL/667m2(即每667 m2采用300 mL 41%草甘膦兑纯水15 kg进行喷施),每年喷施2次,连续喷施2年(2015—2016年),为保证各处理试验样地摄入水量一致,2017年在进行LHF处理的同时,每667 m2喷施15 kg纯水;高剂量每次使用的浓度为600 mL/667m2(即每667 m2采用600 mL 41%草甘膦兑纯水15 kg进行喷施),在试验第1年(2015年)喷施2次,为保证各处理试验样地摄入水量一致,2016、2017年在进行LHF处理的同时,每667 m2喷施15 kg纯水。除草剂均采用16型背负式喷雾器及0.7 mm喷片进行喷雾,一年中2次喷施的时间为4—5月和8—9月。人工除草抚育的处理时间也为2015—2017年每年4—5月和8—9月各除草1次。图1为试验结束一年时(2018年7月)的林分结构。

图1 试验林分结构(摄于2018年7月)Fig.1 Stand structure of the experimental plantations (Photos were taken in July 2018)
1.3 植物群落调查及功能群划分
于2018年7月在每个30 m×20 m的样方内,分别位于上、中、下坡各设1个5 m×5 m的灌木调查样方,记录样方内所有木本植物的种名、个体数、高度和盖度;同时,在灌木样方内设1个2 m×2 m样方,记录草本植物的种名、个体数、高度和盖度。共设置灌木和草本调查样方72个。参照Miller等[8]的方法,将林下植物划分为木本植物功能群(Woody plant functional group,WFG)、藤本植物功能群(Vine functional group,VFG)、蕨类植物功能群(Fern functional group,FeFG)、禾草植物功能群(Gramineae functional group,GFG)、非禾本科草本(杂草)植物功能群(Forb functional group,FoFG)和入侵植物功能群(Invasive plant functional group,IFG),以揭示不同植物功能群对除草剂的响应和适应。
1.4 样品采集与分析
于2018年7月在每个30 m×20 m的样方中心以及距离样方中心9—10 m处,每隔45°设置一个采样点,共9个采样点,用内径为8.5 cm的不锈钢土钻采集0—10 cm土层的土样,去除植物根系及石砾,制成混合土样后过2 mm孔径筛,将样品分为3份,一份风干用于测定土壤理化性质,一份经冷冻干燥用于土壤微生物群落磷脂脂肪酸(Phospholipids fatty acid, PLFA)分析,另一份保存于4 ℃冰箱用于土壤酶活性、微生物生物量碳氮及铵态氮、硝态氮含量的测定。
土壤基本理化性质测定方法参见《土壤农化分析》[19]。土壤 pH值采用pH 计( pHS- 25型) 测定,取10 g风干土样与去离子水(土∶水=1∶2.5,W/V) 充分混匀,待土壤溶液澄清后,取上清液测定pH值;土壤水分含量(Soil moisture content,SMC) 采用重量法测定;土壤全氮(Total nitrogen,TN) 含量采用连续流动分析仪(AA3,Bran and Luebbe, Norderstedt,Germany) 测定;土壤全磷(Total phosphorus,TP) 采用氢氧化钠碱熔-钼锑抗比色法测定;土壤全钾(Total potassium,TK) 采用氢氧化钠碱熔-火焰光度计法测定;土壤速效钾(Available potassium,AK) 用乙酸铵浸提-火焰光度计法测定;土壤速效磷(Available phosphorus,AP)用双酸浸提-钼锑抗比色法测定;土壤有机质(Soil organic matter,SOM) 采用重铬酸钾氧化-外加热法测定;土壤微生物生物量碳(Microbial biomass carbon,MBC)、氮(Microbial biomass nitrogen,MBN) 测定采用氯仿熏蒸浸提法;称取10 g鲜土,用2 mol/LKCl溶液提取后于全自动连续流动分析仪测定土壤铵态氮、硝态氮含量。土壤有效氮(Available nitrogen,AN) 含量为铵态氮、硝态氮含量之和。
参照 Frostegård 等[20]的方法测定土壤微生物群落PLFA含量。单个脂肪酸种类用 nmol/g干土表示,每种脂肪酸的浓度基于19∶0碳内标的浓度来计算。本研究中,用PLFA i14:0、a15:0、i15:0、i16:0、a17:0、i17:0指示革兰氏阳性菌(Gram-positive bacteria,GP),16:1ω7c、cy17:0、18:1ω5c、18:1ω7c、cy19:0指示革兰氏阴性菌(Gram-negative bacteria,GN),10Me16:0、10Me17:0、10Me18:0指示放线菌(Actinomycetes,Act),18:1ω9c、18:2ω6c指示真菌,16:1ω5c指示丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)[21- 23]。细菌的PLFA含量为GP与GN的PLFA含量之和。
通过测定土壤氧化还原酶类(过氧化物酶、酚氧化酶) 及水解酶类(β- 1,4-葡萄糖苷酶和N-乙酰-β-氨基葡萄糖苷酶、脲酶、磷酸酶) 的活性来评价土壤微生物功能[24]。过氧化物酶(Peroxidase,PER)和酚氧化酶(Phenol oxidase,PHE)活性采用左旋多巴胺(L-DOPA)为底物进行测定[25]。β- 1,4-葡萄糖苷酶(β- 1,4-glucosidase,BG) 和 N-乙酰-β-氨基葡萄糖苷酶(N-acetyl-β-glucosaminidase,NAG) 活性采用对硝基苯乙酰基氨基葡萄糖苷为底物进行测定[26-27]。脲酶(Urease,URE) 活性采用次氯酸钠-苯酚钠比色法测定;酸性磷酸酶(Acid phosphatase,ACP) 活性利用对-硝基酚磷酸钠溶液为底物测定[28]。
1.5 数据统计分析
林下植物重要值(Importance value,IV)计算公式为:
IV=(相对盖度+相对密度+相对频度)/3
其中,相对盖度(%)=100×样方内某个种的盖度/所有种的总盖度;
相对密度(%)=100×样方内某个种的株数/所有种的总株数;
相对频度(%)=100×样方内某个种出现的次数/所有种出现的总次数。
物种丰富度指数:S=样方内出现的物种数。
Shannon-Wiener 指数(H)[29]:
式中,pi=ni/Ni代表第i个物种的个体数ni占所有个体总数Ni的比例。
Simpson指数(D)[30]:
Pielou 均匀度指数(J)[31]:
式中,H为Shannon-Wiener指数,S为样方内出现的物种数。
采用单因素方差分析(One-way ANOVA)检验不同处理林下植物多样性指数、功能群重要值、土壤养分含量、土壤酶活性、土壤微生物功能群PLFA含量的差异,用S-N-K法进行显著性检验;采用Pearson相关分析方法对林下植物功能群重要值与土壤性质、微生物及酶活性进行相关分析;以上分析均用SPSS19.0(SPSS, Inc, Chicago, IL)软件完成,显著性水平设P<0.05。在R3.5.1中采用piecewiseSEM程序包[32]构建除草剂影响土壤养分、林下植物群落、土壤酶活性及土壤微生物群落的结构方程模型,其中土壤养分用包含SOM、TN、TP、TK、AN、AP、AK含量主成分分析第一轴(PC1)的数据表征,林下植物群落用包含多样性指数、功能群重要值主成分分析第一轴(PC1)的数据表征,酶活性用本研究所测得6种酶活性主成分分析第一轴(PC1)的数据表征,土壤微生物群落用各功能群PLFA含量、MBC、MBN主成分分析第一轴(PC1)的数据表征。主成分分析采用vegan程序包进行[33]。采用Sigmaplot 11.0辅助绘图。
2 结果与分析
2.1 植物种类和功能群组成
本实验共监测到维管束植物55种,分属32科、48属;其中木本植物25种、藤本植物18种、蕨类植物4种、禾草植物3种、杂草2种、入侵植物3种(表1)。由表1可以看出,施用除草剂导致桉树人工林林下植物种类和功能群组成发生了显著变化。人工除草(MT)时,林下以WFG、VFG、FeFG、GFG为共优势,重要值分别为29.17%、25.99%、22.50%、21.87%(图2)。低剂量高频率施用除草剂(LHF)显著提高了FeFG的重要值(IV=53.87%),显著降低了VFG的重要值(IV=9.79%),而林下WFG、GFG重要值有所降低,IFG重要值有所上升。中剂量中频率施用除草剂(MMF)显著提高了GFG的重要值,其重要值为39.13%,VFG、WFG重要值则显著下降,分别为13.24%和12.77%。高剂量低频率施用除草剂(HLF)时,林下以WFG重要值最高,为32.35%,其次是FeFG和VFG,分别为24.52%和23.37%,GFG相应为17.62%。在所有的处理中,杂草植物和入侵植物功能群的比例最低,为0—4.29%之间(图2)。
由图3可以看出,与人工除草相比,施用除草剂均不同程度地降低了物种丰富度、Simpson指数、Shannon-Wiener指数和均匀度指数,其中,除了低剂量高频率施用除草剂显著降低了林下植物的Simpson指数(P<0.05)外,其余差异不显著(P>0.05),但随着除草剂施用浓度的增加和频率降低,物种丰富度和各多样性指数又呈现逐渐增加的趋势(图3)。
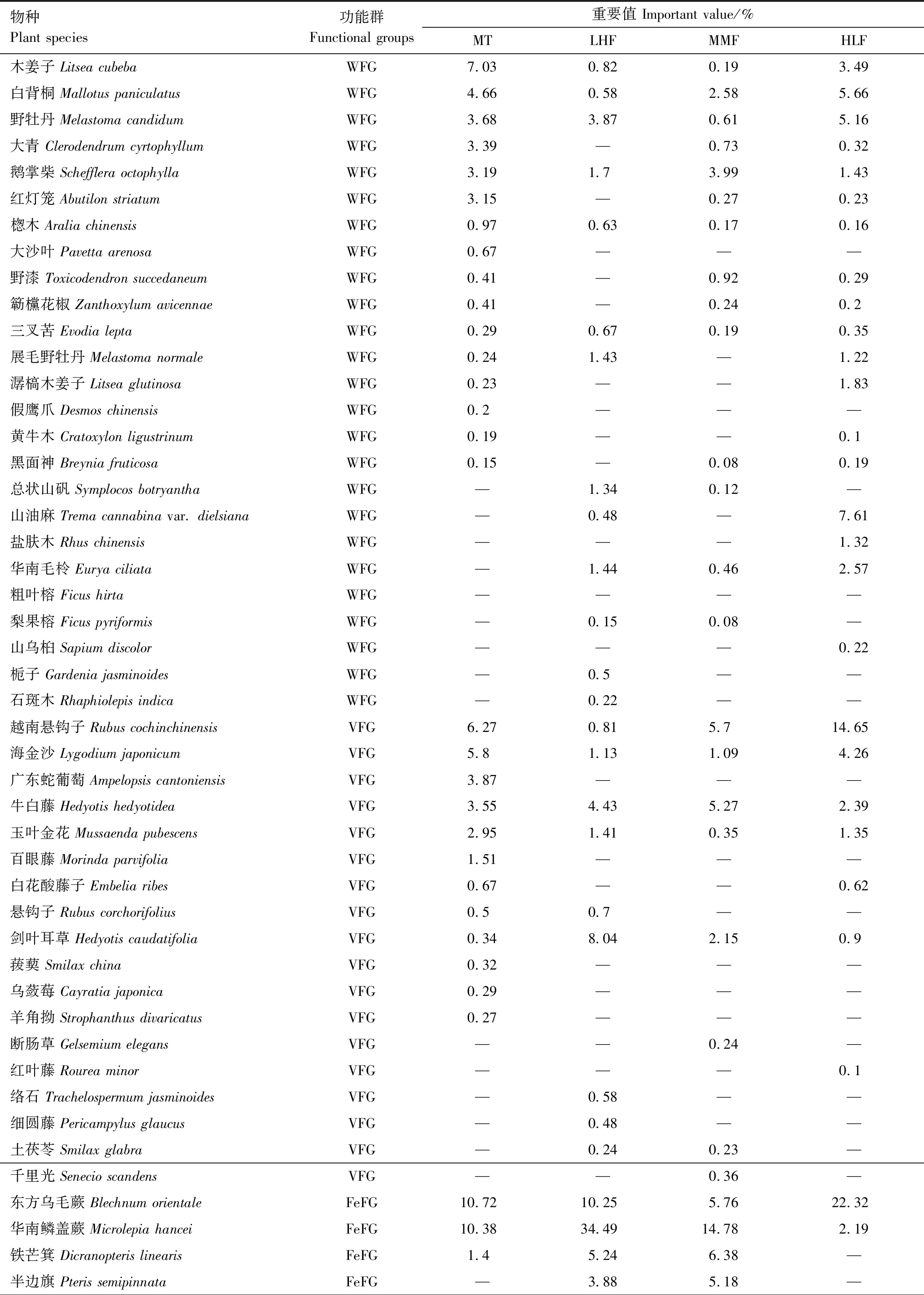
表1 不同处理桉树人工林林下植物物种、功能群组成及重要值

图2 不同处理桉树人工林林下植物功能群重要值 Fig.2 Importance value of different plant functional groups in understory of Eucalyptus plantations with different treatmentsWFG:木本植物功能群 Woody plant functional group;VFG:藤本植物功能群 Vine functional group;FeFG:蕨类植物功能群 Fern functional group;GFG:禾草植物功能群 Gramineae functional group;FoFG:非禾本科草本(杂草)植物功能群 Forb functional group;IFG:入侵植物功能群 Invasive plant functional group;不同小写字母表示同一功能群不同处理间差异显著(P<0.05)

图3 不同处理桉树人工林林下植物多样性Fig.3 Diversity indices of understory plant species in Eucalyptus plantations with different treatments不同小写字母表示不同处理间差异显著(P<0.05)
2.2 土壤微生物生物量及功能群组成
MT、LHF、MMF和HLF处理的土壤微生物生物量碳含量分别为(375.72±17.97) mg/kg、(290.94±12.88) mg/kg、(127.24±7.00) mg/kg、(279.63±23.52) mg/kg,土壤微生物生物量氮的含量分别为(49.71±1.86) mg/kg、(25.90±1.41) mg/kg、(22.87±0.55) mg/kg、(23.89±1.27) mg/kg(图4)。土壤微生物生物量碳、氮均以人工除草的最高,MMF的最低。方差分析结果表明,施用除草剂显著降低了微生物生物量碳、氮的含量,MMF的微生物生物量碳显著低于LHF和HLF(P<0.05),而三者之间的微生物生物量氮差异不显著(P>0.05)(图4)。

图4 不同处理桉树人工林的土壤微生物生物量碳氮Fig.4 Microbial biomass carbon and nitrogen in Eucalyptus plantations with different treatments不同小写字母表示不同处理间差异显著(P<0.05)
研究结果显示,HLF((9.19±0.12) nmol/g)和MT((8.89±0.33) nmol/g)的土壤总PLFA差异不显著(P>0.05),但两者均显著高于MMF((8.19±0.18) nmol/g)和LHF((7.74±0.13) nmol/g)的土壤总PLFA(P<0.05),后两者之间的差异也不显著(P>0.05)。与MT相比,LHF显著降低了总PLFA、真菌和放线菌的PLFA含量;MMF显著降低了放线菌和总PLFA(P<0.05),而HLF的细菌、真菌、丛枝菌根真菌以及总PLFA与MT均无显著差异(P>0.05),但放线菌的PLFA含量显著提高。与MT相比,随着除草剂浓度的增加和频率降低,各微生物类群的PLFA含量均呈先下降后增加的趋势(图5)。

图5 不同处理桉树人工林土壤微生物功能群的PLFA含量Fig.5 PLFA contents of soil microbial functional groups in Eucalyptus plantations with different treatments不同小写字母表示不同处理间差异显著(P<0.05)
2.3 土壤养分特征
和MT相比,除了HLF处理显著降低了土壤全磷(TP)的含量外,不同处理间土壤养分指标均无显著差异(表2),但除草剂处理的土壤养分指标均存在不同程度的下降趋势。从表2还可看出,不同的指标对除草剂的响应不同,随着除草剂浓度的增加和频率的降低,土壤pH、全钾呈上升趋势,土壤含水量、全磷、速效磷和速效钾呈下降趋势,而土壤有机质、全氮、有效氮的含量却呈先下降后增加的趋势。
2.4 土壤酶活性
由表3可知,与MT相比,施用除草剂显著降低了土壤酸性磷酸酶和过氧化物酶的酶活性,而HLF显著提高了土壤脲酶的活性。虽然施用除草剂对β- 1,4-葡糖苷酶、N-乙酰-β-氨基葡糖苷酶和酚氧化酶的影响不显著,但均不同程度地降低了其酶活性。随着除草剂浓度的增加和频率的降低,酶活性呈先下降后恢复的趋势(表3)。

表2 不同处理桉树人工林土壤养分特征

表3 不同处理桉树人工林的土壤酶活性
2.5 林下植物与土壤性质、微生物和酶活性的关系
相关分析结果表明,林下木本植物功能群与土壤微生物总PLFA、放线菌PLFA、革兰氏阴性菌PLFA及PER活性呈显著正相关关系(表4)。藤本植物功能群与全氮、全钾、总PLFA、细菌、真菌、放线菌、革兰氏阳性、革兰氏阴性菌PLFA、BG、NAG、PHE及PER活性呈显著或极显著的正相关关系。而蕨类植物功能群与全钾、总PLFA、细菌、真菌、放线菌、革兰氏阳性菌PLFA、NAG、PHE活性呈显著或极显著的负相关关系。禾草植物功能群与有效氮、MBC呈显著负相关关系,而与GP∶GN呈显著正相关关系。杂草植物功能群分别与全磷、脲酶活性呈显著负、正相关关系。
结构方程模型阐明了土壤微生物群落68%的变异可由除草剂对土壤养分、林下植物群落、土壤酶活性的影响来解释(图6)。模型适配度良好,拟合结果为:Fisher′sC=1.627,P=0.443,自由度df=2。除草剂对土壤微生物群落的直接影响并不显著(β=-0.004,P=0.991),而是主要通过降低林下植物群落多样性(β=-0.655,P=0.020)、土壤养分(β=-0.342,P=0.276)间接影响土壤微生物群落。此外,除草剂对土壤酶活性的影响也不显著(β=0.431,P=0.395),但土壤酶活性显著影响土壤微生物群落(β=0.573,P=0.041)。

表4 林下植物功能群重要值与土壤性质、微生物及酶活性的相关性分析

图6 除草剂影响土壤养分、林下植物群落、土壤酶活性及微生物群落的结构方程模型Fig.6 A structural equation model(SEM)showing the effects of herbicide on soil nutrients, understory plant community, soil enzyme activity and soil microbial community箭头:指标对指向指标的影响;箭头粗细:所受影响程度(箭头越粗表示影响越大);箭头上系数:β值,标准通径系数;实线:正相关;虚线:负相关
3 讨论
3.1 除草剂对植物物种组成和功能群的影响
多数研究认为除草剂降低了物种多样性[34- 36],但也有研究表明,除草剂并未使物种多样性降低[37],只是导致物种组成发生改变[38- 41]。长期使用单一除草剂或防除植物种类相近的除草剂可能引起物种组成趋同化[42],而且容易给植物施加强大的选择压力,使抗单一除草剂甚至抗多种除草剂的植物种类和数量不断增加[2,43]。Zhou等[5]的研究发现高浓度高频率除草剂导致桉树林下植物群落多样性减少和外来入侵植物增加。本研究发现,除草剂降低物种丰富度和多样性指数,但差异不显著,且随除草剂施用频率的降低及恢复时间的增加,物种丰富度及多样性指数呈恢复趋势,这与上述除草剂只改变植物物种组成,并未使物种多样性降低的结果一致[39- 41]。有研究表明,除草剂能促进草本植物群落的发育[5,44],降低木本植物的物种丰富度[5,45]。除草剂的应用频率越高,植物生长型(功能群)的相对多度和相对盖度减少越明显[46]。我们早期的研究也发现,在炼山和非炼山条件下,桉树林下植物功能群对低浓度低频率除草剂的响应不同,炼山+除草剂增加木本植物盖度,降低蕨类、杂草、禾草和豆科植物盖度,非炼山+除草剂却出现相反的趋势[10]。本研究发现,不同植物功能群对不同剂量和不同频率除草剂的响应存在显著差异,低剂量高频率除草剂显著提高蕨类植物功能群的重要值,而显著降低藤本植物功能群的重要值;中剂量中频率除草剂显著提高禾草植物功能群的重要值,却显著降低木本和藤本植物功能群的重要值;高剂量低频率除草剂与人工除草(对照)无显著差异。桉树林下植物功能群的去除试验表明,木本植物功能群具有比其它植物功能群更强的生态系统多功能性的维持能力[47]。本研究中,中剂量中频率除草剂施用显著降低木本植物功能群的优势,这可能会对生态系统多功能性产生长期的负面影响。此外,除草剂对植物最显著的影响是致死,而未被杀死的植物会自我修复[48],但不同的物种对除草剂的敏感程度及自我修复能力均存在差异[49]。本研究中,高剂量低频率除草剂应用对植物多样性的影响反而较小,可能与处理的频率低,而恢复的时间较长有关,也可能与本试验的高剂量并非极值有关。
3.2 除草剂对土壤微生物和酶活性的影响
呼蕾等[50]的研究表明,草甘膦对土壤微生物生物量碳和生物量氮的影响会因土壤类型的不同而异,指出在碱性土,草甘膦对土壤微生物生物量碳和生物量氮含量有一定的抑制作用,而在酸性土,却表现出一定的激活作用。在本研究中,施用除草剂均显著降低土壤微生物生物量碳和生物量氮的含量,尤其以中剂量中频率除草剂的负作用最明显,这可能与中剂量中频率除草剂施用显著降低木本、藤本植物功能群而显著提高林下禾草植物功能群的优势有关[47](表4)。有研究认为,施用高浓度的草甘膦会使土壤微生物活性受抑制[51- 52]。本研究还发现,施用除草剂显著降低了酸性磷酸酶和过氧化物酶的活性;酚氧化酶、β- 1,4-葡糖苷酶和N-乙酰-β-氨基葡糖苷酶的活性也有所降低,但影响不显著,并且,随着除草剂浓度的提高和频率下降,恢复期延长,酶活性有所恢复;高剂量低频率除草剂显著提高了脲酶的活性。这表明除草剂对土壤酶活性的影响会随施药剂量、频率的变化而发生变化[16,53]。
多数研究认为,施用高浓度的草甘膦导致土壤微生物数量普遍降低,随着草甘膦施入时间的延长,对土壤微生物的抑制作用逐渐减弱[51-52]。邓晓等[51]研究发现草甘膦对土壤微生物的种群数量及土壤中细菌、放线菌和真菌生长速率均具有一定的抑制作用,并随药剂浓度的升高抑制作用逐渐增强。陶波等[54]研究发现,随着草甘膦施入时间的延长,真菌、细菌、放线菌的种群数量有所恢复,其中放线菌与真菌同细菌相比对草甘膦敏感,土壤细菌对草甘膦具有较强的耐受或降解能力。也有研究认为,田间施用高浓度的草甘膦对土壤微生物群落结构几乎没有影响[55],而且草甘膦喷施后只会导致农田内少数的土壤微生物种群发生变化,但这些变化都具有时效性,并且影响比较微弱[56]。本研究结果显示,除草剂对土壤微生物群落的直接影响并不显著,而是通过对林下植物群落和土壤养分的负面影响间接影响土壤微生物群落(图6)。方差分析结果显示,低剂量高频率除草剂显著降低了微生物群落、真菌和放线菌的PLFA含量,这与该处理显著降低林下藤本而显著提高蕨类植物功能群有关(表4,图2);中剂量中频率除草剂显著降低了微生物群落和放线菌的PLFA含量,这与该处理显著降低木本和藤本植物功能群有关(表4,图2);高剂量低频率除草剂的微生物群落、细菌、真菌以及丛枝菌根真菌的PLFA含量在经过两年的恢复之后与人工除草相比均无显著差异,但放线菌的含量显著升高,这也与该处理林下植物功能群及多样性的恢复有关(表4,图2,图3)。我们前期的研究表明,林下植被由多功能群组成(多样性高)的群落比单一功能群占优势(多样性低)的群落更有利于凋落物的分解;木本植物功能群能提供更多样化的凋落物及根系分泌物,从而为土壤微生物群落提供更多底物和生境,提高土壤微生物PLFA含量、增强土壤养分含量及酶活性[47]。本研究中,低剂量高频率及中剂量中频率除草剂处理均会导致木本和藤本植物功能群优势的降低,导致凋落物分解缓慢及碳源输入的减少是微生物生物量降低的主要原因。
4 结论
除草剂对林下植物群落多样性、功能群重要值、土壤微生物群落PLFA及土壤酶活性的影响随施药剂量、频率的改变而发生变化。不同剂量和频率的除草剂并未显著降低林下植物群落物种丰富度和多样性,随除草剂施用频率的降低及恢复时间的增加,物种丰富度及多样性指数呈恢复趋势。不同剂量和频率的除草剂显著改变不同植物功能群的优势度,并通过对林下植物群落和土壤养分的负面影响间接影响土壤微生物群落。低剂量高频率除草剂显著提高蕨类植物功能群的重要值,而显著降低藤本植物功能群的重要值,从而显著降低了微生物群落、真菌和放线菌的PLFA含量。中剂量中频率除草剂显著提高禾草植物功能群的重要值,却显著降低木本和藤本植物功能群的重要值,导致微生物群落和放线菌的PLFA含量显著降低。高剂量低频率除草剂处理中,在经过3年时间无除草剂喷施的干扰后,林下植物功能群及多样性恢复到与人工除草无差异的水平,其土壤微生物群落、细菌、真菌以及丛枝菌根真菌的PLFA含量、土壤酶活性也与人工除草无显著差异,且放线菌PLFA及脲酶活性显著提高,但土壤全磷含量显著降低,速效磷含量也明显降低。值得注意的是,施用除草剂显著降低了土壤微生物生物量碳、氮的含量。因此,生产上应减少除草剂的施用,以减少对林下植物和土壤微生物群落的负效应。本文仅研究了不同剂量和频率的除草剂施用4年后林下植物和土壤微生物群落的变化,除草剂对森林生态系统造成的影响是长期而复杂的,除草剂施用对桉树人工林林下植物和土壤微生物群落的长期影响及其机制还有待深入研究。
