LncRNA NEAT1调控miR-195对宫颈癌细胞SiHa放射敏感性的影响
2021-09-30王秋宇姜平朱军义许静郭哲孙慧霞
王秋宇 姜平 朱军义 许静 郭哲 孙慧霞
doi:10.3870/j.issn.1674-4624.2021.02.008
宫颈癌作为妇科最常见的恶性肿瘤之一,发病率在妇科恶性肿瘤中高居第2位[1-2],3年生存率低于15%,且中晚期宫颈癌主要的治疗方法—放疗常产生放射耐受性,患者预后较差,生存质量较低[3]。因此,研究宫颈癌放疗耐受的分子机制已成为其临床治疗基础研究的热点。
长链非编码RNA(long non-coding RNA, lncRNA)和微小RNA(microRNA, miRNA)参与肿瘤发展进程,且lncRNA可作为miRNA分子海绵发挥作用,进而调控miRNA靶基因的表达,发挥生物学功能[4-7]。核富集转录本1(nuclear paraspeckle assembly transcript 1, NEAT1)是一种lncRNA,其表达水平与宫颈癌细胞增殖、集落形成、迁移能力和侵袭力关系密切,可能成为宫颈癌精准的治疗靶点[8]。但目前,NEAT1对宫颈癌细胞放疗敏感性的影响和机制还未知。本研究前期通过Targetscan靶基因预测软件显示,NEAT1可能靶向结合miR-195。研究显示,过表达miR-195可增加人喉癌和非小细胞肺癌细胞的放射敏感性[9-11]。而NEAT1能否靶向调控miR-195表达,影响宫颈癌SiHa细胞放射敏感性尚还未知。本文将讨论NEAT1对宫颈癌SiHa细胞放射敏感性的影响及其能否靶向负调控miR-195表达,以期为提高宫颈癌放疗敏感性提供分子靶点。
材料与方法
一、材料
宫颈癌细胞株SiHa和正常宫颈细胞株Ect1/E6E7购自中科院上海细胞库;胎牛血清(fetal bovine serum, FBS)和DMEM培养基购自Gibco公司;四氮唑蓝(blue tetrazolium chloride, BTC)、二甲基亚砜和胰蛋白酶购自Sigma-Aldrich公司;Transwell板购自美国Corning公司;双荧光素酶报告系统购自美国Promega公司;Lipofectamine 2000试剂盒、Trizol试剂、实时定量PCR(real-time PCR)试剂盒、反转录试剂盒购自美国Invitrogen公司;NEAT1小干扰RNA(si-NEAT1,5′-UAGGUCAGUGCGCCUAGUC-3′)、不含人体DNA分子同源序列的小RNA分子作为随机dsRNA对照组(si-con,5′-CUGAUGCUAGCGAUCG-UC-3′)、miR-195抑制剂(anti-miR-195,5′-CGA-UAGCUAGCUACGGGGA-3′)及抑制剂阴性对照序列(anti-miR-con,5′-CGAAUUAAGCACAGUC-3′)、miR-195模拟物(mimics,5′-ACGAUAUAC-GUAC-GUA-3′)及模拟对照序列(miR-con,5′-CGA-GAUAUACGUACGUAAG-3′)、NEAT1过表达载体(pcDNA-NEAT1,5′-CAACGAAUA-UGCUAG-CAC-3′)及对照空载体(pcDNA,5′-CAUACUACGAUAUCUACCGC-3′)、NEAT1野生型质粒(WT-NEAT1)及突变型质粒(MUT-NEAT1)购自上海吉玛制药技术有限公司;光学显微镜、全自动酶标仪及Real-time PCR仪购自美国Bio-Rad公司。
二、方法
1.细胞培养:使用含10 % FBS的DMEM培养液(含100 U/mL青霉素和100 μg/mL链霉素)培养SiHa和Ect1/E6E7细胞,在37 ℃ 5% CO2培养箱中培养,湿度95%,培养细胞至对数生长期。将对数增殖期的SiHa和Ect1/E6E7细胞均稀释浓度至1×106/ml,200 μl细胞/孔接种于6孔板中,培养24 h后,0.25%胰蛋白酶消化,收集细胞,RT-qPCR检测SiHa和Ect1/E6E7细胞中NEAT1和miR-195RNA的表达水平。
2.SiHa细胞转染:SiHa细胞培养至对数生长期,收集细胞,稀释细胞浓度至1×106/ml,200 μl细胞/孔接种于6孔板中,细胞培养至基本融合为一层时,采用Lipofectamine 2000脂质体法,分别转染si-con(si-con组)、si-NEAT1(si-NEAT1组)、pcDNA(pcDNA组)、pcDNA-NEAT1(pcDNA-NEAT1组)、共转染si-NEAT1与anti-miR-con(si-NEAT1+anti-miR-con组)、si-NEAT1与anti-miR-195(si-NEAT1+anti-miR-195组)。转染12 h后,换成完全培养基。再培养24 h后收集细胞进行实验。
3.实时荧光定量PCR(real-time quantitative PCR, RT-qPCR)检测NEAT1和miR-195RNA的表达:转染后的SiHa细胞(si-con组、si-NEAT1组、pcDNA组、pcDNA-NEAT1组),用Trizol试剂提取总RNA,测定浓度和纯度,保存于-80 ℃。然后反转录合成cDNA,反应程序为16 ℃ 30 min、42 ℃ 45 min、72 ℃ 10 min;4 ℃放置10 min,合成的cDNA测定浓度和纯度后置于-80 ℃保存。取cDNA按照RT-qPCR的说明书进行反应,反应程序为:95 ℃ 4 min;95 ℃ 30 s、60 ℃ 40 s、72 ℃ 40 s,40个循环;72 ℃ 10 min。引物如下:miR-195上游:5′-ATCCAGTGCGTGTCGTG-3′,下游:5′-TGCTTAGCAGCACAGAAA-3′;NEAT1上游:5′-TGG-CTAGCTCAGGGCT-3′,下游:5′-TCTCC-TTGCCAAGCTTCCTTC-3′。运用Bio-RadIQ5TM系统进行数据分析。
4.克隆形成实验测定放射处理后细胞存活分数:收集转染后SiHa细胞(si-con组、si-NEAT1组、si-NEAT1+anti-miR-con组、si-NEAT1+anti-miR-195组),以2.5×104个/孔接种于6孔板培养过夜。然后用不同剂量(0、2、4、6、8 Gy) 6 MV-X照射细胞,照射均为一次性照射。照射条件:室温,源靶距100 cm,剂量率200 cGy/min,照射面积12 cm×10 cm,射野覆盖全细胞培养板。取照射后细胞500个/皿接种于细胞培养皿中,加入10 ml培养液混匀,培养至出现肉眼能清晰可见的细胞克隆(约2周),弃培养液,洗涤2次,甲醛固定细胞20 min,弃固定液,洗涤2次,吉姆萨染色30 min,清洗晾干后计数,细胞克隆数>50个时为有效菌落。细胞克隆形成率=(克隆数平均值/铺板细胞总数)×100%,细胞存活分数(survival fraction, SF)=(受照射细胞克隆形成率/对照细胞克隆形成率)×100%。根据单机多靶模型SF=1-(1-e-D/D0)N,拟合细胞存活曲线,计算放射增敏比(sensitization ratio,SER),其中D为放射线剂量,D0为平均致死剂量,Dq为准域剂量,N为外推数。
5.BTC实验测定细胞活性:收集转染后的SiHa细胞(si-con组、si-NEAT1组、si-NEAT1+anti-miR-con组、si-NEAT1+anti-miR-195组)以2×104/孔接种于96孔板中,经4 Gy 6 MV-X照射2 h,然后分别培养24、48、72 h。每孔加20 μl(5 mg/ml)BTC,继续培养4 h,弃去上清培养液。每孔加入150 μl二甲基亚砜,室温振荡5 min,酶标仪测定490 nm 处的吸光度(A)值。
6.双荧光素酶报告实验:将转染48 h后的SiHa细胞进行胰酶消化、计数,以1×104个细胞/孔接种于24孔板中,CO2培养箱中继续培养24 h ,若细胞融合度达到80%~90%,则按照Lipofectamine 2000说明书进行转染,分别共转染WT-NEAT1与miR-con或miR-195 mimics、MUT-NEAT1与miR-con或miR-195 mimics。转染12 h后,更换培养基。再培养24 h,收集细胞,加入配制好的裂解缓冲液,室温裂解15 min,离心收集上清,-20 ℃保存或直接检测。加入荧光素酶底物,发光仪检测荧光素酶活性。结果以萤火虫与海肾的荧光强度比值表示。
7.流式细胞术测定细胞凋亡率:转染后SiHa细胞(si-con组、si-NEAT1组、si-NEAT1+anti-miR-con组、si-NEAT1+anti-miR-195组)以2×104个/孔接种于6孔板,经4 Gy 6 MV-X照射2 h,然后培养72 h。弃去培养液,洗涤2次,胰酶消化,离心收集细胞。加200 μl结合缓冲液重悬细胞,再加入5 μl膜联蛋白V标记的异硫氰酸荧光素和5 μl碘化丙啶混匀,室温避光反应20 min,用流式细胞仪检测细胞凋亡率。
三、统计学分析
结 果
一、宫颈癌SiHa细胞中NEAT1和miR-195的表达
宫颈癌SiHa细胞中NEAT1的表达高于正常宫颈细胞Ect1/E6E7(P<0.05),而miR-195的表达低于Ect1/E6E7细胞(P<0.05)。见表1。
表1 人宫颈癌细胞中NEAT1和miR-195的表达
二、不同剂量的放射照射对宫颈癌SiHa细胞中NEAT1和miR-195表达的影响
与0 Gy组相比,(2、4、6、8 Gy)组照射的宫颈癌SiHa细胞中NEAT1表达量均显著升高(P<0.05),而miR-195的表达量均显著下降(P<0.05);而正常宫颈细胞Ect1/E6E7经照射后细胞中NEAT1和miR-195的表达量均无显著变化(P>0.05),见表2。选择有显著差异且对SiHa细胞伤害小的照射剂量4 Gy进行后续实验。
表2 不同剂量的放射照射对宫颈癌SiHa细胞中NEAT1和miR-195表达的影响
三、NEAT1靶向调控miR-195的表达
Targetscan软件预测结果显示,NEAT1与miR-195存在互补的核苷酸序列,见图1。双荧光素酶报告系统结果如表3所示,共转染miR-con与WT-NEAT1的细胞比较,共转染miR-195与WT-NEAT1的荧光素酶活性显著下降(P<0.05);而共转染miR-con与MUT-NEAT1的细胞比较,共转染miR-195与MUT-NEAT1的荧光素酶活性没有明显变化。RT-qPCR结果显示,与si-con组相比,si-NEAT1组miR-195表达量显著上升(P<0.05);与pcDNA组相比,pcDNA-NEAT1组miR-195表达量均显著下降(P<0.05),见表4。说明NEAT1靶向负调控miR-195的表达。
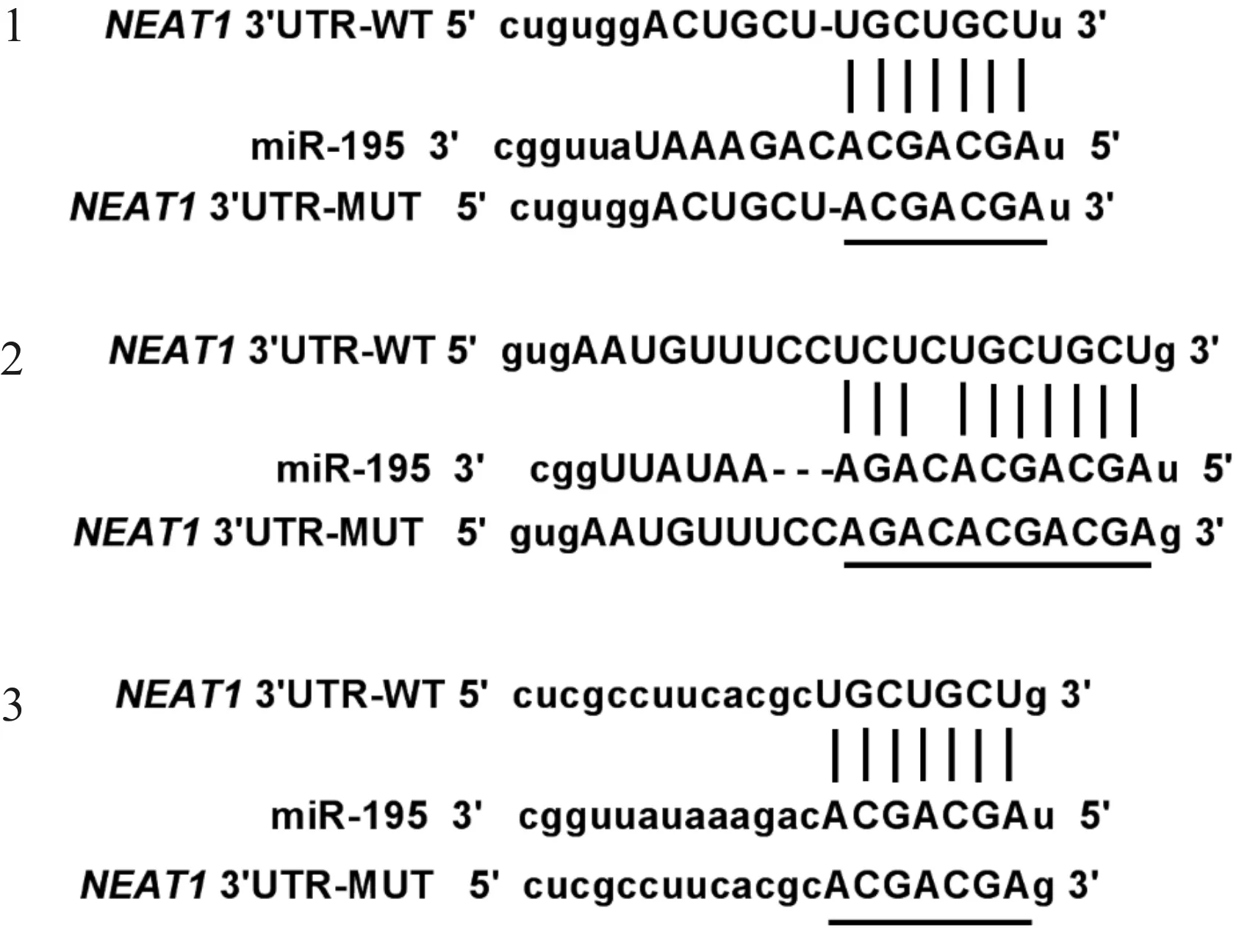
图1 NEAT1与miR-195互补的核苷酸序列
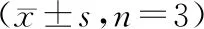
表3 双荧光素酶报告实验
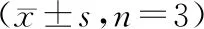
表4 NEAT1调控miR-195的表达
四、抑制NEAT1表达和敲除miR-195对宫颈癌细胞放射敏感性的影响
克隆形成实验结果表明,随着照射剂量的增加,与si-con组相比,si-NEAT1组SiHa的细胞存活分数逐渐下降,且差异显著(P<0.05,图2),放射增敏比为1.45(表5);与si-NEAT1+anti-miR-con组相比,si-NEAT1+anti-miR-195组SiHa的细胞存活分数逐渐升高,且差异显著(P<0.05)(图2),放射增敏比为0.66(表5)。表明抑制NEAT1表达可增加宫颈癌SiHa细胞的放射敏感性,敲除miR-195则会逆转抑制NEAT1表达对SiHa细胞的放射敏感性。

注:与si-con组比较,*P<0.05; 与si-NEAT1+anti-miR-con组比较,#P<0.05图2 不同剂量放射下各组宫颈癌细胞生存曲线
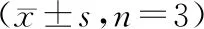
表5 抑制NEAT1表达和敲除miR-195宫颈癌细胞放射后单击多靶模型拟合的参数值
五、抑制NEAT1表达和敲除miR-195对放射照射(4 Gy)后宫颈癌细胞增殖的影响
BTC结果显示(表6),在48 h和72 h时,与si-con组相比,si-NEAT1组SiHa的细胞增殖活性逐渐下降,且差异显著(P<0.05);与si-NEAT1+anti-miR-con组相比,si-NEAT1+anti-miR-195组SiHa的细胞存活分数逐渐升高,且差异显著(P<0.05)。说明抑制NEAT1表达可抑制宫颈癌SiHa细胞增殖,敲除miR-195则会逆转抑制NEAT1表达对SiHa细胞的增殖抑制作用。
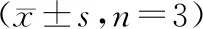
表6 抑制NEAT1表达和敲除miR-195对放射照射(4 Gy)后宫颈癌细胞增殖的影响
六、抑制NEAT1表达和敲除miR-195对放射照射(4 Gy)后宫颈癌细胞凋亡的影响
流式细胞术结果显示(表7),与si-con组相比,si-NEAT1组SiHa的细胞凋亡率显著升高(P<0.05);与si-NEAT1+anti-miR-con组相比,si-NEAT1+anti-miR-195组SiHa的细胞凋亡率显著下降(P<0.05)。说明抑制NEAT1表达可诱导宫颈癌SiHa细胞凋亡,敲除miR-195则会逆转抑制NEAT1表达对SiHa细胞凋亡的诱导作用。
表7 抑制NEAT1表达和敲除miR-195对放射照射(4 Gy)后宫颈癌细胞凋亡的影响
讨 论
本研究结果显示,宫颈癌组织及放射线处理的宫颈癌SiHa细胞中NEAT1表达升高,抑制NEAT1表达的宫颈癌SiHa细胞经不同放射线处理后,细胞存活分数降低,增敏比为1.45,同时增殖能力降低,凋亡加剧,说明抑制NEAT1表达可增强SiHa细胞放射敏感性。NEAT1属于lncRNA家族成员,参与多种肿瘤的发展进程。Guo等[12]研究发现,NEAT1在宫颈癌组织中表达上调,促进细胞增殖,抑制NEAT1可通过调节Akt/PI3K信号通路抑制宫颈癌细胞增殖和侵袭,且促进细胞凋亡。Han等[13]研究发现,NEAT1在宫颈癌组织及抗辐射细胞系中表达上调,抑制NEAT1可抑制癌细胞增殖,诱导癌细胞凋亡,NEAT1通过靶向结合miR-193b-3p上调细胞周期蛋白D1的表达,从而增强宫颈癌的放射敏感性。这些报道结果与本文的研究结果相一致,提示NEAT1有可能成为增强宫颈癌细胞放射敏感性的分子靶点。
为了进一步探究NEAT1影响宫颈癌细胞放射敏感性的分子机制,本研究证实了NEAT1可靶向结合miR-195;同时抑制NEAT1可促进宫颈癌细胞中miR-195的表达,而上调NEAT1则抑制miR-195的表达,说明NEAT1靶向结合并负调控miR-195。miR-195参与多种肿瘤的发展进程及肿瘤细胞的放射敏感性。研究显示[14],miR-195在耐5-氟尿嘧啶胃癌细胞中表达下调,上调其表达可增强耐5-氟尿嘧啶胃癌细胞对5-氟的敏感性;miR-195在放射处理的乳腺癌细胞中表达下调,miR-195的过表达可能通过下调BCL-2促进细胞凋亡,增强乳腺癌MCF-7细胞的放射敏感性[15]。桂云等[16]发现,miR-195在宫颈癌组织或血清样本中表达下调,这与本研究宫颈癌SiHa细胞中miR-195的表达低于正常宫颈细胞的结果一致。本研究还表明,miR-195在放射处理的SiHa细胞中表达显著下调,敲除miR-195则会逆转抑制NEAT1表达对SiHa细胞放射敏感性的影响,说明NEAT1可能通过靶向负调控miR-195来影响SiHa细胞的放射敏感性。
综上,放射线处理可促进宫颈癌细胞中NEAT1的表达,而抑制NEAT1表达可阻碍宫颈癌SiHa细胞增殖,并促进细胞凋亡,增强SiHa细胞的放射敏感性,其作用机制可能与靶向负调控miR-195表达有关,NEAT1可能为提高宫颈癌放射治疗效率提供新的治疗靶点。
