TIPS联合TACE序贯热消融治疗门静脉高压症合并肝细胞癌疗效分析
2021-09-29李建军朱桐杨晓珍生守鹏张永宏郑加生
李建军 朱桐 杨晓珍 生守鹏 张永宏 郑加生
门静脉高压症是肝硬化疾病进展的一种终末阶段,可出现食管胃静脉曲张破裂出血、腹腔积液等并发症[1-2],严重影响人类健康。经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt,TIPS)是治疗门静脉高压所致食管胃静脉曲张破裂出血及顽固性腹腔积液等并发症的一种有效的微创治疗方法[3-5]。肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)联合热消融治疗肝细胞癌也被广泛应用[6-7]。TIPS联合TACE序贯热消融治疗门静脉高压症合并肝细胞癌尚未见报道。本文总结了22例门静脉高压症合并肝细胞癌患者应用TIPS联合TACE序贯热消融治疗的临床资料,旨在评价上述联合治疗的安全性及有效性。
资料与方法
一、基本资料
收集2015年6月至2019年3月在我院行TIPS治疗的176例肝硬化门静脉高压患者资料,其中22例合并肝细胞癌。所有病例在TIPS术前均经胃镜检查和CT/MR平扫+增强检查确诊为食管胃静脉曲张。本组病例TIPS术入选标准为年龄≥18岁,同时出现以下情况之一:(1)急性食管胃静脉曲张出血经药物和(或)内镜治疗无效者;(2)食管胃静脉曲张反复出血经药物和(或)内镜治疗复发者;(3)顽固性腹腔积液。TIPS术排除标准:(1)门静脉海绵样变;(2)弥漫性肝癌;(3)合并心、肝、肺、肾或血液系统等严重的器官功能障碍;(4)对比剂过敏。所有患者肝细胞癌诊断均符合《原发性肝癌诊疗规范(2017版)》[8]的诊断标准。依据巴塞罗那肝癌标准(Barcelona clinic liver cancer,BCLC)进行肝癌分期[9]。TACE和热消融的适应证和禁忌证符合相应的指南和专家共识[10-12]。22例肝癌患者中,11例是在行TIPS治疗前已明确诊断为肝癌,并已行TACE序贯热消融治疗;11例是在TIPS治疗同期发现或在随访中进展为肝癌,然后再行TACE序贯热消融治疗。
二、治疗方法
(一)TIPS
先于右股动脉置入5 F血管鞘,经鞘送入Cobra 2导管于肠系膜上动脉行间接门静脉正、侧位造影;穿刺右侧颈内静脉,送入RUPS 100,将金标猪尾测量导管置于下腔静脉测压;穿刺门静脉左支或右支成功后,送入直头导管测量门静脉压力,并行直接门静脉正、侧位造影;送入Cobra 2导管用游离弹簧圈(COOK,美国)和/或可控弹簧圈(Boston Scientific,美国)栓塞胃冠状静脉、胃短静脉等侧支循环;用球囊导管(8 mm×60 mm)扩张分流道,然后于分流道内植入直径8 mm覆膜支架;送入金标猪尾测量导管再次测量门静脉压力,并行直接门静脉正、侧位造影;最后将金标猪尾测量导管置于下腔静脉测压,计算门静脉压力梯度(portal pressure gradient,PPG)变化情况(图1A、1B)。
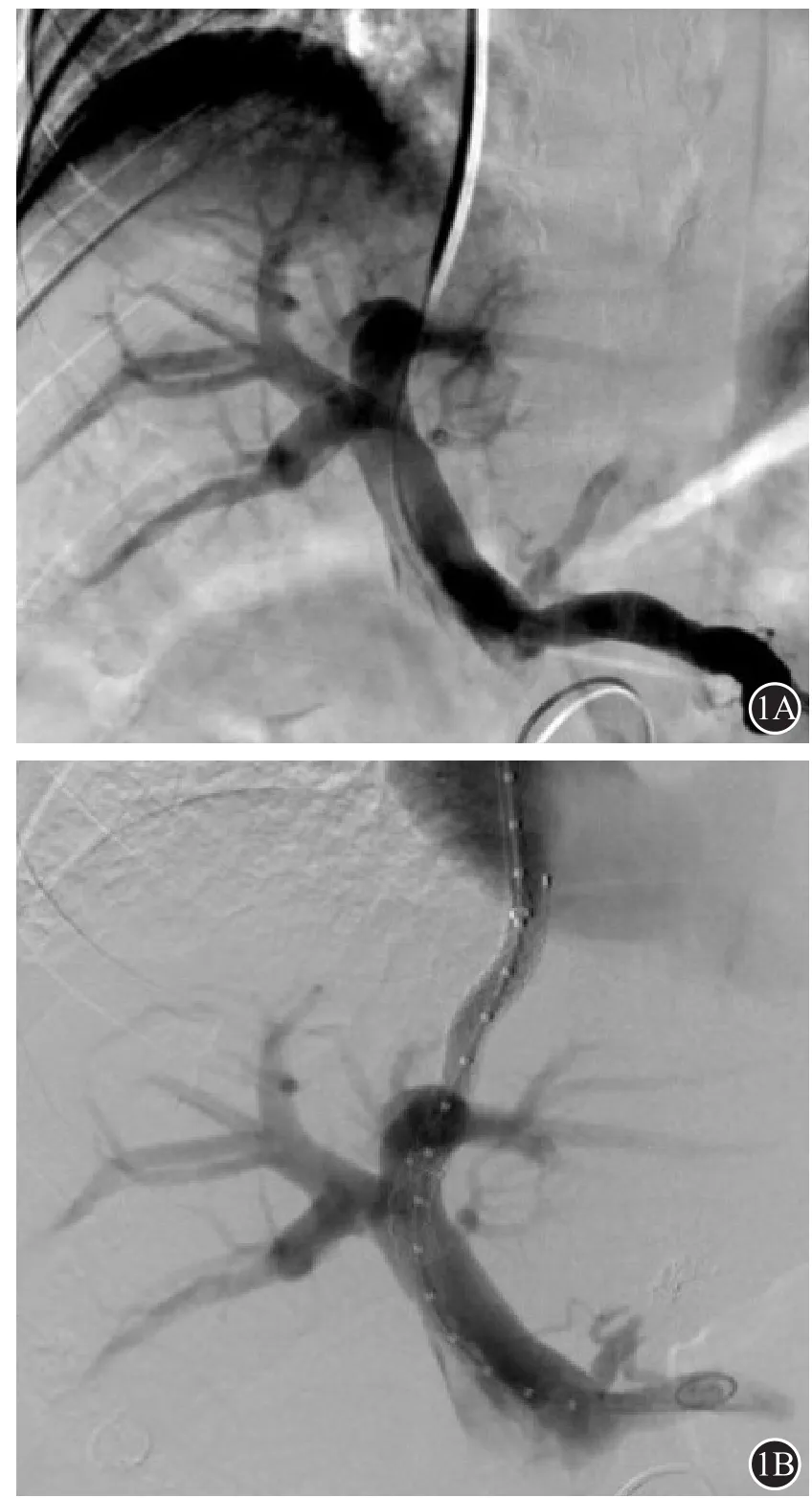
图1 54岁男性,反复上消化道出血,行TIPS治疗
(二)TACE
先用5 F猪尾导管行腹主动脉造影,了解肝的血管解剖及变异。用5 F肝管行肝动脉造影后,超选择至肿瘤供养血管。如果肝血管迂曲、纤细则用微导管超选择至肿瘤供养血管。先常规注入化疗药5-氟尿嘧啶500~1 000 mg,羟基喜树碱10~20 mg,吡柔比星10~40 mg,药物剂量根据患者的白细胞及血小板计数和肝功能等情况决定。然后根据肿瘤的大小、血供及肝功能情况用超液态碘化油(法国加柏公司)和明胶海绵颗粒(350~560 μm,杭州艾力康医药科技有限公司)栓塞肿瘤供养血管。最后再次造影证实肿瘤血管是否闭塞。部分脾功能亢进致血小板减少患者(血小板计数<50×109/L),为减少热消融治疗的出血风险,在TACE治疗同时行部分脾动脉栓塞术。
(三)CT引导下热消融治疗
先行CT扫描(Activion16排CT,日本TOSHIBA公司),确认肿瘤位置,并确定穿刺方向、角度及进针深度。常规消毒铺巾后,2%利多卡因局部麻醉,用22 G的Chiba针作为导引针穿刺入消融靶点部位,重复CT扫描,射频电极针(Cooltip冷循环射频消融治疗系统,美国Covidien公司)或微波天线(南京维京九洲医疗器械研发中心)沿导引针穿刺逐步进入消融靶点部位,CT扫描确定电极针或微波天线位于消融靶点区后进行热消融治疗。根据肿瘤的位置及大小和使用的射频电极或微波天线选择消融参数。根据肿瘤大小,消融时采用单点或多点叠加消融的方法确保消融范围覆盖肿瘤全部。治疗完毕,行针道止血后行即刻增强CT扫描查看治疗效果,并确定有无肝包膜下出血及气胸等并发症发生(图2A~2C)。
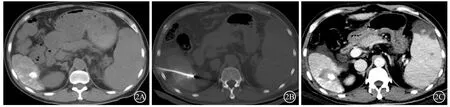
图2 图1患者肝脏CT
三、随访及疗效评价
1.记录围手术期(TACE、热消融或TIPS术后1个月)严重并发症发生情况,术后每2~3个月对患者进行随访,随访终点为患者死亡,截止时间为2019年12月25日。
2.采用CT或MRI平扫+增强评估肿瘤活性,并应用实体瘤疗效评价标准[13](modified response evaluation criteria in solid tumors,mRECIST)进行疗效评估。
3.记录患者肝功能中血清总胆红素和白蛋白情况,参考Johnson等[14]的研究计算方法白蛋白-胆红素(albumin-bilirubin,ALBI)评分,A组记录时间点为TIPS术前1周内和术后3个月,B组记录时间点为TACE序贯热消融术前1周内和术后3个月。
4.TIPS术后每3个月定期复查肝脏平扫+增强CT和肝脏血管彩超。同时,记录患者肝性脑病、消化道再出血及顽固性腹水等门静脉高压并发症、分流道狭窄/闭塞、肿瘤进展及生存情况。患者总生存时间定义为接受第1次TACE序贯热消融治疗之后的生存时间。累积分流道通畅率定义为TIPS术后分流道初始通畅率。
四、统计学分析
应用SPSS 19.0统计软件进行数据处理。计量资料采用中位数(范围)或均数±标准差(±s)表示,配对计量资料比较采用配对t检验,计数资料采用率或构成比表示。采用Kaplan-Meier方法计算累积无门脉高压并发症发生率、累积分流道通畅率、无进展生存期(progression free survival,PFS)及总生存期(overall survival,OS),组间比较采用Log-rank检验。P<0.05为差异有统计学意义。
结 果
22例患者均为男性,中位年龄59(40~72)岁。肝硬化原因分别是:17例为乙肝肝硬化;5例为酒精性肝硬化。门静脉高压的并发症分别是:12例患者为食管胃静脉曲张破裂出血;9例为食管胃静脉曲张破裂出血合并腹腔积液;1例为顽固性腹腔积液。22例肝癌患者中有1例伴有门静脉右后分支癌栓,无肝外转移。患者病例特点见表1。
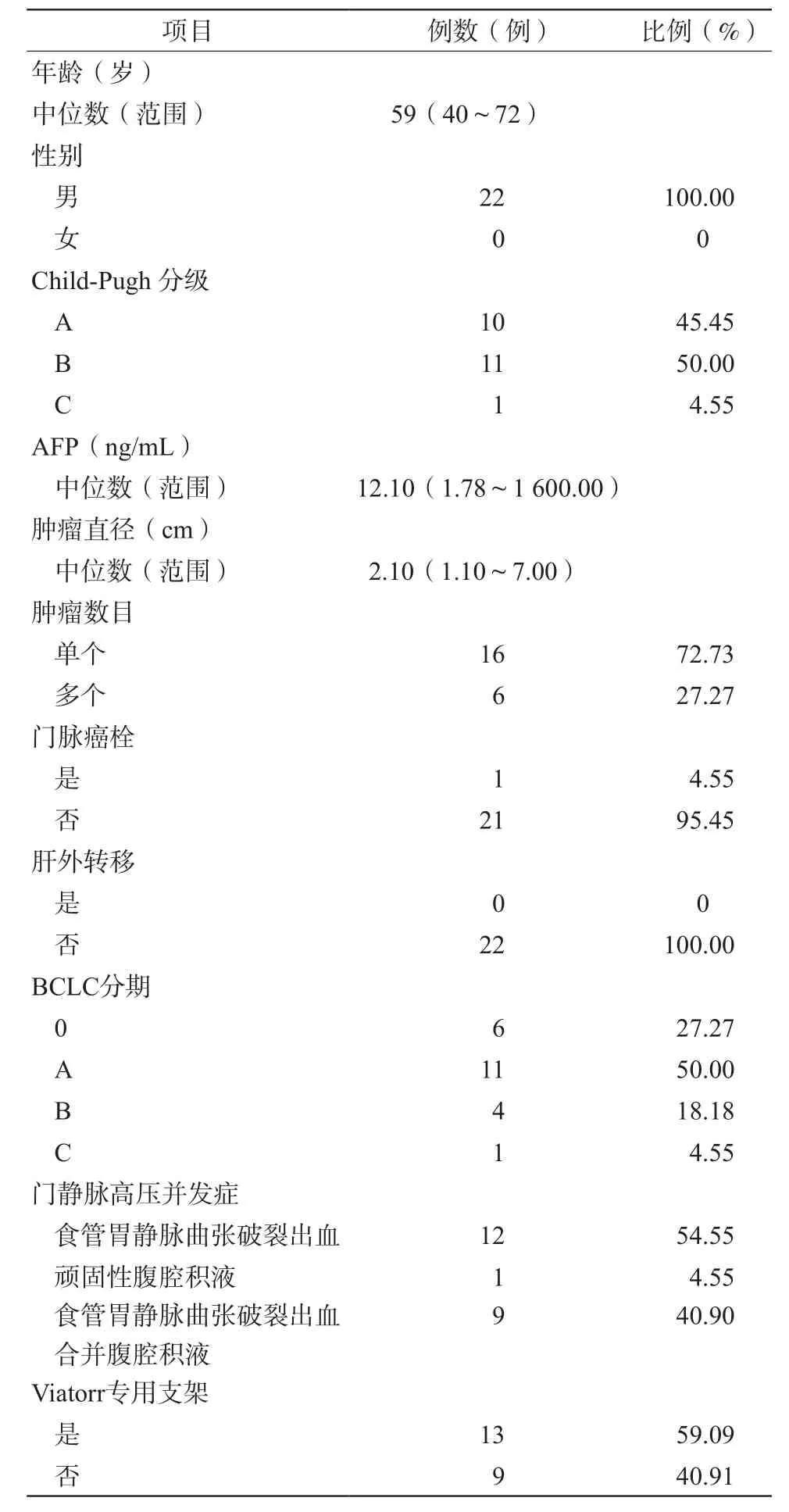
表1 22例患者的一般资料
根据TIPS和TACE序贯热消融治疗的时间先后,将患者分为A组(TIPS术前行TACE序贯热消融组)和B组(TIPS术后行TACE序贯热消融组)。A、B组分别为11例。A组中,在行TIPS术前,肝癌病史中位时间为60个月(4~120个月);B组中,6例在行TIPS术前检查同时发现肝癌,5例为在TIPS术后随访期间发现肝癌(2~41个月)。
22例患者TIPS手术均成功。所有分流道均采用直径8 mm的聚四氟乙烯覆膜支架建立,其中,采用Viatorr(GORE,美国)专用支架比例为59.09%(13/22),余下9例采用Fluency-Plus(BARD,美国)覆膜支架联合E-Luminexx(BARD,美国)裸支架建立分流道(因Viatorr专用支架此前未在中国上市)。
一、A组与B组肝功能变化情况
A组TIPS术后血清总胆红素较前术前明显升高(t=-3.76,P<0.01);血清白蛋白较术前稍升高,差异无统计学意义(t=-0.84,P=0.43);ALBI较术前稍升高,差异无统计学意义(t=-0.06,P=0.96);见表 2。
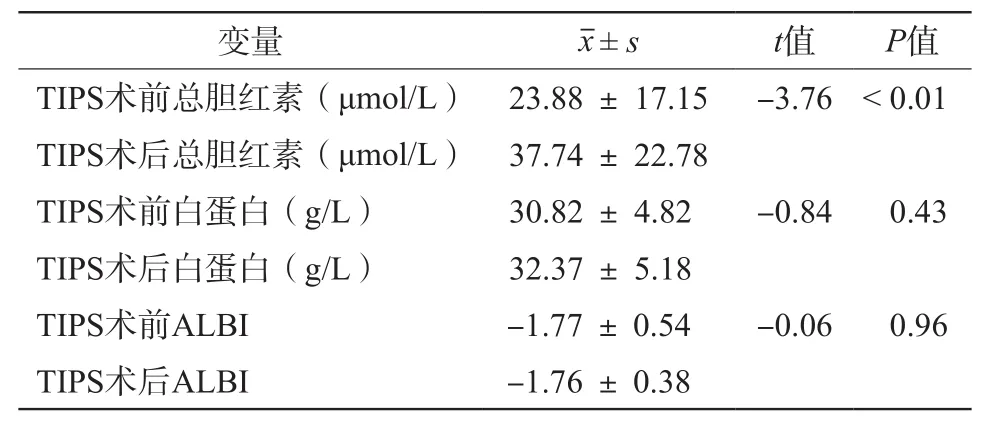
表2 A组TIPS术前、术后血清总胆红素、白蛋白和ALBI变化情况
B组TACE序贯热消融术后血清总胆红素、白蛋白和ALBI均较术前变化不明显,差异无统计学意义(t值分别为-1.68、1.24和-1.54,P值分别为0.13、0.25 和 0.16),见表 3。
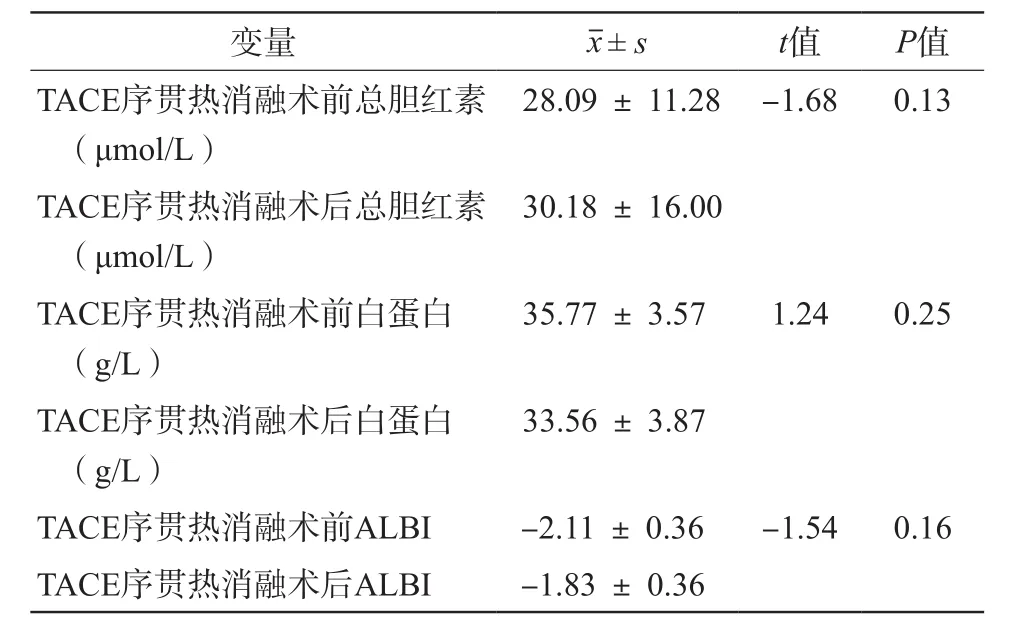
表3 B组TACE序贯热消融术前、术后血清总胆红素、白蛋白和ALBI变化情况
二、门静脉压力梯度变化情况
TIPS术前PPG为(19.62±5.77)mmHg,术后PPG为(8.40±3.38)mmHg,术后PPG较术前明显下降(t=8.77,P<0.01)。
三、肝性脑病发生情况
TIPS术后肝性脑病发生率为27.27%(6/22),其中4例为肝性脑病2期,2例为肝性脑病3期。5例患者通过调整蛋白饮食、乳果糖通便及门冬氨酸鸟氨酸等内科保守治疗后恢复;1例患者因多次发生肝性脑病,行分流道限流术后未再发生。
四、TIPS术后门脉高压并发症及分流道通畅情况
患者TIPS术后共发生消化道再出血2例,TIPS术后3个月和6个月累积无门脉高压并发症发生率分别为95.24%和90.48%(图3)。
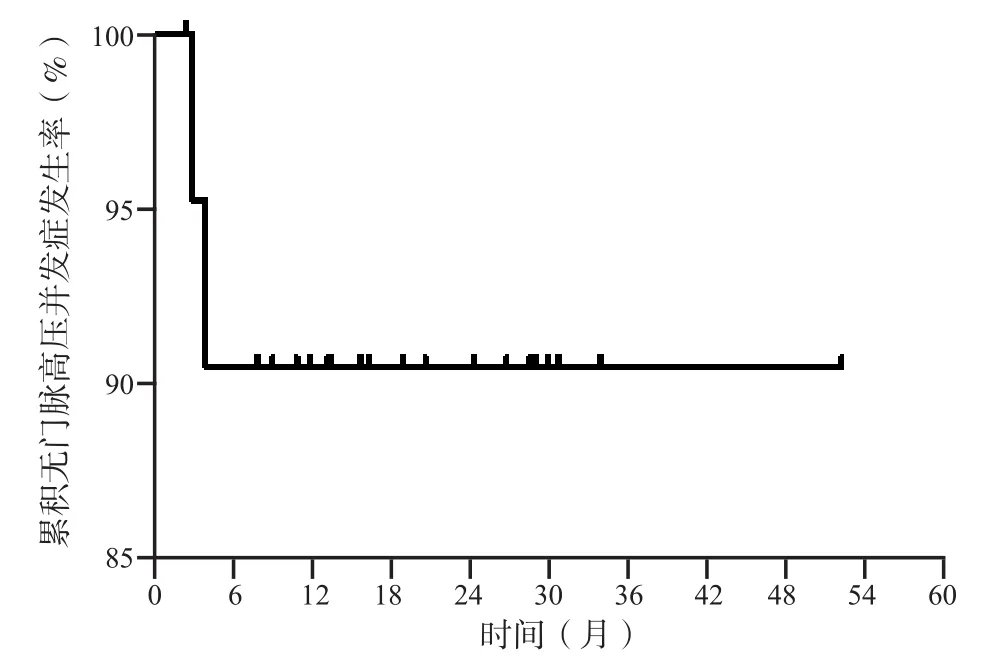
图3 22例患者的累积无门脉高压并发症发生率
患者TIPS术后12个月和24个月累积分流道通畅率分别为83.57%和54.70%(图4)。其中,Viatorr专用支架组和非Viatorr专用支架组TIPS术后1年累积分流道通畅率分别为85.71%和60.00%,差异有统计学意义(χ2=4.46,P=0.035)。

图4 22例患者的累积分流道通畅率
五、围手术期并发症发生情况
所有患者无围手术期严重并发症发生,围手术期死亡率为0。
六、PFS和累积生存率情况
TACE序贯热消融术后12、24和60个月PFS率分 别 为61.30%、43.78%和10.95%,中 位PFS为20.6个月。第1次TACE序贯热消融术后中位随访时间为25.9(10.4~127.5)个月,随访期间共有5名患者死亡,其中2例患者分别于TACE序贯热消融术后11和70.7个月死于肿瘤进展后的肝功能衰竭,3例分别于TACE序贯热消融术后24、28.2和95个月死于肿瘤终末期。TACE序贯热消融术后12、24和60个月OS率分别为95.24%、87.91%和79.12%,中位OS为95.0个月(图5)。
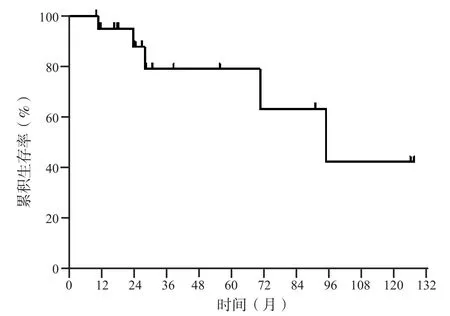
图5 22例患者的累积生存率
讨 论
TACE广泛应用于肝功能储备较好的不能手术切除肝癌患者的姑息性治疗,可显著延长患者生存期[8-9]。消融治疗(包括射频消融、微波消融等)目前已成为小肝癌的根治性治疗手段之一,通常适用于直径≤5 cm单发肿瘤或肿瘤数目≤3个,且每个直径≤3 cm的患者[8]。对于不能手术切除的直径3~7 cm的单发肿瘤或多发肿瘤,可TACE联合消融治疗[7-8]。得益于肝脏拥有肝动脉及门静脉2套血供系统,TACE栓塞供应肿瘤的肝动脉时,门静脉血流仍然能够供应残余肝组织[15]。由于将部分门静脉血流分流至体循环,TIPS可导致肝内门静脉灌注减少。因此,TIPS联合TACE治疗对于肝脏血供可能存在潜在影响。目前关于TIPS联合TACE治疗安全性和有效性的研究报道的结果不尽相同[16-17],少见报道TIPS联合TACE序贯热消融治疗门静脉高压症合并肝癌的安全性和有效性。
Kang等[16]回顾性分析了20例接受TIPS及选择性TACE治疗的肝癌患者的资料,只有1例发生了自发性细菌性腹膜炎,TACE相关严重并发症发生率为5.0%(1/20),同时,TACE术后30 d内并未发生患者死亡,其结论认为选择性TACE对于接受TIPS治疗的肝癌患者是安全的。但是,其他研究观点不尽相同[17-18]。Miura等[17]回顾性分析16例TACE联合TIPS治疗肝癌的患者资料,结果表明TACE术后3级及以上的并发症的发生率为11.1%,因此,作者认为对于接受TIPS治疗的肝癌患者TACE术后并发症发生率可能更高。本研究表明,仅A组TIPS术后血清总胆红素较前术前明显升高,余肝功能指标术前与术后比较差异无统计学意义。尽管TIPS术后血清总胆红素较前术前升高,但是升高的幅度不大。因此,本研究认为TIPS联合TACE序贯热消融治疗并未对门静脉高压症合并肝癌患者肝功能造成严重影响,联合治疗是安全的。
本研究的创新点在于TACE序贯热消融治疗肝癌。一项随机对照研究表明,对于中等直径(3.1~5.0 cm)的肝癌TACE联合射频消融术后3年的局部进展率及OS均优于单独行射频消融治疗[19]。同时,研究显示微波消融与射频消融之间无论是在局部疗效和并发症方面,还是生存率方面都无统计学差异[20]。本研究中患者的60个月OS可媲美于外科手术切除,多项大型回顾性研究及荟萃分析显示,外科切除肝癌患者的60个月生存率为40%,对肝功能较好的早期肝癌患者,其60个月生存率为60%[21]。热消融治疗前行TACE治疗可减少射频消融时热沉降效应、缩小肿瘤直径、导引作用、减少漏诊率及减少穿刺出血率等优势。
本研究中Viatorr专用支架的通畅性高亦得到其他研究的证实,Saad等[22]的回顾性研究比较了Fluency支架与Viatorr支架行TIPS手术的疗效,其中,Fluency支架组术后6、9、12个月的分流道初次通畅率分别为87%、81%及81%,而Viatorr支架组术后6、9、12个月的分流道初次通畅率分别为95%、93%及89%,差别有统计学意义。
综上所述,TIPS联合TACE序贯热消融治疗门静脉高压症合并肝癌是安全、有效的。
