高强度运动对摔跤运动员体成分及肠道菌群的影响
2021-09-28宋韡汤丽群张根生徐璐高帆
宋韡 汤丽群 张根生 徐璐 高帆
摘 要:目的:探究高强度运动对摔跤运动员体成分改变及肠道菌的影响。方法:对招募的30名长期参加系统性摔跤训练的运动员进行为期4周高强度间歇性专项训练,分别于运动干预阶段前后测试体成分并采集粪便。粪便经质检后提纯DNA样品,16SrRNA基因V4区进行PCR扩增并完成建库;利用HiSeq平台进行测序分析,将聚类生成的OTU比对数据库完成物种注释、多样性分析及功能预测。结果:高强度运动干预后,运动员体重、BMI(身体质量指数)和体脂率显著降低;摔跤运动员肠道菌多样性增加不显著,体内拟杆菌门(Bacteroidetes)拟杆菌属(Bacteroides)为优势菌,且拟杆菌与厚壁菌门(Firmicutes)比值增加,但柔嫩梭菌属(Faecalibacterium)和双歧杆菌属(Bifidobacterium)丰度显著降低。功能基因预测显示,机体经过高强度运动,物质代谢反应和免疫能力增强,心血管疾病风险降低。
关键词:
高强度运动;体成分; 肠道菌群;16SrRNA
中图分类号:G804
文献标识码:A
文章编号:1008-2808(2021)05-0089-08
Abstract:
The purpose of the study is to explore the influence on body composition and intestinal bacteria of wrestlers with high intensity exercise.Research method: In this study, thirty wrestlers who have been taking part in systematic sports training for a long period of time were recruited. They were trained for four weeks with medium intensity and another four weeks with high intensity intermittently. During this testing period, their body composition was tested, as well as their feces samples were collected at different stages of sports intervention. After quality inspection, DNA samples were purified, 16SrRNA Gene V4 region was amplified by PCR methods and the database was established. This research select the HiSeq platform for sequencing, by comparing the OTU (generated by clustering) and database was used for species annotation, sample diversity analysis and function prediction. The results show that after the intervention of high-intensity exercise, the body weight, BMI index and body fat rate of selected athletes were significantly reduced, while the diversity of intestinal bacteria was not significantly increased. Specifically, Bacteroides which is belong to Bacteroidetesare is the dominant bacteria. The ratio of Bacteroides to Firmicutes increased. While Faecalibacterium and Bifidobacterium are significantly undermined. The prediction of functional genes showed that after high-intensity exercise, the response of body metabolism and immune ability were enhanced.
Key words:
High-intensity exercise;Body composition;Gut microbiota;16SrRNA
人体肠道内生存着1 000~1 500种不同类型的菌种,数量高达10[1],且因其具有人体150倍之多的微生物编碼基因数而被称为人体“第二基因库”[2]。定植于人体消化道内的菌群通过其物种结构与多样性影响人体代谢过程、机体免疫和神经调节[3]。如肠道菌利用膳食纤维发酵产生短链脂肪酸,与G蛋白耦联受体结合,抑制脂肪沉积,参与甘油三酯的代谢过程[4],此外短链脂肪酸可刺激肠内分泌肠源性5羟色胺,影响肠道传出神经的兴奋性[1]。但受宿主年龄、饮食结构、生活方式和遗传背景等内外因素的影响,肠道菌呈现出较大的差异性[2]。运动作为独立的外界环境刺激,对宿主各项生理机能和机体稳态调节具有积极有效的作用[5]。宿主经长期自主运动,肠道微生物组成于不运动条件下有明显不同[6]。研究显示,与久坐不动相比,运动可以刺激肠道菌群产生更强烈的改变,在促进代谢、降低脂肪组织炎症、减轻体重中发挥重要作用[7]。
随着国内外运动训练的科学化发展,运动方式不再局限于单纯的有氧运动,高强度间歇训练已逐渐成为成年人运动的有效方式之一[8]。据相关文献报道,高強度间歇运动更能高效动员机体各项生理机能,有望成为有氧运动的替代之选[9]。人体对不同运动强度和运动方式具有相应的应激性生理反应,肠道菌群也将随之发生变化[10]。目前,国内外学者达成的暂时性共识是:对于普通人群,运动可以提高机体新陈代谢水平,提高肠道菌群多样性,增加有益菌,抑制有害菌。研究显示,自主运动或被动运动[11]、高强度或低强度运动[12],以及长时间或短时间运动都对宿主肠道菌群结构及分布产生影响。随着人体肠道菌群的结构和多样性变化,肠道微生态环境随之改变,内环境稳态也相应调节[13],包括调节机体的新陈代谢和免疫能力等[14]。金泽宇等(2019年)对不同人群的肠道菌群宏基因组研究显示[15],运动员与同龄普通人群相比,肠道菌群在结构和代谢通路上存在较大差异,且长期参加运动的人群,肠道菌群多样性明显高于久坐人群。然而,针对专业的运动员,不同的运动强度尤其是高运动强度训练对其肠道菌群的相关研究迄今为止仍然很少。本研究对长期参加训练的摔跤运动员展开调查,通过分析高强度运动干预前后体成分、肠道菌群变化的情况,探讨高强度运动对运动员减脂降体重,以及肠道菌稳定性及多样性的影响。研究结果将为指导运动员科学训练,健康协调发展提供数据支持。
1 研究对象与方法
1.1 研究对象
筛选30名省级摔跤运动员,其中22男8女,均为二级以上运动员,年龄为男性17.73±2.30岁,女性19.42±9.22岁;专项训练年限为男性7.17±2.81年,女性8.00±2.12年;身高为男性1.75±0.05,女性1.70±0.07m;体重为男性77.65±12.98kg,女性72.71±10.79。纳入标准:具有长期参加常规摔跤专项训练经历,饮食结构一致;排除标准:近期有伤病发生,不适宜进行高强度运动,近半年来服用过抗生素类药物,发生过腹泻便秘等胃肠疾病,收集样本时使用过甘油等通便药物。
1.2 测试方法
1.2.1 运动强度
受试者参加日常中等强度的摔跤专项技术及体能训练(70%~80%VO2max);之后参加为期4周的高强度间歇性训练(80%~90%VO2max)。
1.2.2 体成分测试
采用”TANITA MC-980MA体成分仪分别在不同强度训练阶段对运动员进行测试[16],电脑自动分析并记录体重、身体质量指数(BMI)、体脂率(%)、水分率(%)、肌肉量(kg)。
1.2.3 样本采集
分别于高强度间歇性运动干预前和高强度运动干预时期的第四周采集粪便,装入粪便保存液(上海微基生物)转至-80℃冰箱保存。同一天进行体成分测试、采集粪便工作。
1.2.4 样本测序
取实验对象的粪便保存液进行质检,合格样品30ng,与融合引物配置成PCR反应体系,进行PCR扩增,采用Agencourt AMPure XP磁珠纯化PCR扩增产物,溶于Elution Buffer中,完成建库。使用Aglient 2100 Bioanalyzer 对文库片段范围、浓度进行检测。将合格的文库根据插入片段的大小,选择HiSeq[17]平台进行测序(华大基因完成测序)。
1.2.5 数据分析
利用USEARCH(ver. 7.0.1090)将tags[5]聚类为相似度达97%的OTUs[18],并绘制OTU Venn图。基于贝叶斯算法,利用RDP classiffer工具进行物种组成分析[19],绘制物种丰度柱状图。Picrust[20]软件根据KEGG数据库比对OTU功能基因,并采用Wilcox检验各组间的差异功能。采用SPSS2 3.0处理配对样本T检验。
2 研究结果
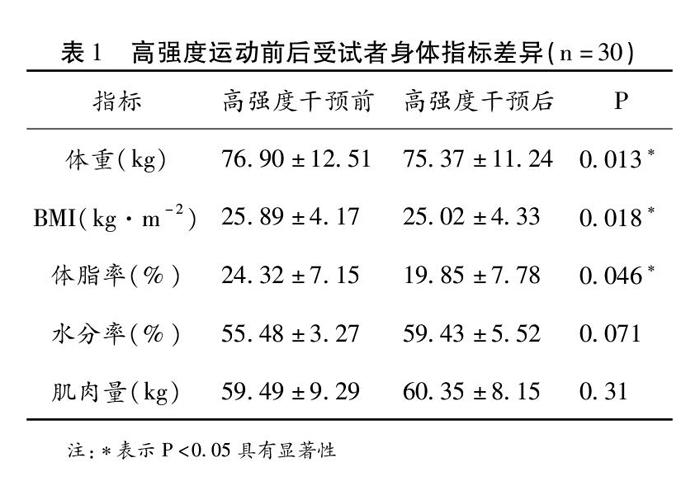
2.1 高强度运动干预对运动员体重及体成分的影响
对30位摔跤运动员体重及体成分测试结果进
行配对样本T检验分析(见表1),运动员在高强度运动干预前(以中等强度运动为主)和高强度运动阶段呈现明显的差异,受试者的体重、BMI(身体质量指数)和体脂率在高强度运动干预后呈显著性降低,水分率和肌肉量的变化无显著性。
2.2 高强度运动对运动员肠道菌群的影响
2.2.1 肠道样本高通量测序及多样性
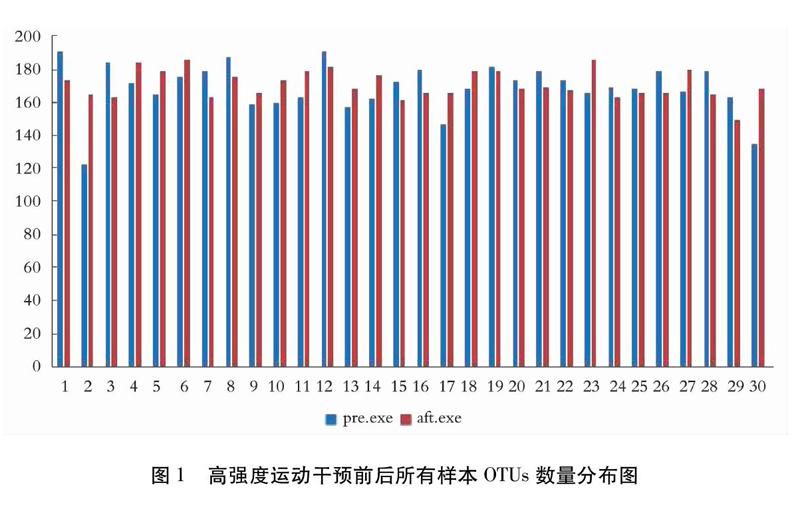
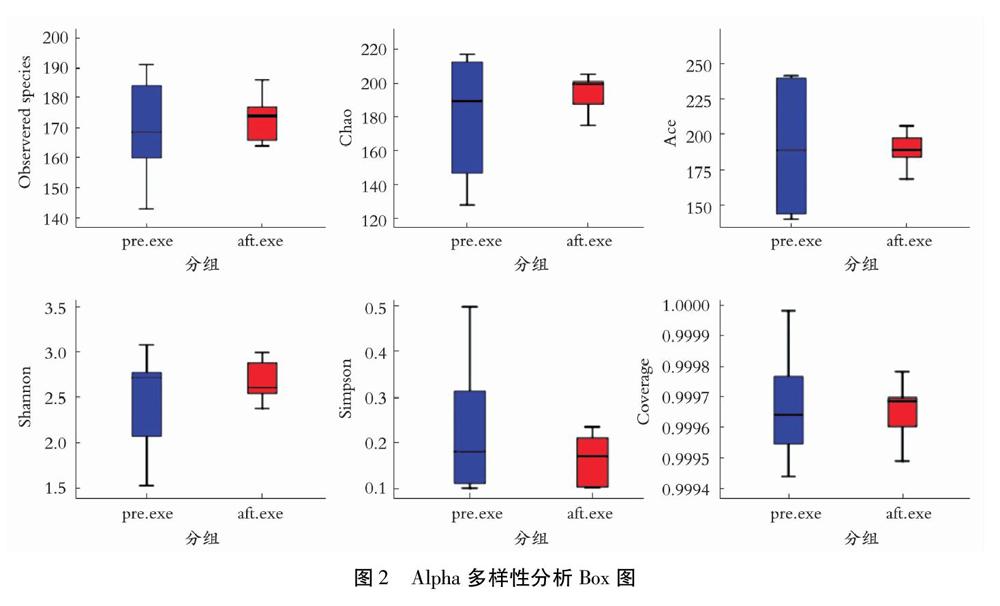
所有肠道样本共得到3,867,885条tags,按照97%的序列相似度可聚类成1 357条OTUs。由图1可知,不同受试者的OTU数量各不相同,且在高强度运动干预前后,受试者OTU变化情况也存在较大的差异。其中16名受试者OTU数量表现为下降,其余数值增加。结合Alpha多样性指数值分析(见图2),在高强度运动干预后,受试者肠道菌群中OTU数量增多,其余shannon指数,simpson指数以及ace指数变化均无统计学意义(P>0.05),表明高强度运动干预后,受试者肠道菌群多样性无显著性改变。
2.2.2 肠道菌群组成及差异
采用基于贝叶斯算法的RPD classifier对OTU代表序列进行分类学鉴定,并在门纲目科属种水平上统计样本物种组成,其中物种丰度小于0.5%的归属其它待鉴定类(others)。由图3a可知,运动员肠道菌群中拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)为主要菌群;经高强度运动干预后样本的菌群结构发生变化(图3b),高强度运动下受试者厚壁菌门丰度显著降低(P<0.05),而变形菌门丰度表现为显著增加(P<0.01);虽然拟杆菌门在各样本中仍处于优势菌种地位,但高强度运动后该菌种丰度增加并不显著。
受试者肠道菌群中,鉴定出细菌71个科,见图4a。其中拟杆菌科(Bacteroidaceae)、普雷沃氏菌科(Prevotellaceae)、毛螺菌科(Lachnospiraceae)、疣微菌科(Ruminococcaceae)、產碱菌科(Alcaligenaceae)、双歧杆菌科(Bifidobacteriaceae)以及韦荣氏菌科(Veillonellaceae)为优势菌群。物种丰度差异分析,如图4b所示高强度运动干预之后,产碱菌科和紫单胞菌科相对丰度显著增高(P<0.05),双歧杆菌科相对丰度则显著降低(P<0.05)。
在已鉴定的96个属中,普氏菌属(Prevotella)、拟杆菌属(Bacteroides)、萨特氏菌属(Sutterella)、布劳特氏菌属(Blautia)为优势菌属。受高强度运动的影响,样本中普氏菌属丰度降低,拟杆菌属丰度升高并成为相对丰度最高的菌属(图5a)。从图4b物种丰度差异分析图中可知,经高强度运动干预,萨特氏菌属和副拟杆菌属丰度显著增高,而柔嫩梭菌属、布劳特氏菌属及双歧杆菌属丰度下降不显著。
2.3 LEfse分析物种差异
通过LEFse分析[19],绘制成树形聚类图。高强度运动干预前丰度较高的细菌主要集中在:放线菌门,双歧杆菌目(Bifidobacteriales)的双歧杆菌科;以及厚壁菌门,梭状菌纲(Clostridia),梭状菌目(Clostridiales)下的毛螺菌科。高强度运动干预后受试者肠道菌群主要菌集中在:变形菌门,β-变形菌纲(beta-Proteobacteria),伯克霍尔德氏菌目(Burkholderiales)下的产碱菌科以及紫单胞菌科。
2.4 肠道微生态功能预测
通过计算各组样本16SrRNA的编码基因丰度值,与KEGG数据库比对后,基于PICRUSI丰度表,获得39个功能基因参与的KEEG代谢通路预测结果。由图7可知,参与碳水化合物代谢(Carbohydrate Metabolism)、膜转运(Membrane Transport)及能量代谢(Energy Metabolism)的功能基因均占比较高。而代谢途径又存在明显差异,经历高强度运动干预后,机体中参与能量代谢、糖合成与代谢(Glycan Biosynthesis and Metabolism)等通路的功能基因增多,其中,参与运动员免疫系统调节(Immune System)的功能基因显著增高(P<0.01),参与心血管疾病(Cardiovascular Diseases)的功能基因显著减少(P<0.01)。
3 分析与讨论
3.1 高强度运动摔跤运动员体成分的影响
对于摔跤这种竞争日趋激烈的控体重运动项目来说,合理的体重水平对取得良好的运动成绩至关重要。此外,由于摔跤运动的复杂性和多变性,在控制体重的同时,肌肉含量却不能减少,这对于控体重工作提出较高的要求。高强度间歇运动可有效提高葡萄糖代谢和脂肪氧化分解代谢,进而减少体内脂肪含量。Barker等人发现[20],通过两周高强度间歇性运动可改善受试者最大摄氧量,提高糖和脂肪的氧化代谢率。Little[21]于2011年证实高强度间歇运动可激活5-腺苷-磷酸激活蛋白激酶和p38促分裂原活化蛋白激酶,此二者为运动反应性信号物质,与激活转录因子增加线粒体基因转录有关。通过本研究发现,经过高强度运动训练后,运动员的体重和体脂量显著降低,由此说明高强度运动对摔跤运动员赛前减脂控体重,保持肌肉力量,保障竞技能力是十分有效的。
3.2 高强度运动对摔跤运动员肠道菌群的影响
与被动运动相比,肠道菌群多样性在自主运动下表现出降低的现象[22],这暗示了经常参加主动运动的专业运动员,其运动强度对肠道菌的改变存在适宜度问题。不同的专项运动、运动强度以及运动负荷对运动员肠道菌群微生态的稳定性均有一定的影响。有研究显示,在马拉松运动员的肠道菌群中发现了一株非典型优势菌种——韦荣球菌(Veillonella),该菌通过加速乳酸代谢生成丙酸增强机体的运动能力[23]。本研究发现,韦荣球菌在摔跤运动员肠道内也处于优势菌地位,但相较日常训练的中等运动强度来说,在高强度运动下的韦荣球菌丰度降低,这说明运动强度的改变可以影响受试者肠道菌群多样性及结构分布情况。
肠道菌群稳定性受机体的遗传、饮食及生活方式的影响很大。本研究在纳入受试对象时,为了避免受上述因素的干扰,从同期训练安排一致,排除药物干扰,饮食一致且没有腹泻和便秘问题的运动员中筛选。对菌群结构与物种多样性分析发现,高强度运动下,运动员的肠道菌群多样性有所提高,但部分细菌的数量发生较大波动。如高强度运动前肠道内的厚壁菌门(参与机体免疫调控[24])丰度明显高于高强度运动干预后,但促进炎症反应的变形菌门(机体的有害菌体[24])则在干预后显著增多。类似的变化也在科学家对小鼠中等强度运动前后肠道菌群的研究中发现,即厚壁菌门和乳酸菌含量中等强度运动后显著增加[25]。其次,高强度运动显著降低了运动员机体内的厚壁菌门丰度,但拟杆菌门与厚壁菌门的比值增高。该结果与相关报道中肥胖小鼠在高强度间歇运动后两者比值升高的情况一致[25]。由此,这两种肠道菌的丰度比值大小可间接反映运动员的日常训练强度。
运动可以提高机体的氧化能力,增加线粒体数量以及提高三羧酸循环酶活性[25]。本研究结果显示,高强度运动增强了肠道微生物参与下的物质代谢和能量代谢(功能基因参与两种代谢通路的数量较多,显著性较强)。值得关注的是,本研究中发现高强度运动后,机体参与心血管疾病代谢通路的基因比高强度干预前有所减少。Dias等[9]发现,高强度间歇性运动可显著提高青少年的心肺功能。由此推测,高强度运动训练更有利于青少年心血管疾病的预防。
本研究的受试者在高强度运动条件下,机体表现出代谢功能基因占比显著增加;结合机体体成分变化,说明高强度运动也可以通过改变肠道功能基因的分布来提高机体脂代谢和肌纤维合成的能力。不同运动强度对人体肠道菌群的影响变化是复杂且多样的,部分肠道菌群可能参与到机体生理生化代谢的调控网络中。针对国内外不同训练强度的多种运动训练项目的相关研究仍须继续展开,特色菌群的筛选与鉴定、宏基因组学、相关调控机制与代谢功能的研究亦是肠道微生物的重点研究方向。
4 结 论
综上所述,高强度间歇性训练可以显著降低摔跤运动员体重和脂肪量。研究发现通过摔跤运动员肠道菌群中,拟杆菌门、厚壁菌门为优势菌门,拟杆菌科、普雷沃氏菌科、毛螺菌科、双歧杆菌科、韦荣氏菌科和产碱菌科为优势菌科,普氏菌属、拟杆菌属、萨特氏菌属和布劳特氏菌属为优势菌属。经过高强度间歇运动,肠道菌群发生变化,表现为菌群多样性增高,结构在门、科、属水平上测得也有相应改变。在门水平上,厚壁菌门与拟杆菌门比值增高;在科水平上,双歧杆菌科丰度显著降低,但产碱菌科丰度增高;在属水平上,萨特氏菌属和副拟杆菌属丰度升高。此外,肠道菌功能基因预测显示,高强度运动除提高宿主机体代谢能力外,还可以显著增强机体免疫力,降低心血管疾病的风险。
参考文献:
[1] Yano J M, Yu K, Donaldson G P, et al. Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis[J], Cell, 2015 (161):264-276.
[2] Alok K M, Vinay D, Asit R G. Obesity: an overview of possible role(s) of gut hormones, lipid sensing and gut microbiota[J]. Metabolism, 2016, 65(1): 48-65.
[3] Ghouri Y A, Richards D M, Rahimi E F, et al. Systematic review of randomized controlled trials of probiotics, and synbiotics in inflammatory bowel disease[J]. Clinical and Experimential Gastroenterology, 2014 (7): 473-487.
[4] Samuel B S, Shaito A, Motoike T, et al. Effects of the gut microbiota on host adiposity are modulated by the short-chain fatty-acid binding G protein-coupled receptor Gpr41[J]. PNAS, 2008, 105(43): 767-777.
[5] Simrén M, Barbara G, Flint H J, et al. Intestinal microbiota in functional bowel disorders: a rome foundation report[J]. Gut, 2013, 62(1): 159-176.
[6] 蒋兴宇,赵霞,邹凌云,等.适度运动对人体肠道菌群结构的影响,第三军医大学学报[J]. 2017(18): 1824-1831.
[7] Welly R J, Liu T W, Zidon T M, et al. Comparison of diet versus exercise on metabolic function and gut microbiota in obese rats[J]. Med. Sci. Sports Exerc, 2016, 48(9): 1688-1698.
[8] Buchheit M, Millet G P, Parisy A, et al. Supramaximal training and postexercise parasympathetic reactivation in adolescents[J]. Med. Sci. Sports Exerc,2008, 40(2): 362-371.
[9] Dias K A, Ingul C B, Tjnna A E, et al. Effect of high-intensity interval training on fitness, fat mass and cardiometabolic biomarkers in children with obesity: a randomised controlled trial[J]. Sports Medicine, 2017,48(10): 1-14.
[10] 潘鳳伟, 张磊, 张晨虹, 等. 不同运动强度对女游泳运动员肠道菌群的影响[J].基因组学与应用生物学, 2019,38(4): 1837-1846.
[11] Evans C C, LePard K J, Kwak J W, et al. Exercise prevents weight gain and alters the gut microbiota in a mouse model of high fat diet-induced obesity[J]. PLoS ONE, 2014, 9(3): e92193.
[12] Yuan X, Xu S, Huang H, et al. Influence of excessive exercise on immunity, metabolism and gut microbial diversity in an overtraining mice model[J]. Scand. J. Med. Sci. Sports, 2018, 28(5): 1541-1551.
[13] Codella R, Luzi L, Terruzzi I. Exercise has the guts: how physical activity may positively modulate gut microbiota in chronic and immune-based diseases, Dig[J]. Liver Dis, 2018,50(4): 331-334.
[14] 李佳帅,唐强,朱路文.肠道菌群功能及其与运动的相关性研究进展[J].中国康复理论与实践. 2018, 24(12): 64-67.
[15] 金泽宇,李威,孙宝林.宏基因组测序分析男性运动员肠道菌群物种组成及代谢通路特点[J]. 生物学杂志, 2019, 36(4): 7-13.
[16] 侯玉鹭,彭红.中国优秀跳远运动员身体成分的分析[J].中国组织工程研究, 2014,14(24): 4543-4546.
[17] Fadrosh D W, Ma B, Gajer P, et al. An improved dual-ndexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq iplatform[J]. Microbiome, 2014, 2(1):6.
[18] Edgar R.C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996.
[19] Schloss P D, Westcott S L, Ryabin T, et al. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and environmental microbiology, 2009,75(23): 7537-7541.
[20] Barker,Day,Smith,Bond,Williams. The influence of 2 weeks of low-volume
high-intensity interval training on health outcomes in adolescent boys[J]. Journal of Sports Sciences,2014,32(8).
[21] Little JP, Safdar A, Bishop D, Tarnopolsky MA, Gibala MJ. An acute bout of high-intensity interval training increases the nuclear abundance of PGC-1α and activates mitochondrial biogenesis in human skeletal muscle[J]. Am J Physiol Regul Integr Comp Physiol,2011,300(6):R1303‐R1310.
[22] Allen J.M, Berg M M E, Pence B D, et al. Voluntary and forced exercise differentially alters the gut microbiome in C57BL/6J mice[J]. Journal of applied physiology, 2015, 118(8): 1059-1066.
[23] Scheiman J, Luber J M, Chavkin T A, et al. Meta-omics analysis of elite athletes identifies a performance-enhancing microbe that functions via lactate metabolism[J]. Nature medicine, 2019, 25(7): 1104-1109.
[24] Verdam F J, Fuentes S, de Jonge C, et al. Human intestinal microbiota composition is associated with local and systemic inflammation in obesity[J]. Obesity (Silver Spring), 2013(21): 607-615.
[25] Petriz B A, Castro A P, Almeida J A, et al. Exercise induction of gut microbiota modifications in obese, non-obese and hypertensive rats[J]. BMC Genomics, 2014(15): 511.
收稿日期:2020-04-17;修回日期:2020-06-21
基金項目:国家自然科学基金(青年)(编号:31800657);山西省体育局科研课题(编号:17TY106);山西省应用基础研究计划(编号:201801D221242);山西省高等学校科技创新项目(编号:2019L0041);山西省高等学校大学生创新创业训练计划项目(编号:2020018)。
作者简介:宋韡(1984-),女,讲师,硕士,研究方向为分子生物学与运动适应。
通信作者:高帆(1985-),男,高级实验师,博士,研究方向为分子生物学与生物信息分析。
作者单位:1.山西体育职业学院,山西 太原 030006; 2.山西大学 生命科学学院,山西 太原 030006; 3.山西省运动康复基地,山西 太原 030025
