血管腔内超声联合血栓保护装置在下肢动脉疾病中的应用
2021-09-28陈国君
陈国君,余 翀,王 翔,洪 毅,葛 进,周 斌
(同济大学附属东方医院血管外科,上海 200120)
血管腔内治疗已成为下肢动脉闭塞病变的首选治疗,在腔内治疗的临床实践过程中,病变位置出现斑块或血栓脱落,发生远端部位栓塞是可能引起严重后果并发症。治疗过程中置入血管远端保护装置,可以有效减少此类事件。现有关于下肢动脉硬化腔内治疗研究报道中,远端保护装置捕获栓子的差异较大[1-2],其原因之一是对血管壁病变的性质判断不足。传统的数字减影血管造影(digital subtraction angiography,DSA)虽能很好地诊断血管闭塞的程度,但对病变段产生栓子脱落风险的评估存在缺陷。血管腔内超声(intravascular ultrasound,IVUS)可以根据不同病变超声反射的差异,对病变性质进行评估,从而帮助确定是否需要采用远端保护装置。本课题组在IVUS协助下判断病变段血管组织碎屑脱落的风险,评估使用远端保护装置的必要性,探讨IVUS对血管腔内治疗的指导价值,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2017年1月至2019年11月本院因外周动脉疾病行腔内治疗并联合使用IVUS评估的37例患者,其中男28例,女9例;年龄43 ~ 84岁,平均(69.0±8.9)岁;踝肱指数(ankle-branchial index,ABI)为0.51±0.16;Rutherford分期均在3~4期。动脉硬化闭塞症初次手术32例,二次手术5例。动脉平均病变长度(18.0±5.2)cm;患者经药物治疗效果不佳,进一步进行腔内治疗。
1.2 方法
1.2.1主要检查仪器
IVUS设备采用美国Volcano公司相控阵型血管内超声仪,相应IVUS导管为Eagle Eye Gold腔内超声导管,探头频率为20~40 MHz,景深半径为5~10 mm。采用德国Siemens公司Artis Zeego Ⅲ。
1.2.2检查和治疗方法
所有检查和治疗均在本院DSA手术室进行。根据病变情况选择对侧逆行或通过顺行股动脉穿刺,留置6F鞘管。对侧入路“翻山”后更换抗折长鞘引导,选择性动脉造影明确病变性质。如导丝导管通过病变段困难,根据造影结果于病变血管远端逆行穿刺,开通后以直径2.5~3.0 mm预扩张病变段。交换0.014 in导丝引导,透视下送入超声导管至病变远心端。调试至合适参数后开始观察病变声学特点,缓慢后撤IVUS导管至病变近心端,记录图像。根据超声结果综合患者临床表现,对于满足以下条件之一者,使用血管远端保护装置:(1)血栓负荷较重(病变100 mm以上),难以耐受长时间溶栓治疗的患者;(2)以薄层纤维性斑块及脂质核心为主的病变,长度50 mm以上;(3)小球囊预扩张后即出现斑块破裂的病变。并进一步根据检查结果选择选择球囊扩张、置管溶栓或支架置入治疗。溶栓后根据患者再次造影的结果确定是否进一步治疗,如残余病变范围较大(残余狭窄长度大于5 cm)或出现限流性夹层,继续行支架置入术;对于短段狭窄仅予以球囊扩张。
1.2.3术后处理
术后常规予以氯吡格雷75 mg+阿司匹林100 mg双联口服抗血小板治疗,对于血脂异常患者同时给予阿托伐他汀20 mg口服。
1.2.4术后随访
随访6~24个月,观察患者症状改善情况,复查下肢动脉超声及CT血管造影,对于症状复发的患者再次行DSA及IVUS检查,必要时重新干预。
1.3 统计学处理
2 结 果
2.1 IVUS检查结果
IVUS根据回声特点,定性区病变性质。软斑块表现为低回声,纤维性斑块回声强度与血管外膜接近,钙化斑块表现为强回声伴后方声影;血栓性病变表现为较均匀低回声,与斑块组织有较为清晰的界限,机化血栓表现为不规则蜂窝状不均匀强度回声。IVUS下可直接观察斑块破裂、内膜撕裂及夹层形成。根据IVUS检查结果,选择性置入远端血栓保护装置,见图1。
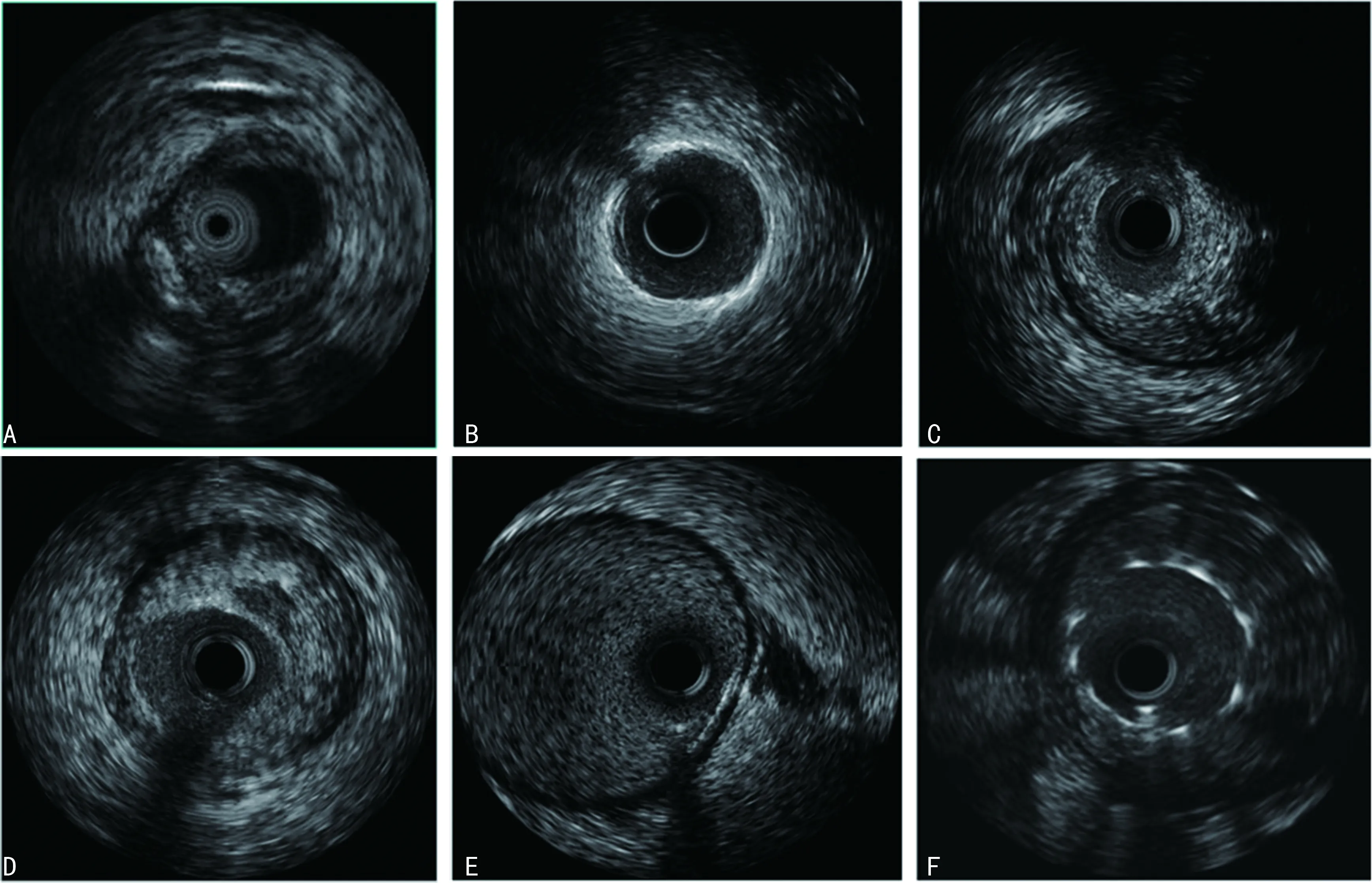
A:钙化斑块,表现为强回声伴有声影;B:环形钙化斑块;C:纤维性斑块;D:脂质斑块,可见到较大脂质核心;E:血栓性病变,低均匀低回声为主,与血管壁有较为清晰的界限;F:支架内图像,可见支架影。
2.2 手术结果
所有患者均成功行DSA和IVUS检查,无手术相关并发症发生。根据DSA及IVUS检查结果,15例患者在IVUS检查后考虑以血栓性病变为主,进行溶栓治疗;其中7例患者于溶栓后再次造影,仍可见明显残余狭窄,予以支架置入治疗,7例患者中5例置入1枚支架,2例置入2枚支架。其余22例患者中,12例患者行支架置入术,其中6例置入1枚支架,3例置入2枚支架,3例置入3枚支架;另有5例患者接受药物涂层球囊治疗。
12例患者在IVUS检查后符合使用血管远端保护装置标准,其中4例为长段血栓性病变且不耐受溶栓患者,6例为广泛易损性斑块,2例为预扩张后发现斑块破裂。将血管远端保护装置置于靶病变远端,治疗结束后逐渐回拉血管远端保护装置,回撤至7F/8F指引导管内,将栓塞物拉出体外。保护装置尾端带螺旋调节器,防止回撤保护伞受阻而导致栓塞物脱落。对于脱落组织体积较大,难以回收的情况,使用引导管预先抽吸出部分脱落组织,减少破碎组织容量后可顺利回收。使用远端保护装置的12例患者均成功置入靶病变部位远端,其中11例(91.6%)捕获脱落斑块或血栓,11例中9例(75.0%)因脱落栓子较大,预先使用导引导管吸栓处理;未接受血管保护装置患者中有1例于治疗过程中血栓脱落至远端胫腓干动脉,经导管接触溶栓后血栓溶解。
2.3 随访结果
随访6个月复查下肢血管CT血管造影或血管多普勒超声Ⅰ期通畅率94.6%。2例复发患者为单纯行球囊扩张患者,因经济原因拒绝Ⅰ期行支架置入术。经再次干预,行球囊扩张+支架置入后患者疗效满意。所有患者临床症状均有不同程度改善,无肢体缺血加重或截肢发生,保肢率为100%。
3 讨 论
血管远端保护装置最初用于颈内动脉狭窄的治疗,通过伞状的滤过装置,捕获治疗过程中脱落的血管组织或脂质结晶,从而减少术中脑梗死的发生。部分学者在治疗下肢缺血性病变的过程中发现合理地使用远端保护装置也能降低治疗中的风险,减少远端动脉栓塞的发生[3-4],但对何种患者需要预防性使用血管远端保护装置目前仍缺少共识。
目前临床上多数血管远端保护装置在DSA引导下使用,DSA技术依赖于显示造影剂通过血管时的二维投影图像,其优势在于诊断相对迅速,显示周围血管病变程度和范围较为明确。但DSA图像以二维投影形式呈现,在检查过程中会损失一些细节,其成像方式决定了其对血管壁病变性质的诊断能力较弱[5-7]。这些缺失使得术者难以完全掌握闭塞性病变的全部信息,造成治疗过程中可能造成的粥样斑块、血栓等脱落。术者多数情况下依据术前经体表超声、术中导丝通过病变段的手感和病变形态的经验判断是否需要使用远端保护装置。
IVUS可提供在血管横截面的声学影像形态的信息,区分血栓的低回声与斑块组织回声分层显像,陈旧的血栓可呈不规则的机化表现,硬化的斑块则可以通过钙化影明确判断[6-9]。本组患者采用IVUS对病变进行判断,并以此为依据使用血管远端保护装置,其中91.6%的患者避免了栓子向远端脱落,其中相当一部分栓子体积较大,需要减容后才能顺利撤出远端保护装置。对于这些患者,血管远端保护装置起到了有效的保护作用。而在IVUS判断不需要使用远端保护装置的25例患者中,仅有1例(4.0%)发生了远端栓塞。证实使用IVUS预先判断血管病变,对确定是否使用血管远端保护装置具有很好的指导意义。
在冠状动脉病变的治疗中,IVUS结合虚拟技术和光谱分析技术,能够有效识别血管病变性质,且在指导复杂病变治疗中优于DSA,有效避免术者低估管腔的狭窄程度,确定相应的诊疗方案[10-13]。在周围血管病变的治疗中,IVUS与光谱技术的联合应用尚处于探索阶段[14-15]。周围血管病变相对于冠状动脉病变,病变负荷更重,长段的完全闭塞性病变或次全闭塞性病变较多,本组患者闭塞+狭窄的病变达到了(18.0±5.2)cm。在治疗的过程中,上述长段病变更易发生血栓、斑块纤维帽或脂质结晶脱落,导致血管远端栓塞。完全闭塞性病变还可能是在局限性重度狭窄或闭塞的基础上继发形成长段血栓。如果病变段新鲜血栓比例较高,球囊挤压及裸支架网眼的切割作用容易造成血栓块的脱落导致远端动脉栓塞,迫使术者继续处理远端血管,增加手术时间和费用,并增加治疗过程中医患遭受电离辐射的时间,甚至造成远端肢体缺血坏死的严重不良事件。
此外,相关研究还表明,在外周血管病变的治疗中,IVUS可以较好地判断炎性病变,从而避免对此类患者不必要的溶栓治疗或支架置入,并明确病变残余狭窄等情况。在评估支架置入后的支架贴壁情况,判断支架内再闭塞原因,掌握溶栓时机,诊断支架置入后无复流的原因等方面都具有独特的优势。已有研究证实IVUS应用于外周动脉病变治疗有助于提高股腘动脉病变的Ⅰ期通畅率;改善球囊扩张及支架在髂股动脉病变中的长期通畅率,降低病变血管再狭窄率[8]。
综上所述,IVUS不仅可实现更精确的管径测量,也能有效明确血管病变的具体性质,优化诸如使用血管远端防护装置等治疗策略,减少治疗相关并发症的发生,在周围血管疾病的介入治疗领域具有良好的运用前景。但目前仍缺少专门为外周血管病变设计的专用超声导管,IVUS本身也存在价格高、处理长段病变更为耗时、增加操作等缺点,需要更多的临床研究来评估IVUS在周围血管疾病中的临床价值。
