老年AML微移植治疗前后NK细胞比例与IFN-γ浓度的相关性研究
2021-09-28金婷,王芳,王利△
金 婷,王 芳,王 利△
(1.华中科技大学同济医学院附属武汉市中心医院血液科,武汉 430014;2.山东省枣庄市山亭区人民医院药剂科 277200)
急性髓系白血病(acute myeloid leukemia,AML)是严重威胁人类健康的一种恶性血液肿瘤。老年AML患者面临的问题是化疗缓解率低,移植相关死亡率高。我国学者在《Blood》杂志报道人类白细胞抗原(human lymphocyte antigen,HLA)半相合外周造血干细胞输注联合化疗(微移植)能较好提高老年AML的治疗疗效[1]。但微移植抗白血病的机制尚未研究清楚,T淋巴细胞、自然杀伤(natural killer,NK)细胞均可能参与发挥作用。NK细胞主要通过穿孔蛋白/颗粒酶途径直接杀伤靶细胞,NK细胞扩增后穿孔蛋白及颗粒酶B基因的表达水平明显增加,NK细胞的杀伤功能明显加强[2]。在蛋白质水平,分泌干扰素-γ(interferon-γ,IFN-γ)是NK细胞活化的一个标志,激活后的NK细胞通过分泌IFN-γ等细胞因子参与免疫调节[3]。本课题组前期已经成功建立了白血病的微移植小鼠模型,发现微移植后IFN-γ释放增加,证明了IFN-γ水平与抗白血病效应呈正相关[4]。因此,笔者推测NK细胞可能通过释放IFN-γ在微移植抗白血病效应中起重要作用,遂进行了相关研究,现报道如下。
1 资料与方法
1.1 一般资料
选取2012年1月至2018年12月在武汉市中心医院血液科行微移植治疗的20例老年低中危AML患者为微移植组,选取同一时期行常规化疗的20例老年低中危AML患者为对照组。纳入标准:(1)明确诊断AML;(2)年龄大于或等于60岁;(3)美国东部肿瘤协作组(eastern cooperative oncology group,ECOG)评分小于或等于2分。供者标准:(1)身体健康,无精神病或严重心、肺、肝、肾疾病者;(2)供受者HLA配型小于或等于7个位点相合。排除标准:(1)AML-M3型;(2)供受者HLA配型大于7个位点相合;(3)高危患者;(4)全身情况差、严重感染、心肌病及心肌炎、其他实体肿瘤、严重肝、肾功能不全、妊娠、结缔组织疾病及自身免疫性疾病;(5)治疗依从性差。微移植组男13例,女7例,年龄60~81岁,平均(66.8±6.68)岁。对照组男11例,女9例,年龄60~80岁,平均(68.3±7.28)岁。所有患者及家属均签署知情同意书,供者签署干细胞采集及干细胞捐献知情同意书。本研究通过伦理委员会审查。
1.2 方法
1.2.1标准化疗方案
诱导化疗方案为地西他滨+HAG方案:地西他滨20 mg·m-2·d-1(化疗第1~5天)+高三尖杉酯碱1~2 mg·m-2·d-1(化疗第1~7天)+阿糖胞苷10~20 mg·m-2·d-1(化疗第1~14天)+重组人粒细胞集落刺激因子(recombinant human granulocyte colony stimulating factor,rhG-CSF)5 μg·kg-1·d-1,当白细胞计数大于20×109/L时,停用rhG-CSF。巩固方案为中剂量或大剂量阿糖胞苷:阿糖胞苷0.5~2.5 g/m2,每12小时1次(化疗第1~3天)。对照组采用上述方案诱导化疗及巩固化疗,共4个疗程。
1.2.2外周血干细胞输注程序
对供者使用rhG-CSF(惠尔血,协和发酵麒麟株式会社)600 μg/d皮下注射,共5 d,第5、6天用费森尤斯卡比血细胞分离机采集外周血干细胞(peripheral blood hematopoietic stem cells,PBHSC)。将采集到的PBHSC分为4等份,受者第1次输注的PBHSC为新鲜采集物,剩余3份冻存于液氮罐中,以后输注的供者PBHSC均为快速复苏的冻存细胞。分别于化疗结束后24~48 h,给受者输注PBHSC采集物,输注过程中严密监测受者生命体征。
微移植组为化疗+供者PBHSC输注(单个核细胞输注中位数范围为2.5~3.0×108/kg,或CD3+T细胞数大于1×108/kg,称为1个微移植疗程),每1~2个月1次,完成4个微移植疗程后停止治疗。
1.2.3观察指标
1.2.3.1疗效评价和随访
(1)完全缓解(complete remission,CR)。CR定义为骨髓中原始细胞比例小于或等于5%,中性粒细胞计数(ANC)≥1.0×109/L,血小板大于或等于100×109/L。(2)嵌合率。微移植组取患者微移植后外周血或者骨髓标本经乙二胺四乙酸(EDTA)抗凝后采用短串联重复序列的荧光PCR检测技术计算得出供者嵌合率(常州金麦格全血基因核酸提取试剂盒)。(3)NK细胞比例。取患者微移植前后EDTA抗凝血3~4 mL,采用流式检测术检测NK细胞比例(流式检测术试剂购自美国BD公司)。(4)IFN-γ浓度。取患者微移植前后血清标本3~4 mL,采用双抗体夹心ELISA法检测标本中IFN-γ浓度(ELISA试剂购自中国武汉光谷联合医学检验所有限公司)。(5)总生存(overall survival,OS)和无病生存(disease-free survival,DFS)。OS定义为确诊至死亡或随访结束,随访时间为确诊到死亡或随访结束。DFS定义为从CR到复发或死亡的时间。统计两组2年OS、DFS数据,并绘制生存曲线。
1.2.3.2不良反应
(1)血液系统:监测ANC、血红蛋白、血小板计数。当患者ANC<0.5×109/L时,给予rhG-CSF 300 μg/d皮下注射。当患者血红蛋白小于60 g/L时,予悬浮红细胞输注;当血小板小于20×109/L时,予血小板输注。(2)非血液系统:①过敏反应或移植物抗宿主病(graft-versus-host disease,GVHD);②微移植治疗相关感染发生情况;③胃肠道反应、肝肾功能损害、神经系统损害等。
1.3 统计学处理
2 结 果
2.1 治疗情况
微移植组20例患者中有1例患者仅完成2个疗程微移植治疗,其余患者均顺利完成4个疗程治疗,总计78个疗程。对照组20例患者有1例患者因消化道出血死亡仅完成2个疗程化疗,共78个疗程。
2.2 疗效
2.2.1近期疗效及嵌合率情况
诱导化疗结束,微移植组CR率为60%,对照组为35%。所有疗程结束后,微移植组中性粒细胞恢复(ANC>1.5×109/L)时间为(13.18±4.23)d,对照组为(15.79±4.76)d,差异有统计学意义(t=-3.627,P<0.05)。微移植组血小板恢复(血小板大于20×109/L)时间为(14.19±4.94)d,对照组为(19.62±5.58)d,差异有统计学意义(t=-6.428,P<0.05)。所有患者的供者细胞嵌合率均小于1%。
2.2.2微移植前后两组NK细胞比例及IFN-γ浓度
与微移植前比较,微移植后NK细胞比例、IFN-γ浓度升高,见表1。采用Pearson相关分析评价微移植后NK细胞比例与IFN-γ浓度的关系,结果显示两个变量存在线性关系,为强相关(P<0.05),见图1。
表1 微移植前后两组NK细胞比例及IFN-γ浓度比较

图1 Pearson相关分析
2.2.3OS及DFS
至随访结束,微移植组8例患者死亡,4例复发状态,8例达CR状态。对照组13例患者死亡,2例复发状态,5例达CR状态。2年OS率微移植组、对照组分别为61.8%、43.3%,差异有统计学意义(P=0.039)。2年DFS率微移植组、对照组分别为51.6%、23.7%,差异有统计学意义(P=0.040),见图2。
2.3 不良反应
(1)血液系统:所有患者都发生Ⅳ度骨髓抑制。(2)非血液系统:所有患者治疗过程中均出现恶心、乏力表现,均未出现肝肾功能损害。微移植组患者均未观察到GVHD临床表现,在输注PBHSC时均未出现发热,患者耐受性良好。9例患者在骨髓抑制期发生感染,均为肺部感染,其中1例在第2疗程治疗后因肺部感染引起呼吸衰竭导致死亡。1例抽搐,1例皮疹,1例血压升高,1例消化道出血,2例腹泻,经过治疗后均恢复良好。对照组12例患者在骨髓抑制期发生感染,均为肺部感染,另有1例在第2疗程治疗后因消化道出血死亡。
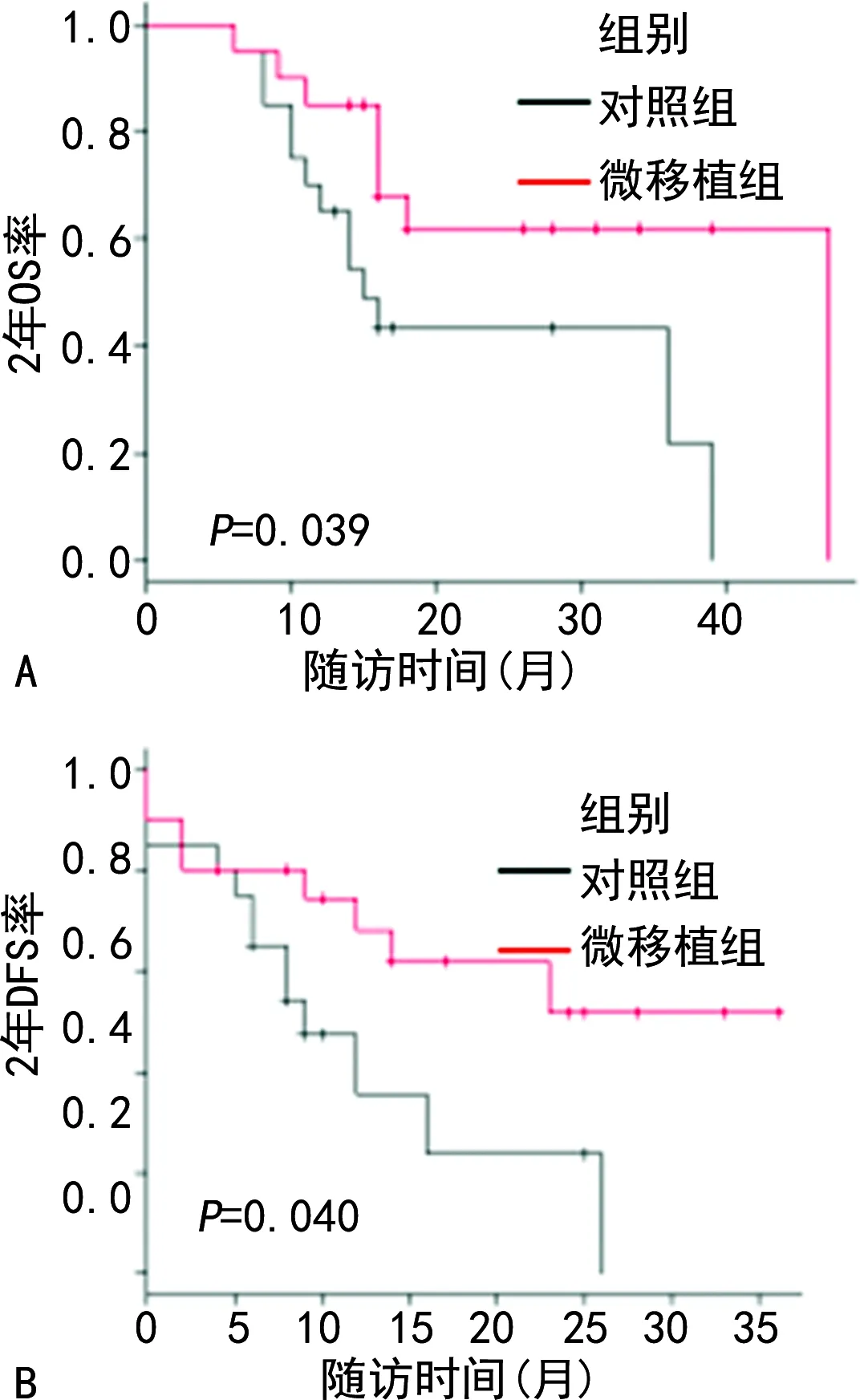
A:OS;B:DFS。
3 讨 论
微移植是指血液系统肿瘤在诱导或强化治疗后输注经rhG-CSF动员的HLA不相合异基因造血干细胞的一种移植方式,也是一种不伴有持续植入的异源反应性细胞治疗,是将化学治疗、移植和免疫治疗有机结合的一种新的治疗模式[5]。微移植治疗AML的基本思路是[6-7]:选用经典联合化疗方案或靶向药物,尽可能降低肿瘤负荷(期间无需使用GVHD预防药物);化疗后通过程序性输注经rhG-CSF动员的HLA不相合PBHSC,使供体细胞在受者体内形成微嵌合(<1%),诱导移植物抗白血病(graft versus leukemia,GVL)的作用,避免临床GVHD的发生,实现GVHD与GVL分离。
异源反应性是供受者之间的免疫反应,这种免疫反应发生在同种异体造血干细胞移植的背景下,已被证明是血液系统肿瘤最有效的免疫治疗形式之一。同样,在微移植治疗AML中,T淋巴细胞和NK细胞的异源反应性起着直接的抗白血病作用[8]。目前估计微移植可能有以下3种机制参与发挥作用[9]:(1)输入的异源反应供者细胞或肿瘤特异性杀伤细胞,如T淋巴细胞、NK细胞介导的直接细胞毒性作用;(2)供者CD4+T淋巴细胞给受者CD8+T淋巴细胞提供“帮助”,激活CD8+T淋巴细胞的抗肿瘤活性,使无抗肿瘤活力的CD8+T淋巴细胞重新获得抗肿瘤能力;(3)受者异源反应细胞在排斥供者细胞的过程中诱导产生促进代谢反应因子,打破免疫耐受或增强宿主抗肿瘤效应。国内学者认为供体微嵌合的外周血干细胞中含有较多淋巴细胞、CD34+细胞及细胞因子(如白细胞介素-2、IFN-γ、肿瘤坏死因子-α),这些细胞及细胞因子可能起到促进造血功能恢复及发挥GVL效应的作用[1,10-11]。
NK细胞是先天性免疫细胞,可通过直接杀伤作用、抗体介导的细胞依赖的细胞毒性作用、分泌细胞因子等机制发挥杀伤作用[12-14]。在造血干细胞移植中,NK细胞有抗白血病作用[15-17]。GUO等[18]证实在微移植治疗中NK细胞等免疫细胞可通过细胞毒作用发挥抗白血病效应,对预后起着重要作用。NK细胞的功能受到抑制性和激活性受体的调节,这些受体起到抗肿瘤监测和细胞毒性调节的作用[19],在这些受体中,杀伤免疫球蛋白样受体(killer cell immunoglobulin-like receptor,KIR)是介导自我耐受、抗肿瘤、抗感染的主要受体之一[20-21]。当受体白血病靶细胞上主要组织相容性复合体(major histocompatibility complex,MHC)-Ⅰ表达降低时,供体NK细胞表达的抑制性KIR将不能与其结合产生的抑制信号,供体NK细胞的杀伤功能被激活,因此,能溶解受体中的残留白血病细胞[15]。HU等[22]根据供体和受体中HLA抑制性KIR配体(A11/3、HLA-Bw4、HLA-Cw)表达的不同,将105例微移植AML患者分为两组,即供体-受体KIR配体重叠组(受者HLA配体可识别供体抑制性KIR)和供体-受体KIR配体不重叠组(受者HLA配体不可识别供体抑制性KIR),结果显示,不重叠组有更高的5年无白血病生存率(44.0% vs.71.1%),5年OS率分别为60.1%、74.4%,5年复发率分别为42.6%、27.5%。红白血病细胞系K562是NK细胞的敏感靶细胞,部分原因在于它们MHC-Ⅰ分子的低表达或不表达[23]。FOLEY等[24]设计成人非亲缘造血干细胞移植模型证实,受人红白血病细胞系K562靶细胞刺激后,高表达KIR的NK细胞分泌更高水平的IFN-γ(Pearson相关系数r=0.412,P=0.023)。本课题组前期已经成功建立了白血病的微移植小鼠模型,发现微移植后IFN-γ释放增加,证明了IFN-γ与抗白血病效应呈正相关[4]。
本研究通过分析比较微移植前后NK细胞比例变化和INF-γ浓度变化之间的相关性发现微移植治疗后NK细胞比例明显高于微移植治疗前,IFN-γ的浓度微移植后较微移植前明显升高,进一步采用Pearson相关性分析微移植后NK细胞比例和微移植后IFN-γ的浓度之间相关性,证实二者为强相关。因此,推测NK细胞与微移植治疗AML的疗效有强相关性。
本研究不足之处在于未明确NK细胞如何直接或间接促进IFN-γ释放的机制,未来有待深入研究NK、CD8+T和CD4+T细胞等免疫细胞如何协同促进IFN-γ释放从而提高微移植疗效的具体机制。
