果糖对γ射线照射V79细胞的辐射保护作用
2021-09-28胡静,郑越
胡 静,郑 越
(解放军总医院医疗保障中心药剂科,北京 100853)
电离辐射是一种电磁波或粒子,当它通过物质时,能够产生离子,并立即引起生物组织的化学变化。一定时间后这些改变可能导致细胞损伤,最终也可能导致细胞或生物体死亡[1]。 这些细胞损伤对可能遭受军事、太空旅行的电离辐射暴露人群,以及接受放疗的癌症患者和核电行业的工作人员至关重要[2]。 有报道认为,活性氧(ROS)是电离辐射引起的细胞损伤的介质,因此,调节这些物质的化合物在保护细胞免受辐射损伤方面可能具有重要意义。近年,研究人员已经投入了大量精力开发具有抗氧化作用的化学辐射保护剂,这些保护剂可以在进入放射性污染场所之前服用[3-5]。 然而,现有的辐射保护剂的辐射防护作用不够持久,毒性与其在细胞保护剂量下的使用有关,且在暴露于辐射前使用最有效[2]。虽然适用于部分临床情况,例如放疗患者,但仍然无法应用于各种紧急情况。目前,阿米福汀是被美国食品药品监督管理局批准的放射性保护药物[6],仍需要开发更多的保护剂。果糖是传统中药方剂四物汤中的主要活性成分,已被证实能保护小鼠免受γ射线辐射[7]。果糖通过阻止参与氧化还原循环的谷胱甘肽二硫化物外流,有效地防止呋喃妥因诱导的氧化应激而不产生细胞毒性[8],通过抑制铁氧化来保护氧化剂诱导的细胞损伤,对氰化物、寡霉素、过氧化叔丁醇、甲萘醌和胱胺的毒性具有良好的防护作用,而果糖也是临床常用的化学放射保护剂的重要成分之一[9]。所有这些都表明果糖可能是一种潜在的辐射防护剂,本文将初步探讨果糖的辐射防护作用,现报道如下。
1 材料与方法
1.1 材料
1.1.1试剂
DMEM细胞培养基和新生牛血清(NBS)购自新西兰Invitrogen公司。胰蛋白酶购自美国Amresco公司。果糖(纯度大于99.5%)购自中国药品生物制品检定所(北京)。二乙酸二氯荧光素(DCFH-DA)购自瑞士Fluka公司。
1.1.2细胞
实验使用中国仓鼠肺成纤维细胞(V79细胞),将细胞培养于25 cm2培养瓶中,加入含10% NBS的DMEM,青霉素100 U/mL,链霉素100 μg/mL,置于5% CO2、温度37 ℃的培养箱中培养。根据实验方法分为对照组、辐射组和果糖组,对照组不做特殊处理,辐射组使用辐射处理,果糖组则在辐射组基础上使用果糖处理。
1.2 方法
1.2.1辐射
辐照前12 h以适当的数量接种细胞,使细胞贴壁,室温下,以钴-60源照射,剂量率0.216 Gy/min。辐照后立即更换培养基。
1.2.2克隆形成率实验
采用V79细胞单层培养法测定果糖的抑制细胞毒性和放射保护作用。选择每个培养皿细胞的数量,使50~100个菌落在特定处理后能够存活。 将固定数量的细胞置于含有2 mL培养基的35 mm培养皿中,在添加不同浓度的果糖之前,让细胞贴壁12~16 h。 用预热的新鲜培养基(对照培养皿)或含药物培养基代替原培养基,再过24 h后,辐射培养皿,再用热的磷酸盐缓冲液(PBS)清洗1次,然后将细胞培养在37 ℃,5% CO2温育3 d。所得的菌落用无水甲醇固定,吉姆萨染色,只计数超过50个细胞的菌落,细胞存活率用溶媒处理(培养基)对照的百分比表示。
1.2.3实验细胞的活力测定(MTS)分析
细胞在96孔板上以3×103个细胞/孔的密度生长。培养12 h后,向细胞加入不同浓度(0、10、50、250、500 μg/mL)的果糖,并在37 ℃下将细胞再培养24 h。孵育后,对细胞进行辐射,然后在照射细胞48 h后,加入20 μL MTS溶液,在37 ℃下再孵育4 h。使用VictorTM1420酶标仪(芬兰Wallac公司)读取490 nm处吸光度。同理,相同方法测定了用果糖预处理12 h及后处理48 h的细胞暴露于辐射后活力变化。
1.2.4台盼蓝排除法
将细胞培养在25 cm2的培养瓶中,培养12 h后,将不同浓度的果糖加入细胞中,细胞在37 ℃再孵育24 h。培养后,对细胞进行照射。照射48 h后,台盼蓝染色后进行细胞计数。将细胞悬浮液与相当体积的0.4%台盼蓝溶液混合,随后在光学显微镜下进行检测。细胞活力用存活细胞占细胞总数的百分比来表示。同理,相同方法测定了用果糖预处理12 h及后处理48 h的细胞暴露于辐射后活力变化。
1.2.5超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性的测定
测量CAT活性的方法按照文献[10-11]描述。将细胞提取物添加到3 mL含10 mmol/L H2O2的50 mmol/L磷酸缓冲液中(pH 7.8),并立即在240 nm下测量。CAT活性以每克蛋白质单位(U/mg)表示。
1.2.6ROS测定
用二乙酸二氯荧光素(DCFH-DA)检测ROS。直接向培养基中加入DCFH-DA工作液10 μmol/L,37 ℃孵育15 min。然后用胰蛋白酶/乙二胺四乙酸(EDTA)去除细胞,用流式细胞仪测量荧光增强的细胞数量。在测定果糖对ROS水平的影响时,细胞在照射前24 h暴露于果糖中,48 h后用DCFH-DA染色。在488 nm和525 nm处读取吸光度(Ex 485 nm和Em 535 nm)。比较3组2′,7′-二氯荧光素(DCF)水平。
1.3 统计学处理

2 结 果
2.1 V79细胞的辐射敏感性
存活分数与辐射剂量的函数关系表明细胞对γ射线敏感,克隆形成率实验允许SF2的特性(2 Gy存活分数)为(0.58±0.03)Gy,见图1。

图1 不同剂量γ射线照射后V79细胞的存活率
2.2 果糖对细胞存活的保护作用
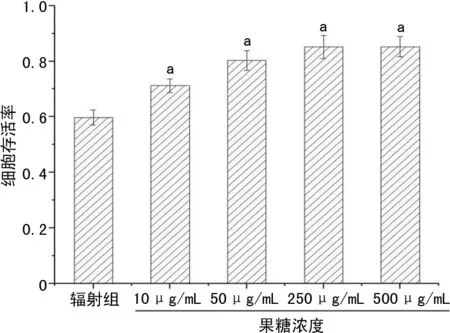
在果糖存在的情况下,测量2 Gy照射后细胞克隆形成存活率,结果显示即使在1 250 μg/mL的高浓度下,果糖也没有表现出细胞毒性。在辐射前用不同浓度的果糖处理细胞24 h,并测定不同果糖处理浓度的存活率,结果显示果糖的保护作用不同程度地依赖于果糖浓度。在10 μg/mL的低浓度下,与对照组比较,果糖组细胞存活率提高。果糖浓度从50 μg/mL提升至500 μg/mL时,细胞存活率也逐渐提高,在500 μg/mL时达到稳定,见图2、3。
与辐射组比较,果糖组存活细胞均增多,且这种保护作用与暴露于辐射前后的果糖添加时间无关。MTS法和台盼蓝排除法也证实了果糖对电离辐射的防护作用。用MTS法和台盼蓝排除法测定辐射后48 h细胞存活率,结果表明果糖组V79细胞存活率较对照组提高,见图4~6。
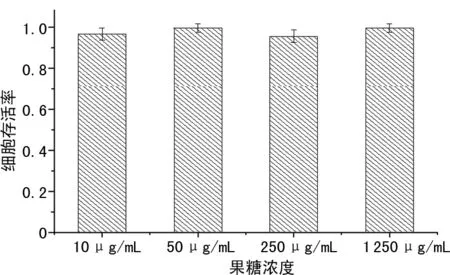
图2 不同浓度果糖对V79细胞毒性的影响
a:P<0.05,与辐射组比较。

a:P<0.05,与辐射组比较。

a:P<0.05,与辐射组比较。
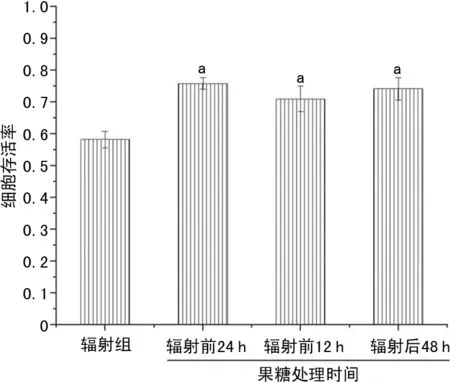
a:P<0.05,与辐射组比较。
2.3 果糖对SOD和CAT活性的影响
辐射组在辐射24、48 h的SOD活性均低于对照组,果糖组SOD活性在辐射24 h明显降低,而在辐射48 h明显增加。24、48 h后,对照组和果糖组CAT活性有明显差异,而辐射组和果糖组CAT活性基本一致,见图7、8。

a:P<0.05,与对照组比较。
2.4 果糖对DCF荧光的影响
与对照组比较,辐射组DCF荧光增强,果糖组DCF荧光强度较辐射组降低,差异有统计学意义(P<0.05),见图9。

a:P<0.05,与对照组比较。
3 讨 论
四物汤是由地黄、当归、川芎、芍药组成的传统经典名方,在我国已有一千多年的应用历史[12],其具有造血、增强细胞免疫和放射防护等作用[13]。果糖是四物汤的主要成分,已证实其在部分坏死和凋亡的细胞模型中具有细胞保护作用[14]。然而,果糖是否具备保护细胞免受放射性损伤的能力还不得而知。本文报道了在γ射线照射下果糖对V79细胞具有辐射防护作用,并采用了3种方法检验,取得了一致性结果。
对于细胞保护机制,首先考虑通过增加糖酵解活性和产生三磷酸腺苷来介导[15],笔者认为果糖也可以通过作用于其他部位来提供保护。众所周知,ROS在辐射损伤过程中损害了细胞关键成分,如DNA、蛋白质和脂类,从而导致细胞死亡,并最终导致组织的物理和化学损伤。针对活性氧的保护路径,已经发现多种抗氧化防御机制。这些抗氧化防御系统包括:(1)金属螯合物,如铜蓝蛋白和转铁蛋白,能够通过抑制Fenton或其他金属催化反应来防止ROS的形成;(2)低分子量抗氧化剂,如抗坏血酸,谷胱甘肽和生育酚;(3)ROS相互作用的酶,如SOD、CAT和谷胱甘肽过氧化物酶[16]。因此,本实验通过测定分析SOD、CAT活性及ROS水平,阐释了果糖对细胞的保护机制可能是通过刺激抗氧化酶来发挥其有效的抗氧化剂作用。
综上所述,果糖通过刺激SOD活性和降低ROS水平对V79细胞产生一定的抗辐射保护作用,其确切机制及电离辐射导致细胞死亡的机制尚有待深入研究,以期为开发新的辐射保护剂提供数据支撑。
