不同脂肪源饲料对斑马鱼elovl5、elovl2和fads2 在高度不饱和脂肪酸合成中的作用影响
2021-09-27王玉梅任天应高坚
王玉梅,任天应,高坚,2
1.华中农业大学水产学院,武汉 430070; 2.农业动物遗传育种与繁育教育部重点实验室,武汉 430070
高度不饱和脂肪酸(highly unsaturated fatty acids,HUFA)是双键数有2个或2个以上并且碳原子数有20个或20个以上的一类多烯直链脂肪酸。由于人体内无法自身合成HUFA,必须从食物中摄取,因此,HUFA被称为必需脂肪酸[1]。HUFA作为必需脂肪酸在维持哺乳动物的正常生命活动中有着不可替代的作用。研究表明,HUFA在机体抵抗炎症过程中必不可少[2],同时,HUFA对抑制心脑血管疾病的产生,以及在抵抗癌细胞增殖扩散等疾病的治疗中发挥重要作用[3-4]。
目前,水产品是人类获取DHA的主要来源。海水鱼类普遍比淡水鱼类具有更多含量的HUFA,但海水鱼体内的DHA主要通过食物链富集而来,而淡水鱼类可以通过自身合成DHA。因此,如何提高淡水鱼HUFA含量具有重要研究价值。斑马鱼作为淡水鱼的经典模式生物,与人类基因组具有高度同源性,且发育迅速、生长周期短,因而在诸多脂质代谢的研究中都有应用[5-6]。
研究表明,脂肪酸碳链的延长和去饱和是HUFA合成的关键步骤[7],该过程主要由脂肪酸延长酶2(elongase of very long chain fatty acids 2,elovl2)、脂肪酸延长酶5(elongase of very long chain fatty acids 5,elovl5)和脂肪酸去饱和酶2(desaturase of very long chain fatty acids 2,fads2)参与[8]。elovl2能将C20HUFA延长到C22HUFA[9]。研究表明,在小鼠中,elovl2敲除后血清中C22HUFA含量降低,尤其是C22:6n-3(DHA)含量会显著减少,使得雄性小鼠精子发育异常导致不育[10]。Monroig等[8]从斑马鱼中克隆出elovl5基因,并证明elovl5能将C18PUFA延长至C20HUFA,也具有延长C20HUFA至C22HUFA的能力,这与elovl2的功能具有相似之处。然而,目前对elovl5的研究主要集中在海水鱼中,在淡水鱼elovl5的研究较少。鱼类Δ4、Δ5、Δ6、Δ8去饱和作用都属于fads2基因[11]。不同鱼类fads2具有不同的去饱和酶活性[12]。
笔者所在实验室分别对斑马鱼elovl2、elovl5和fads2在HUFA合成中的作用进行了探究[13-14]。研究结果表明,敲除斑马鱼elovl5出现C18PUFA含量降低、C20HUFA含量升高[13]。elovl5和fads2具有不同的生理功能,在我们前期研究中,elovl5主要将C18:3n-3(ALA)和C18:2n-6(LNA)分别延长至C20:3n-3和C20:2n-6,然而缺失elovl5的斑马鱼并没有出现ALA和LNA累积[13],我们推测ALA和LNA可能是通过fads2的Δ6作用将ALA和LNA分别转变为C18:4n-3和C18:3n-6。在作为elovl5和fads2的脂肪酸底物ALA和LNA的合成中,elovl5缺失后,fads2是否会起到替补合成作用,elovl5和fads2是竞争底物的关系还是互相替补合成的关系都需要进行深入探究。
为此,本研究利用CRISPR/Cas9技术成功构建了不同敲除型斑马鱼,即elovl5-/-(以下简称E5-/-组)、elovl2-/-×elovl5-/-(以下简称E2-/-×E5-/-组)、elovl5-/-×fads2-/-(以下简称E5-/-×F2-/-组)、elovl2-/-×elovl5-/-×fads2-/-(以下简称E2-/-×E5-/-×F2-/-组)。通过对投喂不同饲料的突变体进行脂肪酸组成分析和实时荧光定量,探究斑马鱼敲除elovl5后缺失elovl2和fads2在HUFA合成中的影响,旨在为更好地阐释elovl2、elovl5和fads2在HUFA合成中的相互作用机制奠定基础。
1 材料与方法
1.1 试验材料
试验用鱼由国家斑马鱼资源中心(中国武汉)提供,成鱼雌雄分别饲养于循环水系统中,系统条件如下:水温为(28±0.5) ℃,pH值为7.6±0.1,光照周期为14 h光照(08:00-22:00)/10 h黑暗(22:00-08:00)。每天用孵化的丰年虫投喂3次。试验中斑马鱼自然受精的卵在28 ℃恒温过滤水中孵化,受精后5 d投喂经纱网过滤的蛋黄,受精后10 d开始投喂丰年虫。
1.2 敲除模型的构建
试验中繁殖用到的单基因elovl2、elovl5和fads2以及E2-/-×E5-/-组纯合突变体均来自笔者所在实验室,具体敲除及构建过程参考文献[13-14]。E5-/-×F2-/-组和E2-/-×E5-/-×F2-/-组的构建流程如图1所示,对基因elovl2、elovl5和fads2互相杂交后获得杂合子,而杂合子间自交后经筛选获得纯合突变体。各纯合突变体在形态上与野生型(wild type,WT)斑马鱼没有区别,雄雌都可育。
1.3 RNA提取
用Primer Premier 6软件设计斑马鱼荧光定量引物,引物序列见表1。用Trizol法提取各类基因型斑马鱼的RNA,具体步骤参考笔者所在实验室已发表文章[13-14]。
1.4 不同脂肪源饲料的制作及试验取样
采用商品饲料(粗蛋白≥35%,粗脂肪≥3%,粗灰分≤12%)经破碎、索氏抽提法乙醚脱脂后,分别添加大豆油(SO)和亚麻芥油(CO)制粒并烘干制成的饲料。油脂添加量为7%,不同饲料脂肪酸组成见表2。试验饲料置于-20 ℃冰箱保存。本试验所用各基因型2月龄以上雄性斑马鱼共300尾,初始试验鱼体质量选择在每尾(0.25±0.03) g,所用循环水系统缸数为30缸。每种饲料每种基因型有3个平行缸,每缸放置10尾。投喂试验开始前饥饿1 d并称体质量。每天定量投喂3次,时间分别为08:00、13:00和18:00,每次投喂饲料质量为缸内鱼体总质量的3%。每天记录斑马鱼的摄食和死亡情况,试验持续4周。4周后饥饿1 d再进行取样。取样时,测量每尾斑马鱼的体质量。从每缸随机取3尾鱼的肝脏,用于提取RNA和分析表达变化;从每缸任意取9尾斑马鱼肝脏混合后保存在-80 ℃冰箱,用于脂肪酸分析。
1.5 斑马鱼肝脏脂肪酸分析
饲料脂肪酸及肝脏组织脂肪酸的测定通过Li等[15]描述的方法进行甲酯化,使用气相色谱仪(GC-2010 Plus)鉴定和定量脂肪酸种类。每种脂肪酸含量计算公式为:脂肪酸含量组成百分比=该种脂肪酸出峰面积/总脂肪酸出峰面积×100%。
1.6 统计分析
试验数据以平均值±标准误差(mean±SD)表示,采用SPSS18.0软件进行单因素方差分析(One way ANOVA),用LSD和Duncan’s多重比较分析确定各试验组间差异的显著性,P<0.05则认为是显著的。采用Prism 8.0.2软件作图。
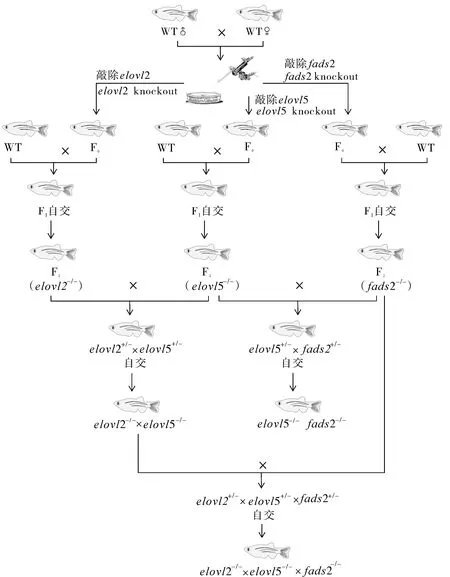
WT:野生型 Wild type; 自交:Selfing.
图1 斑马鱼不同基因的KO模型示意图
Fig.1 Zebrafish different knockout (KO) genotypes maps

表1 PCR和荧光定量PCR引物序列 Table 1 Primers sequence used for PCR and qPCR
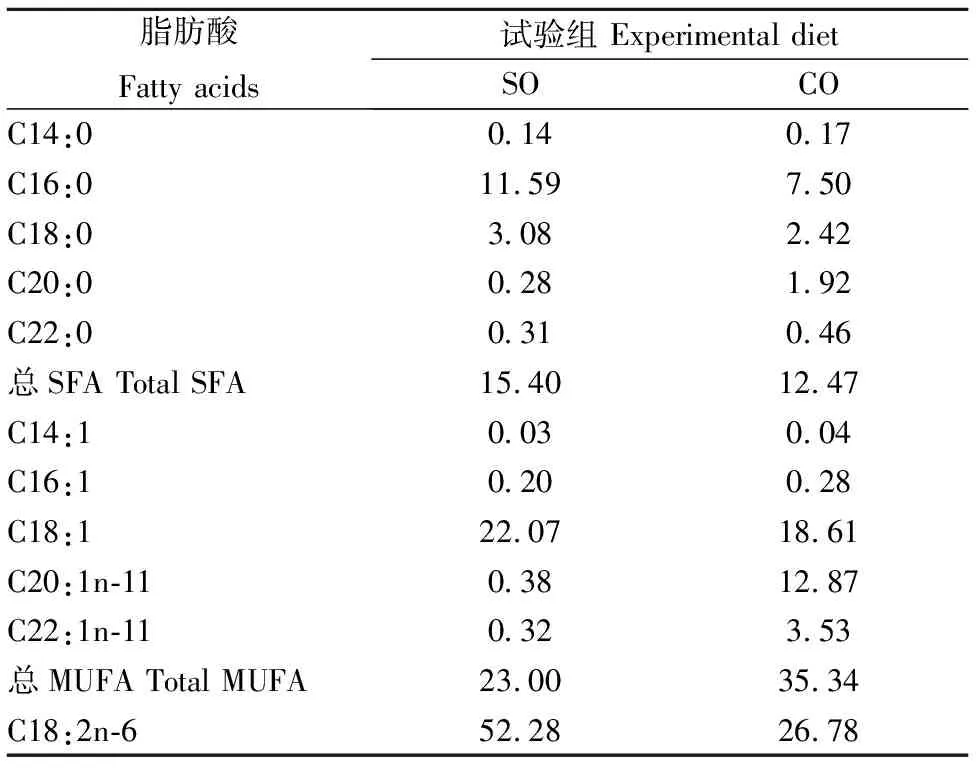
表2 饲料脂肪酸组成(占总脂肪酸的百分比) Table 2 Fatty acid composition(percentage of total fatty acids)of experimental diets %
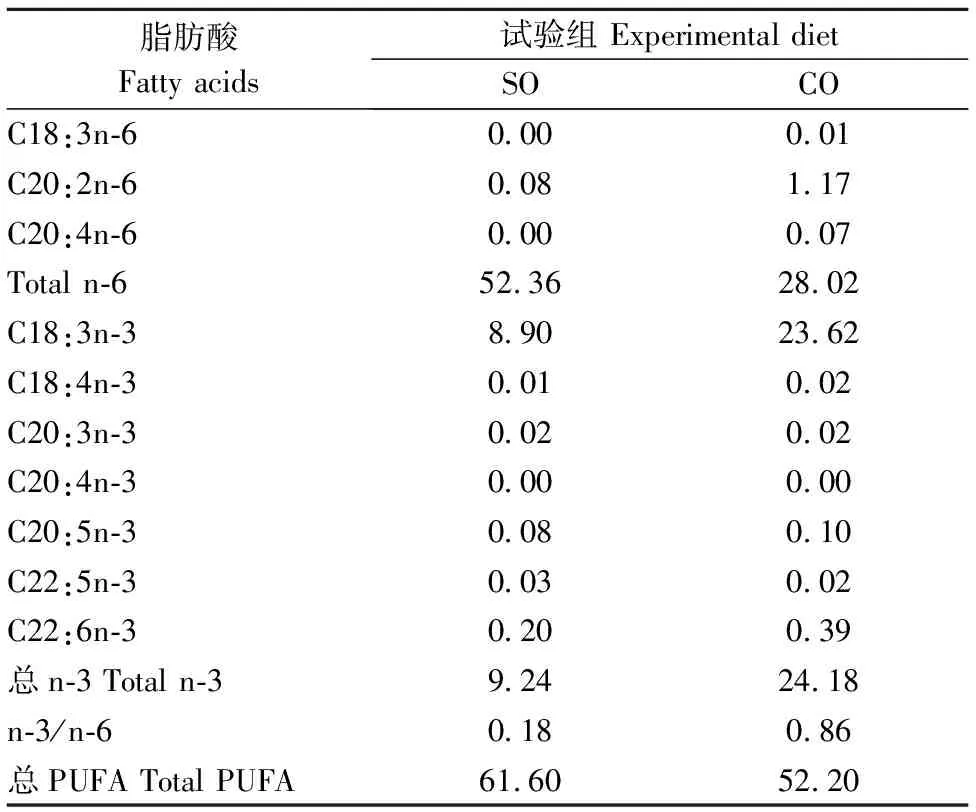
续表2 Continued Table 2
2 结果与分析
2.1 斑马鱼敲除型的构建
经过4周投喂试验,各组鱼体生长性能没有显著差异(未提供数据)。为了研究elovl2、elovl5和fads2在斑马鱼HUFA合成中的功能,使用SO饲料和CO饲料进行投喂试验,分析不同突变型斑马鱼的肝脏脂肪酸组成变化,结果见表3。脂肪酸分析结果显示,SO饲料中主要脂肪酸为LNA。在投喂SO饲料后,与WT组相比,E5-/-组的C18:2n-6未显著变化,而E5-/-×F2-/-组和E2-/-×E5-/-×F2-/-组LNA出现了显著累积。相反,在E2-/-×E5-/-组LNA出现了显著降低。此外,与WT组相比,4组突变类型的EPA含量都显著升高。相较于WT组,E5-/-×F2-/-组和E2-/-×E5-/-×F2-/-组的DHA显著降低,但E2-/-×E5-/-组的DHA含量却显示显著升高(图2)。
2.2 不同脂肪源饲料投喂对敲除型斑马鱼脂肪酸组成的影响
在CO饲料中,ALA是主要脂肪酸。脂肪酸分析结果显示,相较于WT组,E5-/-×F2-/-组、E2-/-×E5-/-×F2-/-组出现了ALA与LNA的积累,但在E5-/-组和E2-/-×E5-/-组中ALA与LNA呈现显著降低的结果。与WT相比,E5-/-组DHA明显增加。同时,E5-/-×F2-/-组和E2-/-×E5-/-×F2-/-组的DHA含量显著降低。在5组比较中发现,EPA的含量并没有明显差异。此外,E2-/-×E5-/-组的花生四烯酸(C20:4n-6,ARA)以及DHA含量无明显变化,而ARA含量显著高于WT组(图2)。
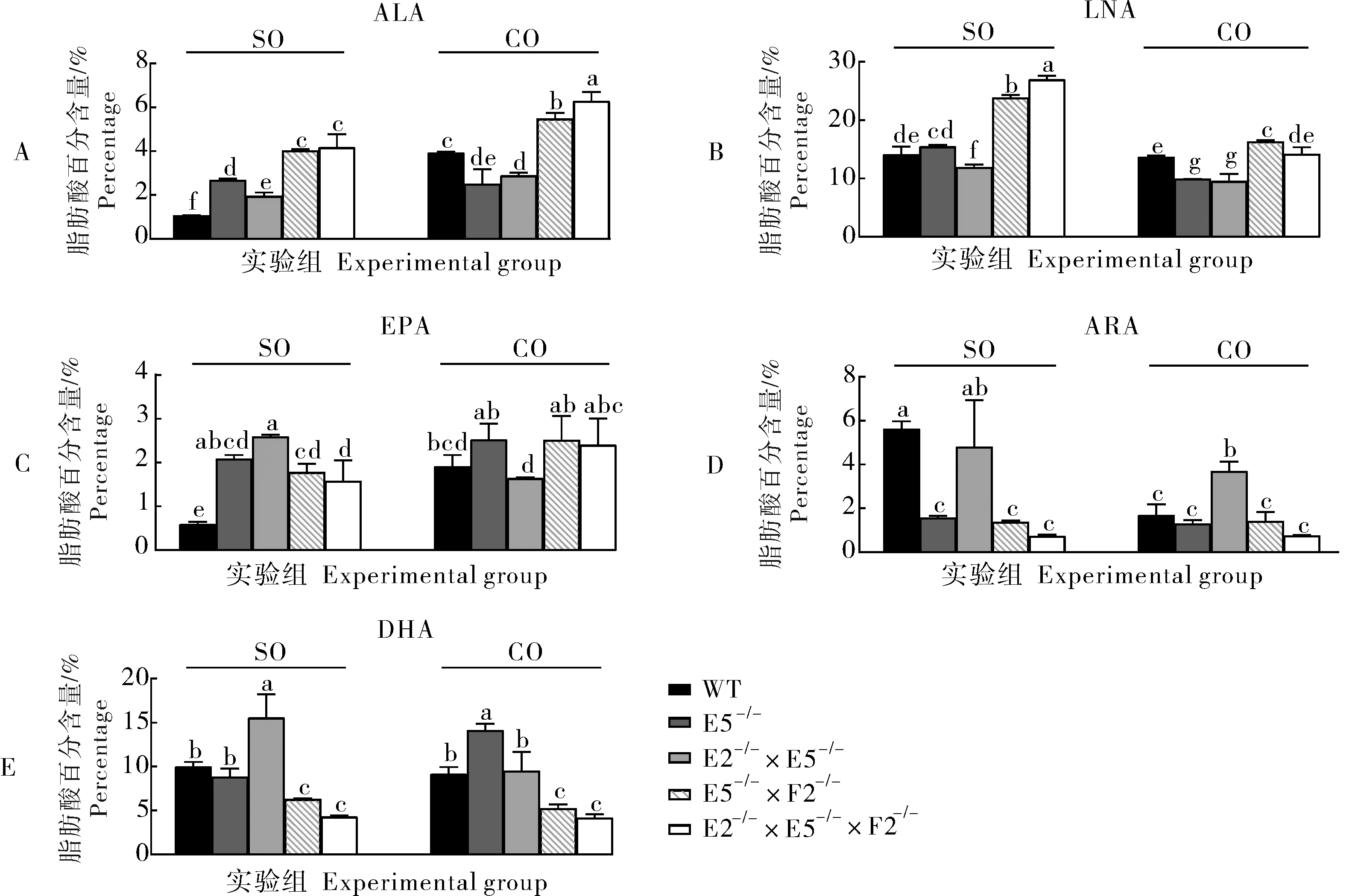
图内5组数据字母不同表示差异显著(P<0.05)。下同。Five groups of data have different letters indicating significant difference in the figure(P<0.05).The same as below.
2.3 不同脂肪源投喂对敲除型斑马鱼中HUFA合成相关基因表达的影响
检测不同突变型斑马鱼肝脏中HUFA合成相关基因(如elovl4a、elovl4b和fads6)的表达变化,如图3所示。在经过CO饲料投喂后,与WT组相比,elovl4a、elovl4b和fads6在各敲除类型中都有明显上调,除在E5-/-组elovl4b没有显著性变化。大豆油饲料投喂后,elovl4a、elovl4b在E5-/-组、E2-/-×E5-/-组和E5-/-×F2-/-组中呈现梯度递增,而E2-/-×E5-/-×F2-/-组和WT组相比,elovl4a、elovl4b的表达水平没有显著变化。与WT组相比,fads6的表达水平在E5-/-组和E2-/-×E5-/-×F2-/-组没有显著性变化,在E2-/-×E5-/-组与E5-/-×F2-/-组中呈现显著升高。
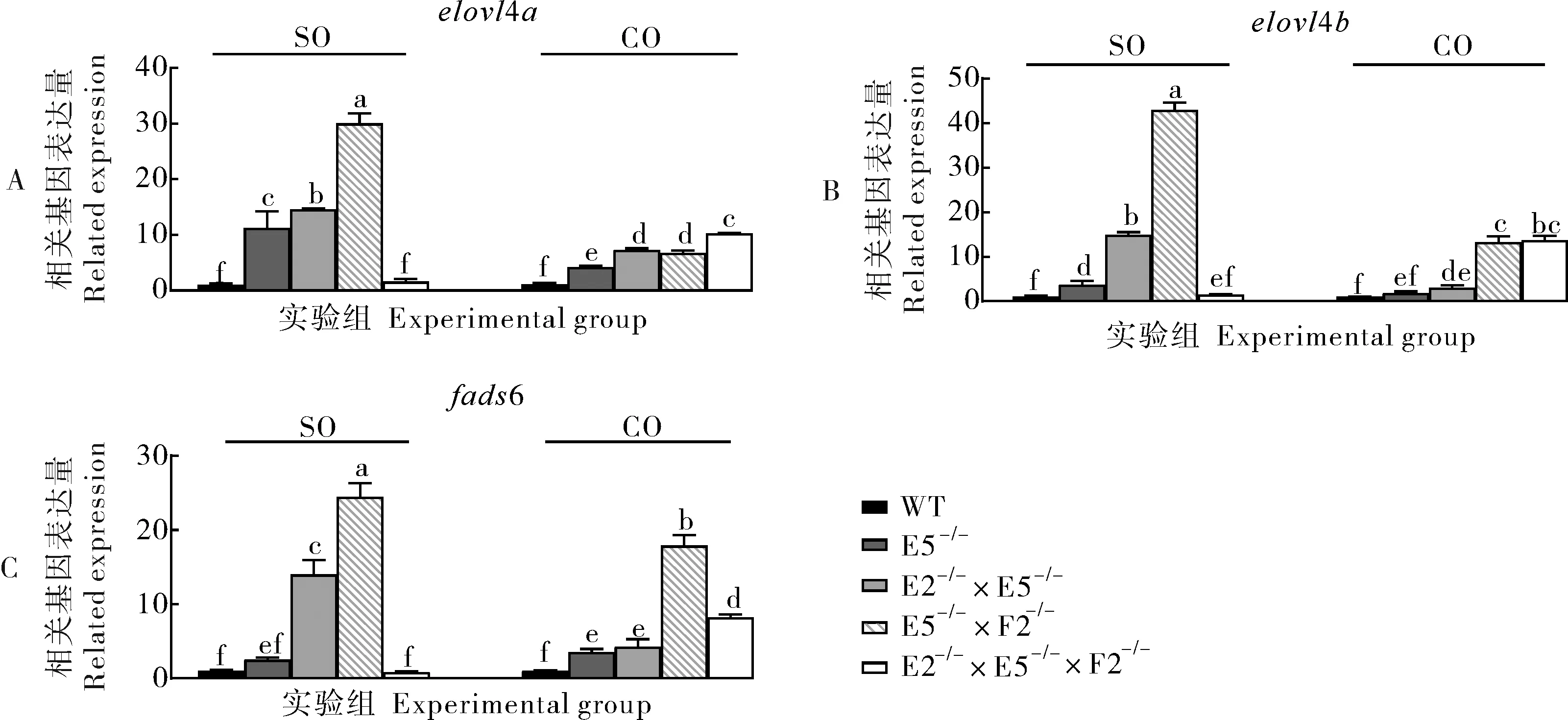
图3 不同试验组斑马鱼肝脏基因表达量Fig.3 Gene expression of zebrafish liver in different experimental groups
3 讨 论
与海水鱼相比,淡水鱼类具有更高的HUFA合成能力[16]。因此,研究淡水鱼HUFA生物合成相关机制有利于提高淡水鱼HUFA含量,并为建立高营养价值的淡水生物群提供理论基础。有研究报道,elovl2、elovl5和fads2的缺失或活力低下是造成鱼体HUFA生物合成功能较弱、甚至缺失的主要原因[17],说明elovl2、elovl5和fads2是合成HUFA的关键酶。为深入了解elovl2、elovl5和fads2在淡水鱼HUFA的合成机理,本试验构建了elovl5和fads2的双基因敲除斑马鱼模型以及elovl2、elovl5和fads2三基因敲除斑马鱼模型。用CO饲料和SO饲料分别投喂4周后对4种突变体及WT组的肝脏进行了脂肪酸组成分析和其他与DHA合成相关基因的荧光定量分析。
本研究发现,尽管CO饲料和SO饲料中不含有DHA含量,但在各突变体仍可以检测到DHA含量,这表明淡水鱼elovl2、elovl5和fads2外还存在其他基因作用HUFA合成。有研究报道,硬骨鱼类elovl4可能是通过Sprecher途径促进DHA的生物合成[18]。在斑马鱼中已有研究发现elovl4a可以将C20HUFA转化为C22HUFA,而elovl4b可以使C20HUFA转化至C36的多烯产物[19]。在本研究中,相对于WT组,除SO饲料投喂的E2-/-×E5-/-×F2-/-组,elovl4a和elovl4b均在各组高表达,从脂肪酸结果分析,在elovl5、elovl2及fads2缺失后elovl4a和elovl4b可能参与了合成DHA的过程,但elovl4a和elovl4b的高表达并没有使DHA的含量达到正常水平,这也说明elovl4a和elovl4b并不能完全替代elovl2和elovl5在C20HUFA合成DHA过程中的功能。
研究表明,淡水鱼elovl5能将C18PUFA延长至C20HUFA,同时也具有延长C20HUFA至C22HUFA的能力[8],但脂肪酸分析结果显示E5-/-组中C18PUFA并未出现累积,CO投喂的E5-/-组C18:2n-6和C18:3n-3甚至出现显著下降,这表明在E5-/-有替代基因在C18PUFA延长至C20PUFA起作用。与我们先前的结果一致[13],E2-/-×E5-/-组与WT相比DHA含量并没有出现显著差异,E2-/-×E5-/-组DHA并没有降低,说明在C18PUFA延长至C22PUFA出现了“补偿基因”,即可能激活别的基因对其产生了“遗传补偿效应”。
脂肪酸组成分析结果显示,E5-/-×F2-/-组和E2-/-×E5-/-×F2-/-组在CO组和SO组的ALA和LNA都出现显著累积,关键产物ARA和DHA的含量都有显著降低的现象。E2-/-×E5-/-×F2-/-组与E2-/-×E5-/-组相比,E2-/-×E5-/-×F2-/-组DHA含量显著降低,延长底物显著累积。这表明,淡水鱼fads2在DHA合成中起到非常重要的作用。
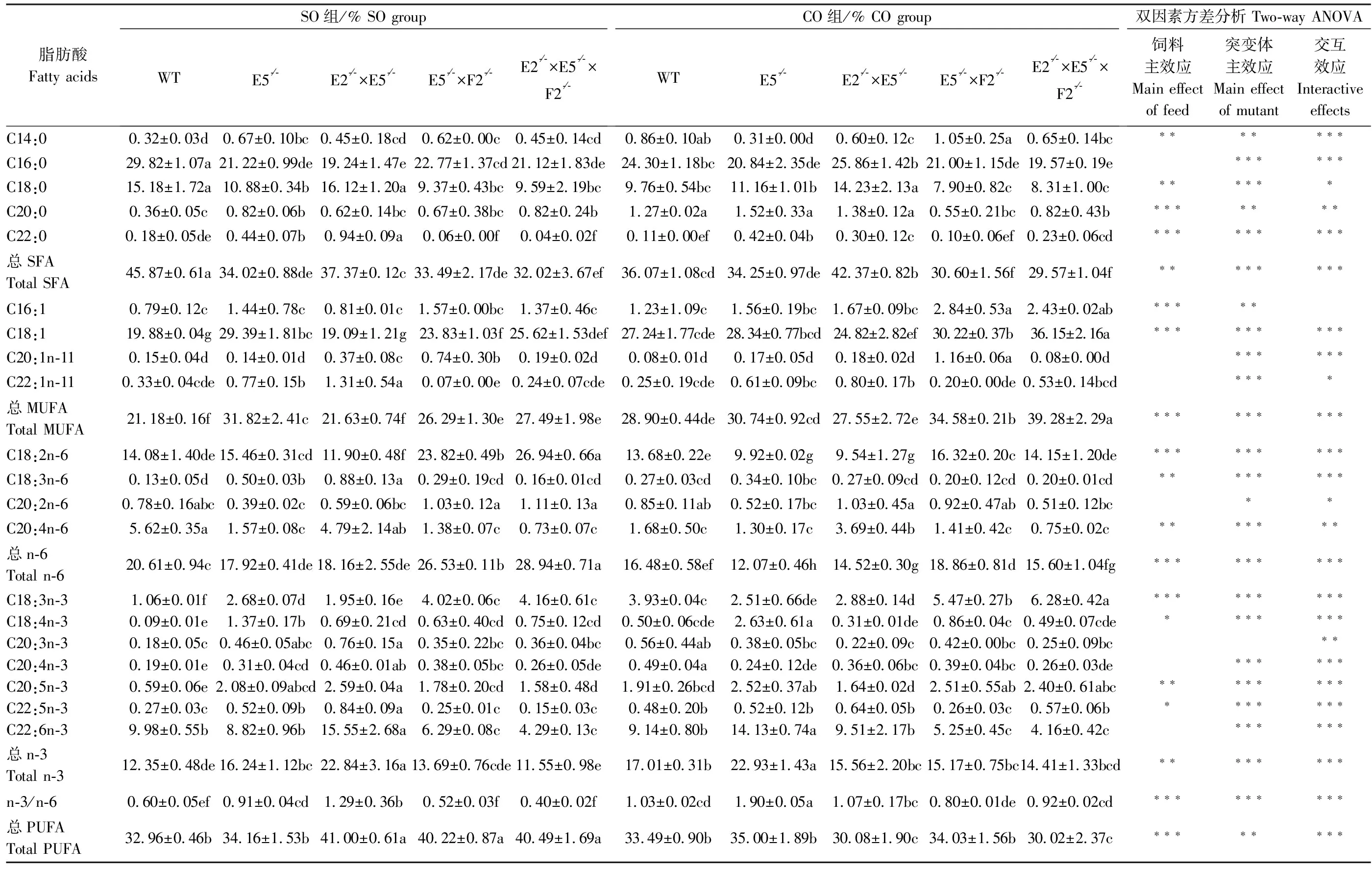
表3 斑马鱼肝脏脂肪酸组成(占总脂肪酸的百分比) Table 3 Fatty acid composition (percentage of total fatty acids) of zebrafish liver
斑马鱼fads6的功能目前未在酵母试验中得到证实,但有研究报道,fads6在淡水鱼中有微弱的Δ4去饱和功能[20]。荧光定量分析结果显示,fads6在SO饲料投喂的E2-/-×E5-/-组和E5-/-×F2-/-组以及CO饲料投喂的4组突变体中都被诱导表达,但fads6的高表达未能弥补fads2缺失导致的DHA含量下降,说明fads2在HUFA合成中不可或缺,fads2的缺失阻碍了相应HUFA的合成。E2-/-×E5-/-×F2-/-组的碳链延长和去饱和功能受到阻碍,这提示我们fads2是在elovl2和elovl5合成HUFA途径中的必要酶,去饱和酶的作用是不可被替代的。
在SO组中,E2-/-×E5-/-×F2-/-组的elovl4a、elovl4b和fads6的表达都未发生显著性变化,这与其在CO组的结果有明显差异。脂肪酸分析结果显示,SO饲料投喂后的E5-/-组DHA含量与WT无显著差异,E5-/-×F2-/-组较WT组DHA含量显著增加,然而CO饲料投喂后的E5-/-组DHA含量较WT组显著升高,E5-/-×F2-/-组与WT无显著差异(表3)。此外,在CO组中,各突变体的EPA含量与WT没有明显变化,这表明在底物n-3脂肪酸充足的情况下,EPA含量并不会因为elovl5缺失而发生变化。EPA含量是否是elovl5缺失后鱼体维持新稳态的重要指标,其分子机制还有待研究。
综上所述,本研究首次构建了elovl5和fads2的双基因敲除斑马鱼模型以及elovl2、elovl5和fads2三基因敲除斑马鱼模型。本研究数据表明,在投喂SO饲料和CO饲料后,在E5-/-组和E2-/-×E5-/-组中,C18PUFA到C20PUFA的延长仍然存在,这可能是“遗传补偿效应”的结果。而E5-/-×F2-/-组和E2-/-×E5-/-×F2-/-组摄食到的ALA和LNA在体内出现累积,表明fads2是elovl2和elovl5参与HUFA合成途径过程中的必需酶。elovl4和elovl4b会在elovl2、elovl5和fads2缺失后被诱导表达但不足以使脂肪酸恢复至正常水平。这更加突出了elovl2、elovl5和fads2在HUFA合成中的协同作用,证明了fads2对机体HUFA的合成至关重要。
