还原性谷胱甘肽联合核苷类似物治疗乙肝肝硬化临床研究
2021-09-27李明雪
李明雪
赤峰市医院消化内科,内蒙古赤峰 024000
乙肝是乙型肝炎病毒(HBV)感染引起的肝脏慢性疾病, 患者肝细胞在持续或反复的炎症中不断坏死和修复,会出现纤维瘢痕与结节,形成假小叶,是导致肝硬化最常见病因,数据统计占比超过60%[1]。 而肝硬化一旦进入失代偿期, 根据文献报道5 年生存率不足35%,因此有效控制乙肝肝硬化患者病情进展是改善预后、延长生存的关键。 核苷类似物是一类抗病毒药物,同时可以提高免疫,促进肝功恢复,是现阶段临床治疗乙肝及乙肝肝硬化常用药物[2]。 还原性谷胱甘肽是临床常用辅助用药, 可以通过与自由基结合生成易代谢的低毒性化学药物来发挥解毒的功效, 可以降低抗结核药物的毒性,预防肝脏损伤,修复受损肝细胞[3]。 该文现以2017 年1 月—2019 年12 月该院收治的104 例乙肝肝硬化患者为例, 探究联合核苷类似物治疗乙肝肝硬化的临床效果,现报道如下。
1 资料与方法
1.1 一般资料
在选择该院收治乙肝肝硬化患者中便利抽取104例为研究对象,随机数表法分为两组。 研究组(52 例):男性 31 例,女性 21 例;年龄 29~64 岁,平均(51.32±7.64)岁;病程 7~21 年,平均(12.72±4.14)年。 对照组(52例):男性 33 例,女性 19 例;年龄 27~65 岁,平均(50.88±7.39)岁;病程 8~20 年,平均(12.59±4.20)年。 两组基线资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
纳入标准:①既往乙肝病史,HBV 阳性,血液学或影像学检查提示门静脉高压或肝细胞合成功能障碍,组织学诊断为肝硬化,诊断符合中华医学会《慢性乙型肝炎防治指南》(2015 版) 关于代偿期乙肝肝硬化相关标准;②年龄≤65 岁的成人病例;③肝功能Child-Pugh A 级;④HBV BNA,乙型肝炎 E 抗原(HBeAg)阴性(-)者>2×102IU/mL,或 HBeAg 阳性(+)者>2×103IU/mL;⑤接受核苷类似物单药治疗或联合还原性谷胱甘肽治疗,疗程满12 个月;⑥患者及家属知情同意,签署知情同意书。
排除标准:①合并丙型肝炎、酒精性肝炎、自身免疫性肝病、 药物性性肝炎等其他可能引起肝硬化的疾病;②肝硬化失代偿期;③伴有食管胃底静脉曲张破裂出血、肝性脑病等严重并发症;④肌酐(Cr)>1.5 倍正常值上限或甲胎蛋白 (AFP)>100 ng/mL; ⑤合并恶性肿瘤、 重要脏器疾病及严重精神疾患; ⑥妊娠哺乳期女性;⑦各种原因换药或自行停药;⑧临床资料不全。
1.3 方法
对照组单纯以核苷类似物进行治疗, 患者用药拉夫米定(国药准字 H20113025),1 次/d,0.1 g/次,阿德福韦酯(国药准字 H20050651),1 次/d,10 mg/次。 研究组在对照组治疗基础上加用还原性谷胱甘肽 (国药准字H20050667),3 次/d,400 mg/次。 两组均连续用药 48周,期间定期随访,疗程满时评价疗效与安全性。
1.4 观察指标
比较观察两组治疗前及治疗12 个月后肝功能指标丙氨酸转移酶 (ALT)、 总胆红素 (TBIL)、 白蛋白(ALB)、凝血酶原活动度(PTA),肝纤维化指标层粘连蛋白(LN)、透明质酸酶(HA)、III 型前胶原(PCIII)水平,血清炎症因子肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、内皮素(ET),超声检查肝脏硬度值变化,以及血清学应答情况(HBeAg 转阴率与血清学转换率)和终点事件(肝硬化失代偿、原发性肝细胞癌、肝硬化相关死亡)发生率,统计不良反应。
1.5 统计方法
采用SPSS 21.0 统计学软件进行数据分析,计量资料用()表示,两组间比较采用独立样本t检验;计数资料采用[n(%)]表示,组间比较采用 χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者治疗前后肝功能指标比较
研究组治疗前肝功能指标 ALT、TBIL、ALB、PTA 与对照组差异无统计学意义(P>0.05),研究组治疗后ALT、TBIL 低于对照组,ALB、PTA 高于对照组, 差异有统计学意义(P<0.05),见表 1。
表1 两组患者治疗前后肝功能指标比较()
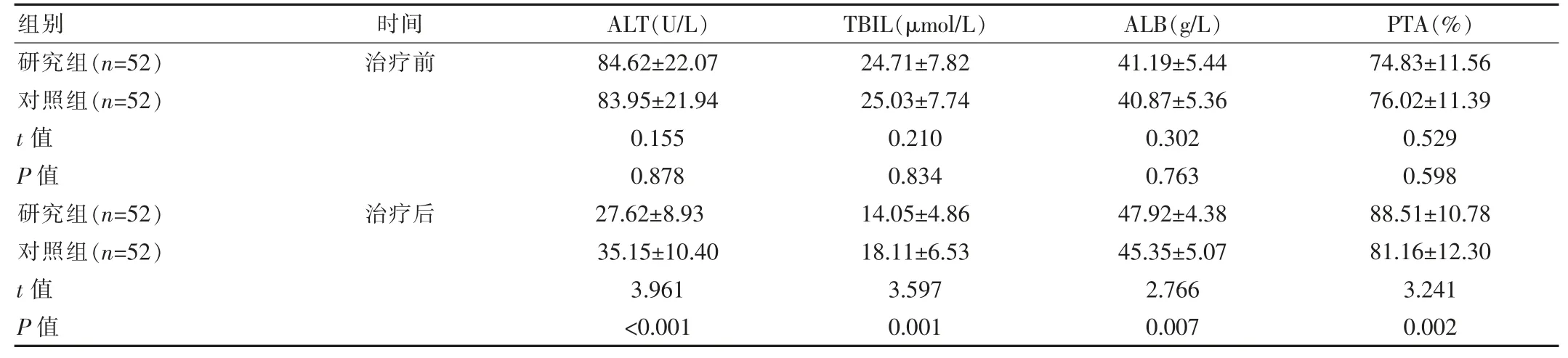
表1 两组患者治疗前后肝功能指标比较()
组别 时间ALT(U/L)TBIL(μmol/L)ALB(g/L) PTA(%)研究组(n=52)对照组(n=52)t 值P 值研究组(n=52)对照组(n=52)t 值P 值治疗前治疗后84.62±22.07 83.95±21.94 0.155 0.878 27.62±8.93 35.15±10.40 3.961<0.001 24.71±7.82 25.03±7.74 0.210 0.834 14.05±4.86 18.11±6.53 3.597 0.001 41.19±5.44 40.87±5.36 0.302 0.763 47.92±4.38 45.35±5.07 2.766 0.007 74.83±11.56 76.02±11.39 0.529 0.598 88.51±10.78 81.16±12.30 3.241 0.002
2.2 两组患者治疗前后肝纤维化指标比较
两组治疗前肝纤维化指标LN、HA、PCIII 差异无统计学意义(P>0.05),研究组治疗后3 项指标均较对照组降低,差异有统计学意义(P<0.05),见表 2。
表2 两组患者治疗前后肝纤维化指标比较()

表2 两组患者治疗前后肝纤维化指标比较()
组别 时间LN(μg/mL)HA(mg/L) PCIII(μg/L)研究组(n=52)对照组(n=52)t 值P 值研究组(n=52)对照组(n=52)t 值P 值治疗前治疗后238.42±39.11 239.60±37.52 0.157 0.876 104.29±21.64 155.70±28.93 10.261<0.001 197.82±21.81 199.04±22.57 0.280 0.870 104.31±19.64 147.55±20.83 10.891<0.001 202.30±25.74 201.77±16.91 0.124 0.902 99.79±18.45 148.60±18.22 13.574<0.001
2.3 两组患者治疗前后血清炎症因子水平比较
两组治疗前血清炎症因子指标TNF-α、IL-1β 与ET 差异无统计学意义(P>0.05),研究组治疗后 3 项指标均低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后血清炎症因子水平比较[(),pg/mL]
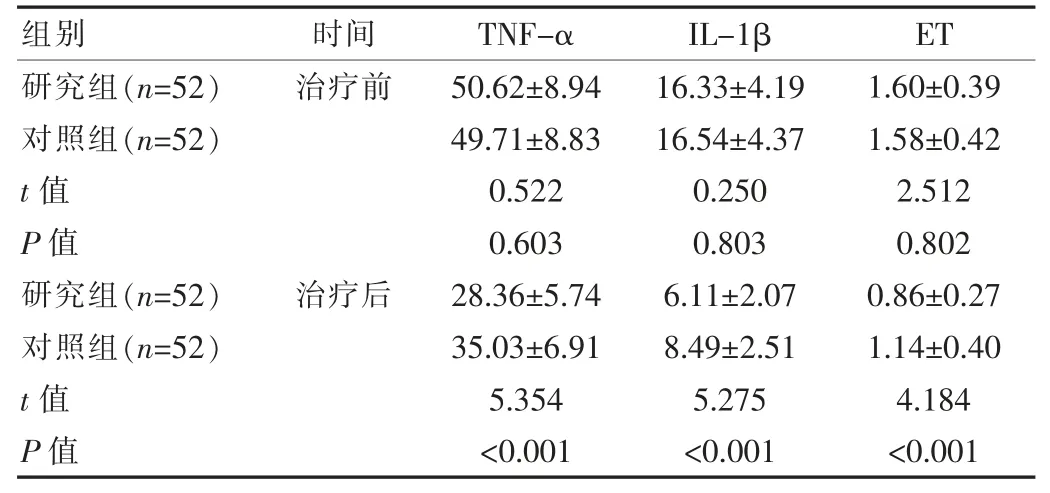
表3 两组患者治疗前后血清炎症因子水平比较[(),pg/mL]
组别 时间TNF-αIL-1β ET研究组(n=52)对照组(n=52)t 值P 值研究组(n=52)对照组(n=52)t 值P 值治疗前治疗后50.62±8.94 49.71±8.83 0.522 0.603 28.36±5.74 35.03±6.91 5.354<0.001 16.33±4.19 16.54±4.37 0.250 0.803 6.11±2.07 8.49±2.51 5.275<0.001 1.60±0.39 1.58±0.42 2.512 0.802 0.86±0.27 1.14±0.40 4.184<0.001
2.4 两组患者治疗前后肝脏硬度值比较
两组治疗前肝脏硬度值, 差异无统计学意义 (P>0.05),研究组治疗后肝脏硬度值较前明显降低,与对照组同期比较,差异有统计学意义(P<0.05),见表4。
表4 两组患者治疗前后肝脏硬度值比较[(),kPa]

表4 两组患者治疗前后肝脏硬度值比较[(),kPa]
组别 治疗前 治疗后t 值 P 值研究组(n=52)对照组(n=52)t 值P 值22.51±7.64 22.82±7.37 0.211 0.834 8.71±3.52 15.26±4.91 7.818<0.001 11.830 6.156<0.001<0.001
2.5 两组患者治疗后血清学应答情况比较
研究组HBeAg 转阴率与HBeAg 血清转换率均低于对照组,差异有统计学意义(P<0.05),见表 5。

表5 两组患者治疗后血清学应答情况比较[n(%)]
2.6 两组患者治疗后终点事件比较
研究组终点事件发生率低于对照组, 但差异无统计学意义(P>0.05),见表 6。

表6 两组患者治疗后终点事件比较
2.7 两组患者用药相关不良反应比较
两组用药期间不良反应发生率差异无统计学意义(P>0.05),见表 7。

表7 两组患者用药相关不良反应比较
3 讨论
持续有效的抑制HBV 复制,可以减轻乙肝肝硬化患者的肝脏坏死性炎症, 对延缓病症进入失代偿引起严重并发症、改善患者预后具有重要意义[4]。 以核苷类似物治疗乙肝,目前临床可用药物众多,其中拉米夫定是首个被批准使用的药物。 该品为抑制病毒药,服用后可转化为活性物质拉夫米定三磷酸盐, 快速抑制HBV复制,从而减轻肝脏损害,促进肝功能恢复[5]。 一项双盲临床试验表明, 合并肝纤维化或已经发生代偿性肝硬化的乙肝患者经3 年拉夫米定治疗, 肝功能失代偿与原发性肝癌发生率明显降低[6],肯定了该品可以延缓肝炎肝硬化进展的作用效果。 但是长期应用拉米夫定,HBV 易发生基因突变,耐药性增强,导致该品抗病毒作用减弱,造成疾病反弹[7]。
根据我国最新指南建议, 对于经治疗以及出现拉夫米定耐药的患者, 建议首选拉夫米定联合阿德福韦酯或替诺福韦单药治疗[8]。 该次临床研究纳入的乙肝肝硬化患者病程长,均为经治疗病例,故以核苷类似物治疗时,均选用拉夫米定联合阿德福韦酯的治疗方案。 其中, 阿德福韦酯为5’-单磷酸脱氧阿糖腺苷的无环类似,用药后可以转化为活性物阿德福伟二磷酸盐,通过抑制HBV DNA 多聚酶来抑制病毒复制, 持续降低HBV DNA 水平[9]。 该药病毒变异率低,联合拉夫米定使用可以强化HBV DNA 抑制效果, 从而保证抗病毒效果,持续发挥改善肝脏损害、促进肝功恢复的作用效果[10]。有研究显示,以拉夫米定联合阿德福韦酯治疗乙肝,可以更好地促进ALT 复常,改善肝组织坏死及纤维化,对预防乙肝肝硬化以及延缓病症进展具有积极作用[11]。
还原性谷胱甘肽是一种游离三肽, 属于非酶性氧化剂, 含有硫原子与氢原子相连组成的官能团-巯基,该物质可以与人体自由基结合加速其排泄, 同时具有参与机体多蛋白质合成、参与三羧酸循环、激活酶类等生理功能,可以帮助维持人体正常代谢,保护细胞膜完整,同时增强细胞免疫功能,提高细胞抵抗力,减少致病性因素损伤肝脏[12-13]。 有研究表明,还原性谷胱甘肽可以通过转甲基和转丙氨基作用, 加速肝内胆汁酸与胆红素代谢,从而减轻肝细胞负担,达到保护肝脏的目的[14]。 另有研究发现,还原性谷胱甘肽具有抑制炎症介质过度释放的作用,可以调控机体炎症反应,抑制巨噬细胞产生TNF-α、IL-6 等内源性细胞因子,从而阻断炎症综合反应恶化与进展[15]。该次临床研究以此联合核苷类似物治疗乙肝肝硬化, 结果显示患者治疗后HBeAg转阴率与HBeAg 血清转化率均明显提高,肝功能指标、血清炎症因子水平均较对照组明显改善, 肝脏硬度值从原来的(22.51±7.64)kPa 降至(8.71±3.52)kPa,明显优于对照组(P<0.05),与文献报道的还原性谷胱甘肽联合核苷类似物治疗后患者肝脏硬度值降至 (8.55±3.27)kPa的研究结论相符[16],提示联合治疗可以有效强化HBV抑制效果,延缓肝纤维化,降低机体炎症,促进患者肝功能恢复。 患者治疗期间未发生终点事件,发生率低于对照组,但差异无统计学意义(P>0.05),考虑与研究随访的时间较短有关。 目前已有研究证实,两类药物联合使用可以降低肝硬化失代偿与肝癌发生, 对促进预后改善具有积极作用[17-18]。
综上所述, 在核苷类似物拉夫米定联合阿德福韦酯基础上加用还原性谷胱甘肽治疗代偿期乙肝肝硬化,可以更好地抑制病毒复制,降低炎症反应,改善患者肝功能,延缓肝纤维化进程,患者用药耐受良好,应用安全有效,值得临床推广。
