膳食结构和成分通过调控肠道菌群影响食物过敏的研究进展
2021-09-27刘翼翔李东慧王彦波傅玲琳刘光明
刘翼翔,马 玉,李东慧,王彦波,,傅玲琳,刘光明
(1.集美大学海洋食品与生物工程学院,福建 厦门 361021;2.浙江工商大学食品与生物工程学院,浙江 杭州 310018)
人类肠道菌群是指生活在人类消化系统中微生物的总称,人类肠道中约有1 000~1 150 种近100万亿 个细菌,是人类细胞数量的10 倍,每个人肠道内至少有160 种优势菌群[1]。健康人体胃肠道内90%以上的细菌为厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),还有变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)和梭杆菌门(Fusobacteria)等不太丰富的门类[1]。这些微生物之间存在着直接或间接的相互作用,并通过直接接触、分泌蛋白质或代谢产物与宿主形成复杂的互作网络,构成一个动态平衡的微生态系统,这个系统与人体健康和疾病息息相关[2]。肠道正常菌群最主要的功能是帮助宿主消化食物。此外,还具有免疫调节[3]、抗炎[4]、抗癌[5]、调节血压[6]、缓解营养不良症状[7]等其他重要功能。一些研究还表明,人类的各种慢性疾病如糖尿病、高血压、脑病、心血管疾病和肥胖等的发生都与肠道微生物系统密切相关[8]。
食物过敏作为一种过敏性疾病,是临床上最常见、最重要的过敏反应之一[9]。食物过敏的发生不仅与遗传因素有关,还受外部环境如饮食、抗生素、疫苗、卫生条件的影响,而所有这些外部环境主要作用于肠道菌群的结构和功能,其中饮食对肠道微生物群的数量和构成影响最大[10]。越来越多的证据表明肠道菌群在食物过敏的发病机制和进程中可能发挥作用。本文综述了饮食结构及膳食成分影响肠道菌群的研究现状,以期为未来利用饮食来平衡肠道菌群、预防和治疗过敏性疾病提供理论依据。
1 食物过敏概述
食物过敏是指通过免疫机制对摄入食物产生的不良反应,可分为免疫球蛋白(immunoglobulin,Ig)E介导和非IgE介导[11]。其中以IgE介导的I型超敏反应最为常见,可引起恶心、呕吐、胀气、腹痛、腹泻等一系列的速发反应和症状[12],并且会感染到皮肤和呼吸道,严重时可引起过敏性休克等全身反应,甚至有致命的危险[13-14]。流行病学调查结果显示,IgE介导的食物过敏对大约5%的成人和8%的儿童造成影响[15],8 种主要过敏性食物(牛奶、花生、小麦、鸡蛋、大豆、坚果、鱼和甲壳类动物)引起了90%的食物过敏疾病[16-17]。
如图1所示,当食物过敏原进入人体后,会由树突状细胞(dendritic cells,DCs)等抗原递呈细胞(antigenpresenting cells,APCs)收集并递呈给肠系淋巴结中的辅助型T(helper T,Th)0细胞,使Th0细胞向Th2细胞分化,Th2细胞分泌白细胞介素(interleukin,IL)-4、IL-5和IL-13等细胞因子诱导B细胞分化为浆细胞,产生特异性的IgE抗体,然后IgE会与肥大细胞和嗜碱性粒细胞表面的高亲和力受体——结晶段受体I(fragment crystallizable receptor I,FcεRI)结合,使机体对该过敏原产生过敏反应;当过敏原再次进入机体时,会立即与IgE结合,IgE激活效应细胞表面的FcεRI,引起细胞脱颗粒,释放细胞内贮存的组胺、白三烯和IL等炎症介质,从而迅速导致呼吸道、胃肠道、皮肤乃至全身的过敏症状[18]。正常情况下,机体内的辅助型T淋巴细胞亚群Th1/Th2细胞会处于平衡状态,然而当过敏人群接触食物过敏原时,Th1/Th2细胞的平衡会被打破,向Th2型反应倾斜,使过敏患者的靶细胞向Th2细胞大量聚集。但经过治疗后,Th2细胞会转为Th1细胞,恢复平衡状态[19]。因此,将免疫平衡从Th2细胞方向转移到Th1细胞方向被认为是纠正与食物过敏相关的T细胞免疫异常的一种有效策略[20]。
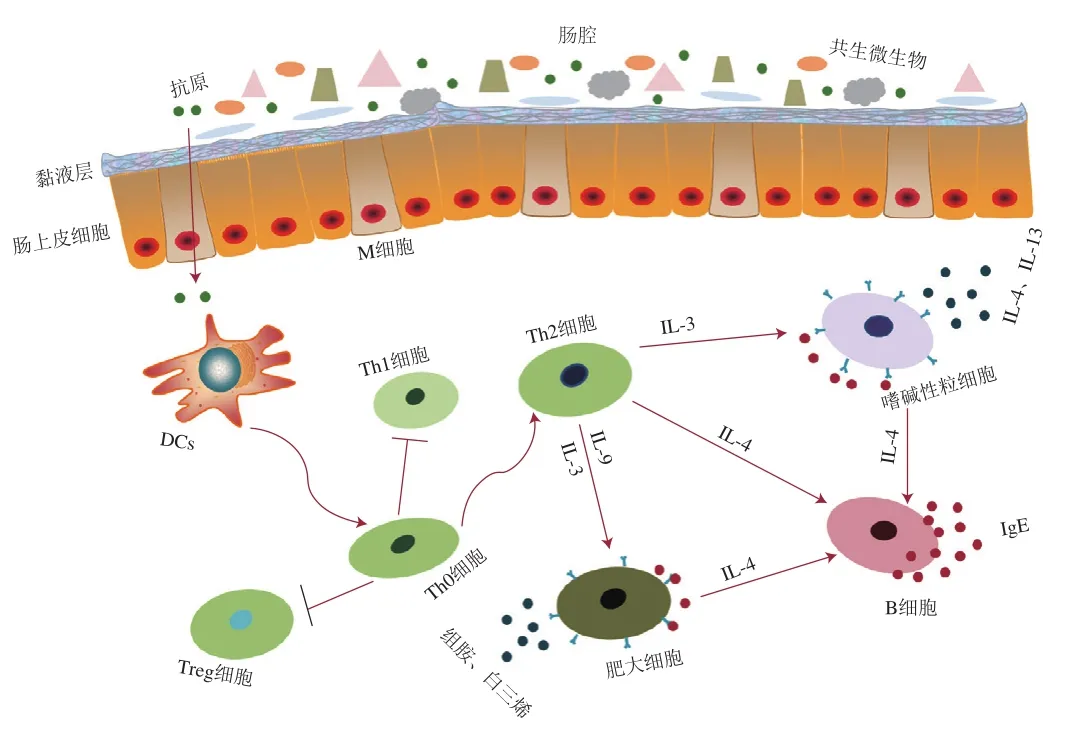
图1 食物过敏机理Fig.1 Mechanism of food allergy
2 肠道菌群与食物过敏的关系
人类肠道中99%以上的微生物都是细菌。根据其功能可分为有益细菌(双歧杆菌、乳酸杆菌)、有害细菌(产气荚膜梭菌、金黄色葡萄球菌)和中性细菌(大肠杆菌、肠球菌)。正常情况下肠道菌群组成保持相对稳定,对人类先天性和适应性免疫系统的发育及功能起着重要作用。然而,当肠道菌群受到外界条件(如抗生素)的干扰时,胃肠道中的这种动态平衡被打破,肠道有害菌易位至固有层与免疫细胞接触,引起黏附失衡、生物拮抗机制失衡和肠黏膜屏障功能障碍,使机体失去对某些正常抗原的免疫耐受,从而导致过敏性疾病的发生[21]。
早在1989年,“卫生假说”就提出儿童早期缺乏微生物接触是导致发生过敏性疾病的主要原因,且儿童体内Th1/Th2免疫失衡,使免疫反应更倾向于Th2型炎症反应,进而增加了过敏性疾病的发病率[22];Cahenzli等[23]研究发现无菌小鼠由于缺乏肠道菌群,会导致Th1/Th2的平衡向Th2偏移,所以更容易产生过敏反应;最近有研究还发现保持一定数量和种类的肠道菌群是有效避免食物过敏的必要条件[24]。Björkstén等[25]的研究显示过敏反应的发生与肠道菌群结构变化有关,表现在过敏儿童肠道需氧菌较多,尤其是梭菌和金黄色葡萄球菌数量多,而乳酸杆菌和双歧杆菌数量少。Watanabe等[26]发现同健康人群的肠道菌群相比,过敏性皮炎患者肠道中双歧杆菌的数量明显较少,而葡萄球菌的相对丰度却是健康人群的1.4 倍,并且有数据表明,越严重的患者肠道内的双歧杆菌相对丰度越低。同样地,Nowrouzian等[27]通过研究发现,肠道微生物群中的金黄色葡萄球菌生长会影响过敏性皮炎的发展。除了过敏性皮炎,过敏性湿疹的发生与肠道菌群也紧密相关。Penders等[28]发现过敏性湿疹婴儿肠道中大肠杆菌的数量比健康婴儿多35%。此外,过敏性湿疹儿童肠道中双歧杆菌和乳杆菌含量明显降低,而肠球菌属和克雷伯氏菌属的含量明显增加[29],且肠道内微生物的多样性显著降低[30]。总地来说,肠道内有益菌数的减少、有害菌数的增多以及中性菌的过度繁殖都与过敏性疾病的发生密切相关。
由于肠道菌群失衡会增加过敏性疾病的发病风险,因此,保持肠道内微生物的平衡成为预防和治疗过敏性疾病的重要手段。Martin等[31]发现灌胃副干酪乳杆菌NCC2461可减少小鼠粪便菌群中金黄色葡萄球菌的相对丰度,增加双歧杆菌的相对丰度。表1列举了部分已被报道的具有治疗食物过敏效果的益生菌。目前研究表明,口服益生菌主要通过改善肠道菌群紊乱和减少过敏介质的产生,从而维持Th1/Th2细胞的平衡,使过敏症状减轻。由此可见,对肠道菌群的调控成为控制食物过敏发生和发展的重要方式。

表1 益生菌在治疗食物过敏中的应用Table 1 Application of probiotics in alleviating food allergy
3 饮食结构通过肠道菌群影响食物过敏
西方饮食、东方饮食和地中海饮食为当今世界范围3 种主要饮食结构,西方饮食由于其动物性食物的占比较大、粮谷类食物的占比过少而具有“高热量、高脂肪(胆固醇)和高蛋白”的特点,因此具有高糖、高脂和高蛋白饮食结构;东方饮食以中国为代表,动物性和植物性食物的摄入比较均衡,但近年来,盐成分的摄入量增加引起一系列慢性疾病,高盐饮食也越来越得到人们的广泛关注;地中海饮食以蔬菜水果、鱼类、五谷杂粮、豆类和橄榄油为主,营养均衡、合理健康,得到营养学家的大力推崇。
3.1 高脂饮食
高脂饮食膳食中的脂肪能量占总能量的35%~45%,且脂肪中饱和脂肪酸比例较高,占膳食能量的18%。Hussain等[41]研究发现高脂饮食喂养会导致小鼠肠道微生物多样性减少,促进肥大细胞的聚集,增加对食物过敏的易感性。动物实验表明,高脂饮食能增加大鼠肠道中的颤螺菌属(Oscillospira)的相对丰度,显著提高厚壁菌门和拟杆菌门的相对丰度,降低乳酸菌和双歧杆菌等保护性功能菌的相对丰度[42],使肠通透性增加并降低肠上皮细胞紧密连接的表达[43],导致肠屏障功能障碍。短链脂肪酸(short-chain fatty acids,SCFAs)可以通过激活相关信号通路影响Treg细胞分化和B细胞产生IgA、IL-22的能力[44]。研究发现,高脂饮食通过改变肠道微生物结构使SCFAs的产生减少,进而改变肠道通透性以及免疫平衡[44],增加了食物过敏的发生风险。
3.2 高糖饮食
糖类是一切生命体维持生命活动所需能量的主要来源。随着生活水平的提高,含糖食品无处不在,尤其是儿童食品和含糖饮料。已有多项研究表明,食用过量高糖食品会影响机体正常的糖代谢,引起糖尿病、高血压、肥胖症等慢性病。张芹等[45]比较了高糖和普通饮食对小鼠肠道菌群的影响,结果显示,与正常饮食小鼠相比,高糖饮食组小鼠粪便样品中厚壁菌属数量多49%,而拟杆菌属数量只有正常组小鼠的10%,且其肠道菌群多样性更低。Jena等[46]也发现高糖饮食可增加肠道内大肠杆菌和梭菌的相对丰度,降低乳酸杆菌的相对丰度,并通过变性梯度凝交电泳法研究了粪便微生物群和血清中促炎症细胞因子的组成,发现各种组织中TLR2、TLR4和NF-κB的表达量上升,血液及组织中炎症反应增强,显著影响其代谢状况。显然,高糖饮食与高脂饮食类似,其对肠道菌群的负面影响将会提高食物过敏发生的可能性。
3.3 高蛋白饮食
膳食蛋白质是结肠微生物生长的主要氮源。每天有10 g左右蛋白质进入结肠,蛋白质在大肠中由拟杆菌属和梭状芽孢杆菌发酵成一系列产物,这些产物与氨基酸组成有关,例如,支链氨基酸经脱氨作用生成支链脂肪酸,包括异丁酸和异戊酸[47]。过量蛋白质在结肠中可以被分解为短肽和氨基酸以提高肠道内的pH值,提高细菌蛋白酶和肽酶在中性和碱性条件下的活性,从而对肠道菌群的生长环境、种类以及丰度产生影响[48]。de Filippo等[49]通过比较动物蛋白摄入量高的欧洲(European,EU)儿童和以碳水化合物为主要膳食的非洲布基纳法索(Burkina Faso,BF)儿童肠道菌群,发现放线菌门和拟杆菌门在BF儿童肠道菌群中的比例高于EU儿童,而厚壁菌门和变形菌门在EU儿童肠道菌群中的丰度比BF儿童更高,且EU儿童和BF儿童肠道菌群的厚壁菌门与拟杆菌门相对丰度之比分别为2.80±0.06和0.47±0.05。Paula-Silva等[50]研究了无蛋白饮食对小鼠食物过敏和口服耐受的影响,发现无蛋白饮食喂养的小鼠上皮淋巴细胞和杯状细胞的数量减少,肠绒毛伸长,sIgA和血清免疫球蛋白水平降低,表现出免疫功能的受损和口服耐受能力的不足,对食物的过敏性增加。研究证实,肠道微生物利用蛋白质产生的一些代谢产物(如吲哚)能够促进肠上皮细胞紧密连接的表达和减少炎症因子的产生,从而改善宿主免疫[51]。因此,适量摄入蛋白质对促进免疫系统的成熟和提高肠黏膜免疫屏障功能具有重要作用,从而能够有效预防食物过敏。
3.4 高盐饮食
盐是日常生活中最基本、最常用的调味品和必需品,也是各类膳食制作必不可少的重要组成部分[52]。在中国,人均膳食盐的摄入量(13.51 g/d)是世界卫生组织推荐摄入量(5 g/d)的2.5 倍多,高盐的摄入使得高血压、中风等慢性病的发病率显著升高[53],成为危害国民身体健康的最大隐患之一。高盐饮食除了会导致心血管疾病的发生和增加肾脏负担以外,还会对肠道菌群产生直接损害作用。Miranda等[54]发现高盐饮食使乳酸菌的相对丰度降低了75%,丁酸盐产量下降了1/3;并通过增加促炎基因(如Rac1、Map2k1、Map2k6、Atf2)的表达,以及抑制多种细胞因子和趋化因子基因(如Ccl3、Ccl4、Cxcl2、Cxcr4、Ccr7)的表达影响结肠和小肠黏膜免疫功能,破坏肠道免疫稳态,使其更容易受到炎症的攻击。高盐饮食还会增加肠道固有层中产生IL-17A细胞的频率,刺激肠道的Th17反应,抑制IL-10的分泌和Treg细胞的功能,对肠道免疫系统具有显著破坏作用[55]。由此可见,高盐饮食会破坏肠道菌群及黏膜免疫,对食物过敏存在负面影响。
3.5 地中海饮食
营养学家发现生活在地中海沿岸的周边国家居民心血管疾病、糖尿病和癌症的发病率很低,平均寿命比西方饮食人群长17%,经过大量调查发现该地区的饮食结构是引起这一现象的主要原因。该饮食结构最主要的特点是以食用橄榄油为主,摄入富含营养的新鲜水果蔬菜类、豆类、坚果类和谷物,适量摄入红酒,少量食用植物油、乳制品、鱼类、红肉及精加工食品等。de Filippis等[56]发现食用富含植物性食物的饮食能显著增加粪便中SCFAs浓度,且SCFAs浓度与普雷沃氏菌属(Prevotella)的丰度呈正相关。有研究表明,地中海饮食可以增加肠道菌群的多样性,维持完整的肠道屏障功能,平衡Th17细胞与Treg细胞的比例,减少促炎因子的产生[57],从而降低食物过敏发生的风险。
4 膳食成分对肠道菌群及肠屏障的影响
膳食成分作为肠道细菌的能量代谢来源,在改变肠道微生物组成和影响肠道屏障功能完整性方面发挥着重要作用[58]。除了上述饮食结构中含有的三大营养素和盐成分外,还有其他一些膳食成分对肠道菌群也具有一定影响。膳食纤维作为第七大营养素,其保健功能长期以来备受关注,对食物过敏的影响也有所报道。其他膳食成分包括酒精、辛辣成分、维生素、膳食多酚以及微量元素对食物过敏是否具有潜在的作用还鲜有研究进行说明,但它们对肠道菌群和肠屏障的调节作用已被确定。
4.1 膳食纤维
饮食中除了含单糖(如葡萄糖、果糖)、双糖(如蔗糖、麦芽糖)等容易被人体吸收的糖类外,还含有大量不被人体消化的多糖,即膳食纤维[59]。人体自身不能分泌分解这些多糖所必需的多糖水解酶,但肠道菌群可以分泌多种多糖水解酶来降解膳食纤维,并将其作为自身的能量来源[49]。食品中的膳食纤维主要包括抗性淀粉、非淀粉多糖和低聚糖,它们能诱导肠道分泌多糖水解酶的细菌生长[60]。Walker等[61]对14 名控制饮食的超重男性的肠道菌群进行研究,结果显示,高抗性淀粉饮食可使肠道中厚壁菌相对丰度增加,非淀粉多糖和低糖饮食可使拟杆菌相对丰度增加,表明膳食纤维可以增加肠道内拟杆菌属和厚壁菌门的相对丰度,从而避免肥胖。膳食纤维还可以有效促进一些益生菌的生长,如低聚果糖可以使肠道内双歧杆菌的比例从12.4%提高到21.0%[62]。Sonnenburg等[63]研究了具有人类微生物菌群的小鼠在低纤维饮食下时肠道微生物的变化,结果表明,低纤维饮食导致小鼠肠道内的微生物多样性显著降低,而将小鼠饮食转为正常的纤维饮食时,这种微生物的多样性却无法恢复。Zhang Zhiyu等[64]发现低纤维饮食加重了OVA诱导的过敏小鼠的炎症反应,而摄入的膳食纤维通过抑制血清OVA特异性IgE水平,减少Th2细胞因子的生成而增加Th1细胞因子的释放,显著抑制过敏反应;此外,膳食纤维的摄入也增加了拟杆菌门和放线菌门的相对丰度,减少了厚壁菌门和变形菌门的相对丰度,显著提高了乳酸杆菌和双歧杆菌等益生菌的相对丰度。膳食纤维由肠道菌分解代谢产生大量内源性SCFAs,而膳食纤维和细菌SCFAs可以通过增强CD103+DCs中视黄酸脱氢酶活性和Treg细胞的分化以及IgA的生成从而促进口服耐受和预防食物过敏[65]。
4.2 酒精
酒因其独特的口味和多样性在世界各地广受欢迎。现代医药学家已经证明适度饮酒可以促进血液循环,刺激中枢神经,产生兴奋,在止痛、保护心肌细胞和神经元方面有显著作用[66]。然而,长期过量饮酒会引起人体肠黏膜的损伤且对肝脏功能有一定的损害[67],增加慢性胃炎、糖尿病和心血管疾病的发生率[68]。范观宇等[68]研究发现,与对照组相比,低酒精量摄入组小鼠肠道内乳酸菌数量显著增加,大肠杆菌和细菌总数显著降低;而高酒精量摄入组小鼠肠道乳酸菌和双歧杆菌数量均显著降低;说明低酒精摄入量能调节小鼠肠道菌群结构,抑制大肠杆菌等有害细菌的生长,而高酒精摄入会导致有益细菌数量减少,造成肠道菌群失调,过量的酒精也会导致肠黏膜损伤,导致肠道炎症的发生。Chen Peng等[69]研究发现酒精通过增加能产生肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的单核-巨噬细胞数量,引起菌群失调,诱发肠道炎症;生物失调诱导的肠上皮细胞中肿瘤坏死因子受体I信号的传导介导了肠道屏障的破坏,使肠道通透性增加,导致微生物产物转移到肝脏,从而引起酒精性肝病。也有研究报道酒精摄入会导致肠上皮紧密连接的松弛,使过敏原更易进入肠道固有层,这样会更易引发Th2型过敏反应[70]。
4.3 辛辣成分
中国饮食文化由于其风味多样,讲究“色、香、味、形”俱全而闻名世界。我国就有不少地方喜食辛辣食物。辛辣食物是指具有尖锐而强烈刺激性的食物,包括葱、蒜、韭菜、生姜、酒、辣椒、花椒、胡椒、桂皮、八角、小茴香等。研究发现,辣椒素可以增加大鼠肠道内普雷沃氏菌(Prevotella)、乳酸菌(Lactobacillus)和阿克曼菌(Akkermansia)的相对丰度,增加产SCFAs细菌相对丰度,降低革兰氏阴性菌(S24-7)的相对丰度以及脂多糖(lipopolysaccharide,LPS)合成功能,增加肠道屏障连接蛋白——闭合小环蛋白1(zonula occludens 1,ZO-1)和occludin基因的表达,从而改善体内慢性炎症水平,可以预防肥胖[71]。Antunes等[72]发现口服辣椒素可以减轻OVA致敏小鼠体内的炎症和氧化应激水平,减少IL-33的生成,对食物过敏具有良好的改善作用。大蒜的杀菌作用早已被人们熟知,吴曼曼等[73]研究发现大蒜素能增加肠道内双歧杆菌等益生菌的生长,同时抑制肠球菌等病原菌的增殖,对急性酒精性肝损伤伴有的肠道菌群失调具有一定的预防作用。生姜是我国中医药中常用的药食两用材料,陶俊等[74]发现生姜也能显著增加小鼠肠道内双歧杆菌和乳酸杆菌等益生菌数量,而显著减少大肠杆菌和肠球菌的数量,并且还能显著提高肠黏膜表面的sIgA和肠组织匀浆上清IL-2的水平,提高肠道局部免疫功能。因此,辛辣成分不仅能提供良好的风味,对肠道健康也具有积极影响。然而,这些成分是否具有潜在致敏性还有待进一步研究。
4.4 维生素
维生素是人和动物为维持正常的生理功能而必须从食物中获得的一类微量有机物质,在人类的生长、代谢和发育过程中起着重要的作用。目前,人类发现的维生素有20多种。最近,有些维生素对肠道菌群的影响被报道出来。Xiao Sa等[75]发现VA能降低志贺氏杆菌(Escherichia-Shigella)在肠道中的比例,显著提高拟杆菌属的相对丰度,降低炎症因子水平,提高Claudin-1、Occludin、ZO-1表达水平,减轻炎症反应,增强肠上皮屏障功能,对坏死性小肠结肠炎有保护作用。Xun Pengwei等[76]发现在金枪幼鱼日粮中添加VB1会增加肠道内假单胞菌(Pseudomonas)的相对丰度,降低支原体和志贺氏杆菌的相对丰度,增加微生物群落的丰富度和多样性,膳食VB1也在一定程度上能增加肠道微绒毛的长度和相对丰度,促进肠道健康。栾子健[77]研究发现VD3可抑制炎症相关结直肠癌小鼠模型中小鼠结直肠癌肿瘤的数目和大小,降低粪便菌群中拟杆菌门相对丰度,增加乳酸杆菌的相对丰度,并降低结肠黏膜菌群中普氏菌和乳酸杆菌相对丰度;VD3还可通过上调上皮钙黏素表达、抑制波形蛋白表达,提高肠道上皮细胞间紧密连接,增强肠上皮的屏障功能。
4.5 膳食多酚
在水果、蔬菜、谷类、茶叶、咖啡等食品中,存在着许多具有重要功能的酚类化合物,即膳食多酚[78]。膳食多酚具有抗氧化、抗肿瘤、保护肝脏及抗肥胖等多种生物活性[79],然而由于绝大部分多酚是在人体肠道中被肠道菌群所降解,提示多酚生理活性可能是通过对肠道菌群的调节实现。大量研究表明,多酚类物质可以抑制肠道内有害菌群的生长繁殖,促进有益菌如乳杆菌、双歧杆菌等的生长[80-81];还能降低厚壁菌门与拟杆菌门的比值,减轻由高脂饮食引起的肥胖和其他代谢综合症[82-84]。Mine等[85]发现从中国甜茶中提取的多酚类物质可以增加OVA致敏小鼠Foxp3+Treg细胞的比例,抑制IL-4的产生,促进IL-10、IL-12a和INF-γ的产生,调节Th1/Th2细胞平衡,减少炎症介质如组胺和肥大细胞蛋白酶-1的释放,减轻小鼠的OVA过敏反应。除了茶多酚之外,一些多酚类提取物如表儿茶素[86]、白藜芦醇[87]、槲皮素[88]等也被发现具有类似的抗食物过敏疗效。
4.6 微量元素
微量元素指人体内含量少于体质量万分之一的元素,主要包括铁、铜、锰、锌、铬、镍、氟、硒、碘、硅、锡等。虽然人体对微量元素需要量较小,但由于其在人体内发挥着强大的生物学作用而受到人们的重视。微量元素的主要吸收途径是通过胃肠道和呼吸道,因此也会对肠道菌群产生影响。陈冬梅等[89]发现适量补充硒能够提高小鼠肠道的微生物多样性,下调炎症因子IL-6、IL-1β和TNF-α的表达,抑制肠道炎症反应。然而硒摄入可能与过敏性哮喘期间发生的炎症和Th2免疫反应不是呈简单的剂量依赖效应,适量的低硒摄入才会降低过敏性气道炎症的易感性[90]。周桂莲等[91]研究发现微量元素铁、铜、锌能够减轻仔猪的肠道炎症,改善粪便状况。高剂量氧化锌还可以通过抑制细菌的黏附和内化,阴止紧密连接通透性的增加和调节细胞因子基因的表达来保护肠细胞免受产肠毒素性大肠杆菌感染,通过提高肠上皮细胞的电阴抗,修复由大肠杆菌引起的肠黏膜屏障损伤[92]。随着年龄的增长,机体对微量元素的吸收能力下降,若不及时补充,可能对肠道菌群及其健康造成重要影响。
5 结 语
许多饮食成分都可以直接或间接影响食物过敏,其主要通过作用于肠道微生物。如图2所示,肠道微生物对食物过敏的调控机制可以概括为3 个方面:1)微生物通过直接作用Th0细胞或者通过DCs传导信号使其分化为Th1细胞或Treg细胞,Th1细胞分泌的IFN-γ可以抑制Th2细胞的分化,维持肠道内的Th1/Th2细胞平衡[93],Treg细胞可以通过分泌TGF-β、IL-10等抗炎因子来促进口服耐受[94],并且刺激B细胞产生IgA和IgG4,进入肠腔维护免疫耐受[95];2)SCFAs是结肠细胞的主要能量来源,饮食成分通过改变肠道菌群结构而使SCFAs产生菌的水平受到影响,SCFAs可以刺激诱导肠道上皮细胞中的炎症小体活化,导致IL-18和抗菌肽的分泌和释放,从而强化上皮屏障功能[96],并且SCFAs还能通过G-蛋白偶联受体(G protein-coupled receptors,GPRs)传递信号,刺激Treg细胞的分化,影响B细胞产生IgA的能力[44];3)肠道微生物与DCs、巨噬细胞、先天淋巴细胞相互作用,促进IL-22的产生,刺激肠道干细胞介导的上皮再生,维护肠道功能完整性[97]。

图2 肠道微生物调节食物过敏机制Fig.2 Mechanism by which intestinal microbes regulate food allergy
目前,食物过敏引起的一系列速发临床症状主要依靠药物进行控制和治疗,虽然这些抗食物过敏药物成本低且见效快,但长期使用容易产生耐药性,并且对肠道益生菌有一定程度的损害,甚至会引起菌群的再次紊乱。因此,迫切需要一种健康有效的方式来替代药物治疗,干预食物过敏。随着生活水平和营养意识的提高,人们越来越注重饮食对肠道微生物和人体健康的作用。肠道微生物作为膳食与健康关系之间的桥梁,合理的膳食干预可以有效改善由食物过敏引起的肠道菌群代谢紊乱和健康威胁。因此,饮食作为肠道微生物的生态驱动力,对肠道菌群的调节和优化以及人类健康水平的提升具有巨大的现实意义。本文综述了饮食结构和膳食成分对肠道菌群的改变以及肠道菌群与食物过敏之间的联系,希望可以以肠道菌群为靶点,通过膳食干预来预防和治疗食物过敏。目前很少有研究将日常饮食与调节食物过敏联系起来,对饮食影响肠道菌群的作用机制少有深入探究,将来可以朝此方向继续挖掘探讨。
