2’-岩藻糖基乳糖的微生物合成研究进展
2021-09-27瓮茹茹卫鑫慧李浩正路福平
瓮茹茹,卫鑫慧,李浩正,路福平,李 玉*
(天津科技大学生物工程学院,省部共建食品营养与安全国家重点实验室,工业微生物教育部重点实验室 天津 300457)
母乳寡糖(human milk oligosaccharides,HMOs)是存在于母乳中仅次于乳糖和脂肪的第三大类营养物质,在婴幼儿的生长发育中起重要作用[1]。HMOs的结构非常多样化,目前已鉴定出200多种寡糖,其中2’-岩藻糖基乳糖(2’-fucosyllactose,2’-FL)含量最高,约占总量的31%[2]。2015年9月由Glycom A/S公司进行化学合成的两种HMOs——2’-FL和乳糖基-N-新四糖(lacto-N-neotetrasaccharide,LNnT),作为婴幼儿配方奶粉中的新型添加剂在美国获得第一批监管批准(并于2016年11月批准其微生物发酵产品),到2019年11月,欧盟批准2’-岩藻糖基乳糖/二岩藻糖乳糖混合物作为新型食品投放市场,这些授权促进了2’-FL的全球商业化,其首先是用作补充婴儿配方食品的成分,还可用作膳食补充剂和医疗食品。此外,对2’-FL的食品安全性以及作为婴儿食品添加剂的安全性进行评估,发现婴儿奶粉中添加1 g/L是安全的[3];其他研究表明,添加2’-FL到低热量婴儿配方奶粉中,摄入奶粉的婴儿可以达到与摄入母乳同样的效果[4]。
从结构组成来说,2’-FL是在还原性末端连接有一个乳糖,在非还原端一个岩藻糖(fucose,Fuc)通过α-1,2-键与乳糖结构中的半乳糖(galactose,Gal)连接(图1)[5]。研究表明,在肠道中,2’-FL可被有益微生物利用,从而调节肠道微生物菌群[6];还可抑制弯曲杆菌与人肠黏膜的结合,从而减少腹泻[7];也可以通过调节人肠道上皮细胞CD14的表达,从而减轻炎症[8]。体外研究发现,2’-FL可使空肠弯曲杆菌对人体的侵袭能力降低80%,从而抑制肠道黏膜促炎因子和信号的释放[9],并减少由空肠弯曲杆菌引发婴儿腹泻的次数[10]。所以在婴儿奶粉中加入食品级微生物生产的2’-FL可以增强新生婴儿的免疫力,并有效增强新生婴儿体质[11]。2’-FL还可以通过提高非致病菌共生体的竞争优势来间接抑制致病菌的生长,并能直接充当抗黏附抗菌剂减少微生物感染,使摄入2’-FL的婴儿不容易患由肺炎链球菌、绿脓杆菌引起的中耳炎[12]。此外,2’-FL在大脑发育、神经元传递和突触的形成中也起作用,能够刺激大脑发育[13-14],所以在饮食中添加2’-FL可以促进大脑发育并且能够改善学习和记忆能力。由于2’-FL的突出生理功能,使得2’-FL成为市场上的急需产品。但目前2’-FL的产量还远不能满足日益增长的需求,因此,如何提高2’-FL的生产规模,以满足食品工业生产的需求,是值得思考的问题。

图1 2’-FL的结构[5]Fig.1 Structure of 2’-FL[5]
目前合成2’-FL的方法主要有化学合成法和生物合成法。化学合成方法中利用结晶媒介技术可实现2’-FL的合成[15],但最终得率不足10%,该合成策略存在反应步骤多、得率较低的问题。随后,一锅法(one-pot)的出现一定程度地提高了2’-FL得率(仍然不足50%),但此法仍需10 步以上的反应[16]。由此可见,化学法合成2’-FL虽然取得了很大的进步,但是合成过程中需要对每个2’-FL分子进行重复且多次的保护和去保护,过程繁琐,还会降低产率并且增加成本[17],想要利用化学合成法真正实现2’-FL的大量合成仍然十分困难。利用微生物进行2’-FL的合成是目前大规模生产2’-FL的可行性方法,而且微生物合成的2’-FL与天然的2’-FL在功能上相同,临床试验也不会引起不良反应。与化学合成方法相比,微生物合成方法更加安全快捷,合成过程中不用引入大量的有毒试剂,更是可以直接用食品安全级别的微生物生产2’-FL,这样大大增加了产物的安全性。然而没有任何一种已知的微生物具有直接合成2’-FL的代谢途径。研究表明,在大肠杆菌(E.coli)中过表达不同来源的糖基转移酶可以实现将内源和外源的糖基受体转化成各种类型的HMOs[18],合成2’-FL的最高产量达到47.0 g/L[19]。其他微生物如酿酒酵母、枯草芽孢杆菌和谷氨酸棒状杆菌等,通过表达合成2’-FL的相关基因也已经成功合成2’-FL。
2’-FL的微生物合成是在α-1,2-岩藻糖基转移酶(α-1,2-fucosyltransferase,1,2-FT)的作用下,将岩藻糖基残基从鸟苷5’-二磷酸-L-岩藻糖(guanosine 5’-diphosphate-L-fucose,GDP-L-fucose)转移到乳糖上[20]。GDP-岩藻糖作为合成2’-FL的供体,在微生物合成方法中确定了两种不同的代谢途径:从头合成途径和补救合成途径[21]。2’-FL的生物合成过程如图2所示。1996年Stevenson等发现GDP-岩藻糖作为荚膜异多糖酸的前体之一存在于大肠杆菌中[22],随后研究人员进一步探究了GDP-岩藻糖的从头合成途径[23]。补救合成途径最初发现仅存在于真核生物中[24],直到Coyne等从脆弱类拟杆菌(Bacteroides fragilis9343)中发现双功能酶L-岩藻糖激酶/GDP-岩藻糖焦磷酸化酶(L-fucokinase/GDP-fucose pyrophosphorylase,FKP)[25],才确定在原核生物中也存在2’-FL的补救合成途径。
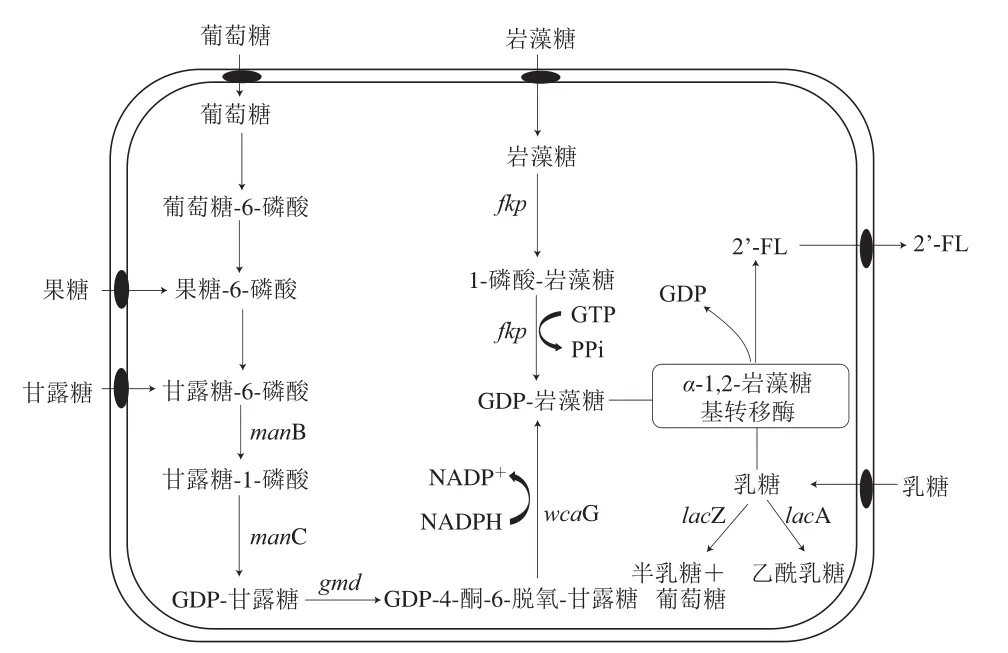
图2 2’-FL的微生物合成途径[23,25]Fig.2 Biosynthesis pathway for 2’-FL[23,25]
1 微生物合成2’-FL的关键步骤和限制因素
1.1 GDP-岩藻糖的含量
GDP-岩藻糖作为2’-FL合成的关键前体,其含量对于2’-FL的高效生产具有重要意义[26]。在微生物合成方法中确定了GDP-岩藻糖的两种不同合成途径:从头合成途径和补救合成途径。在从头合成途径中,辅因子NADPH在实现GDP-岩藻糖高浓度和高生产率方面起重要作用[27],其来源主要有磷酸戊糖途径(pentose phosphate pathway,PPP)、三羧酸(tricarboxylic acid,TCA)循环和脱氢酶系统(图3A)[28]。通过过表达zwf、gnd、icd、pntAB和gapN基因,可以显著促进NADPH再生、GDP-岩藻糖的形成和2’-FL的产生[6,29-30]。GTP作为GDP的供体和能源物质,则参与到GDP-岩藻糖的补救合成过程中,其主要来源是鸟嘌呤核苷的代谢(图3B)。通过操纵GTP的生物合成途径,过表达xpt、guaA、gmk、ndk和deoD基因,敲除ykfN和guaC基因,也能够提高GDP-岩藻糖的合成量[31-33]。

图3 微生物合成2’-FL的辅助因子的来源途径[29,33]Fig.3 Sources and reaction pathways of cofactors for the biosynthesis of 2’-FL[29,33]
1.2 岩藻糖基转移酶的活性
1,2-FT能将岩藻糖基残基从GDP-岩藻糖转移到乳糖上,是2’-FL生产过程中的核心酶,其来源不同不仅决定了2’-FL的形成速率,而且决定了有无副产物的形成。然而,微生物来源的1,2-FT活力是一般代谢酶活力数百分之一,是合成2’-FL的限制因素。现阶段合成2’-FL的过程中,主要是通过筛选微生物来源的高活力1,2-FT来提高2’-FL的产量。到目前为止,已经筛选并验证了几种酶活力较高的1,2-FT,其中,幽门螺杆菌(Helicobacter pylori)来源的FutC和FucT2是目前使用最多的1,2-FT,此外Chin等通过在FucT2的N端加入3 个天冬氨酸标记,使2’-FL的浓度提高了约2.5 倍[34],但发现FutC会催化产生副产物二岩藻糖乳糖。为获得其他高活力的1,2-FT,Chin等[35]继续在碳水化合物活性酶数据库(CAZy)中,通过比对FucT2的氨基酸序列,从11 个预测的基因中筛选出来源于脆弱类杆菌(Bacteroides fragilis)的wcfB基因,用其取代FucT2,使大肠杆菌工程菌发酵液中的2’-FL产量提高了10 倍,且无副产物二岩藻糖乳糖的产生。而Seydametova等[36]利用基因筛选方法从安全菌来源中鉴定出10 个1,2-FT的候选基因,最后筛选出一种来源于长热性球菌 (Thermosynechococcus elongatus)的Te2FT,与FutC相比,使大肠杆菌工程菌发酵液中的2’-FL含量提高了2.7 倍。
1.3 2’-FL的输出
对于所有宿主菌,大部分的2’-FL都无法输出到细胞外,而胞内积累过多的2’-FL可能会通过反馈作用来抑制2’-FL的继续合成。有效地将2’-FL输出细胞会降低其反馈抑制作用,减少副产物形成,同时促进生产并方便下游纯化[37],但有关这方面的研究报道还比较少。Jennewein等首先发现糖转运体SetA在大肠杆菌中的过表达实现了3’-FL的输出[38]。Hollands等证实表达大肠杆菌的SetA和粗糙脉孢菌的纤维糊精转运体CDT2能够将2’-FL从酵母细胞中输出[39]。然而Zhai Yafei等研究发现SetA的表达也能将乳糖输出细胞[31],所以SetA的过度表达是否有利于2’-FL的产生还有待进一步的研究。
2 大肠杆菌合成2’-FL的途径改造与优化
大肠杆菌是研究较为透彻的模式微生物,在实验研究和工业生产中,大多数用于HMOs生产的发酵过程仍然使用大肠杆菌。在合成2’-FL的过程中,由于大肠杆菌本身具有合成和代谢GDP-岩藻糖的能力,研究者们多是通过改造,在增加GDP-岩藻糖积累、提高乳糖的岩藻糖基化的基础上来提高2’-FL的产量,具体优化方法如表1所示。

表1 大肠杆菌中合成2’-FL代谢途径的优化Table 1 Optimization of metabolic pathways for the synthesis of 2’-FL in E.coli
2.1 增加GDP-岩藻糖的积累
GDP-岩藻糖是在细胞质中通过从头合成途径或补救合成途径获得的,其含量决定了2’-FL的整体生产力以及产量[40]。除了可以通过调节辅因子NADPH和GTP的再生来提高GDP-岩藻糖的产量,还可以通过基因工程技术在提高GDP-岩藻糖合成的同时抑制其代谢,从而增加GDP-岩藻糖的积累。在从头合成途径中,主要是过表达关键酶基因manB、manC、gmd、wcaG[41],过表达rcsA、rcsB基因[42],敲除GDP-岩藻糖支路代谢路径相关基因如wcaJ、lon[43]从而提高GDP-岩藻糖的合成量。其中,RcsA和RcsB是大肠杆菌合成荚膜异多糖酸的一种正转录调控因子,能够使GDP-岩藻糖合成途径中相关基因的表达能力上调,但会被温度敏感的ATP依赖性蛋白酶Lon迅速降解;所以,过表达rcsA或rcsB基因同时敲除lon基因可提高GDP-岩藻糖的合成量[44]。WcaJ是荚膜异多糖酸合成途径中的UDP-葡萄糖脂质载体转移酶,敲除wcaJ基因可避免GDP-岩藻糖代谢为荚膜异多糖酸,从而实现GDP-岩藻糖在细胞质的积累[43]。Huang Di等通过过表达关键酶基因以及rcsA基因,敲除wcaJ、lon基因,得到9.12 g/L的2’-FL[6]。
在补救合成途径中,底物L-岩藻糖可以通过L-岩藻糖异构酶(L-fucose isomerase,FucI)、L-岩藻糖激酶(L-fuculose kinase,FucK)和L-岩藻糖1-磷酸醛缩酶(L-fucose 1-phosphate aldolase,FucA)的连续反应进行代谢[45]。同时,D-阿拉伯糖异构酶(D-arabinose isomerase,D-AraA)、L-鼠李糖异构酶(L-rhamnose isomerase,L-RhaA)[46]也会催化岩藻糖异构化。因此,为使L-岩藻糖的代谢更多的趋向GDP-岩藻糖,Jung等通过敲除分解岩藻糖的araA、rhaA、fucI、fucK基因以及分解乳糖的lacZ基因,在大肠杆菌BL21(DE3)中过表达fkp和fucT2基因,最终得到2’-FL的产量为47.0 g/L[19]。
2.2 提高乳糖的岩藻糖基化
乳糖作为受体底物,必须保证其胞内有足够量可用于合成2’-FL。大肠杆菌中存在将胞外乳糖运输到胞内的乳糖透过酶基因(lacY)[42],同时也存在代谢乳糖的β-半乳糖苷酶基因(lacZ),为了阴断细胞内乳糖的代谢,一般是删除内源性的lacZ基因,或是选择β-半乳糖苷酶缺陷型(lacZ)的大肠杆菌JM109作为宿主菌[40]。但文献报道,在大肠杆菌BL21(DE3)中缺失lacZ基因后并没有发现2’-FL的产生,这表明乳糖的转运受到lacZ基因缺失的影响[34]。这可能是因为lacZ基因的缺失是极性突变,影响缺失位点下游基因或操纵子的转录或翻译,导致lacY基因表达的乳糖透过酶合成减少[47]。因此为了减缓乳糖的代谢又不改变对乳糖的运输功能,可对lacZ基因进行部分敲除,如用含有lacZΔM15(lacZ敲除第11~42密码子)修饰的lac操纵子取代内源性lac操纵子,与野生型大肠杆菌相比,β-半乳糖苷酶的活性降低了97%[34];还可通过敲除lacZ基因,同时过表达lacY基因,来实现β-半乳糖苷酶的活性降低,而乳糖透过酶活性不变[6]。
除了保证有足够的乳糖用于合成2’-FL外,还必须提高岩藻糖基转移酶的活性以提高乳糖的岩藻糖基化水平[48]。所以,选择和表达高活力的岩藻糖基转移酶基因是提高2’-FL产量的另一重要步骤。研究发现,并非所有的岩藻糖基转移酶都能利用乳糖作为唯一受体产生2’-FL。来自幽门螺杆菌(Helicobacter pylori)的futC和fucT2基因表达活性较高,但其可以利用多种底物[20],这一特性使其在产生2’-FL的同时会产生不同类型的低聚糖副产品。而来源于脆弱类杆菌(Bacteroides fragilis)的wcfB基因的出现解决了这个问题[35]。另外,最新筛选得到的来源于长热性球菌(Thermosynechococcus elongatus)的Te2FT,不仅使2’-FL的产量提高了,而且总2’-FL中只有12.3%是胞内的,其余87.7%存在于发酵上清液中;而依靠FutC产生的2’-FL中,胞内含量达到49%[36]。这一特性说明Te2FT的表达可使2’-FL外排更容易。
3 其他微生物合成2’-FL的研究进展
到目前为止,在2’-FL的生物合成中主要宿主菌是大肠杆菌,其生产2’-FL的能力最高可达到47.0 g/L。但是除大肠杆菌外,其他微生物如酿酒酵母、枯草芽孢杆菌和谷氨酸棒状杆菌等也已经被选为生产2’-FL的宿主菌,因为它们通常被认为是安全的(generally recognized as safe,GRAS),而且已被广泛应用于食品和制药行业。
3.1 酿酒酵母合成2’-FL
酿酒酵母(Saccharomyces cerevisiae)是一种单细胞真核微生物,也是发酵中最常用的生物种类,具有生长周期短、发酵能力强、容易进行大规模培养以及含有丰富的营养成分等优点,一直是基础及应用研究的主要对象,在食品、医药等领域应用广泛[49]。在酵母的细胞质中存在相对丰富的GDP-甘露糖来源[50],通过表达外源gmd和wcaG/GMER基因或fkp基因可以成功合成GDP-岩藻糖[51-53]。酿酒酵母不具有2’-FL的外排活性,在酿酒酵母细胞中构建2’-FL的代谢途径,可得到总产量为0.5 g/L的2’-FL[54-55]。Hollands等通过筛选在酿酒酵母中表达能够分泌2’-FL的转运体CDT2(来源于Neurospora crassa),使2’-FL的最高产量达到了15 g/L[39]。在补救合成途径中,酿酒酵母细胞中由于缺乏岩藻糖转运体[56],致使岩藻糖利用率较低、细胞内GDP-岩藻糖水平不够高,这可能是限制2’-FL产量的另一重要因素。通过筛选获得岩藻糖转运体并在酿酒酵母中表达,会是提高2’-FL产量的有效措施。
3.2 枯草芽孢杆菌合成2’-FL
枯草芽孢杆菌(Bacillus subtilis)为革兰氏阳性菌,其生长、繁殖速度较快,可形成内生抗逆芽孢,由于其较高的分泌和生产能力,加上粗放的发酵培养要求,长期以来一直被用作生产工业酶、维生素、功能性糖等的细胞工厂[57-59]。此外,还针对枯草芽孢杆菌开发了多种遗传工具,以便更安全和更有效地生产食品添加剂[60]。上述工作的开展使枯草芽孢杆菌成为2’-FL生产的理想宿主。枯草芽孢杆菌本身不表达乳糖透过酶基因,通过在基因组中插入外源乳糖透过酶基因,并表达外源fkp基因和岩藻糖基转移酶基因,即可实现2’-FL的生产。在Deng Jieying等[61]的一项研究中,通过对底物岩藻糖运输和GTP再生模块进行优化——引入了一种编码L-岩藻糖渗透酶的基因(glcP),微调GTP再生模块基因,并敲除内源性β-半乳糖苷酶基因(yesZ),成功地构建了一种高效生产2’-FL的枯草芽孢杆菌菌株,2’-FL的最高产量达到5.01 g/L,岩藻糖和乳糖的2’-FL产率分别达到0.85 mol 2’-FL/mol岩藻糖和0.27 mol 2’-FL/mol乳糖。虽然工程枯草芽孢杆菌2’-FL的产量低于工程大肠杆菌的产量(47.0 g/L),但岩藻糖的2’-FL产率高于工程大肠杆菌(0.52 mol 2’-FL/mol岩藻糖),这也是工程枯草芽孢杆菌合成2’-FL的一个优势。枯草芽孢杆菌中不具有2’-FL转运体,进一步在枯草芽孢杆菌中表达2’-FL转运蛋白基因,还可能会大幅度提高2’-FL的产量。
3.3 谷氨酸棒状杆菌合成2’-FL
谷氨酸棒状杆菌(Corynebacterium glutamicum)是目前全球用以氨基酸发酵工业的主要生产菌,最重要的是,其具有较高的NADPH再生能力[62],这是合成GDP-岩藻糖过程中所需的辅助因子。谷氨酸棒状杆菌本身具有manB和manC基因,可将甘露糖转化为GDP-甘露糖,Chin等[63]发现,通过过表达gmd、wcaG、manB和manC,以葡萄糖和甘露糖为底物,可提高目标产物GDP-岩藻糖的产量,含量达到5.5 mg/gmd,是相同条件下大肠杆菌的2.4 倍。在此基础上表达岩藻糖基转移酶基因fucT2和乳糖透过酶基因lacY,以葡萄糖和乳糖为底物,通过分批补料式培养,最终2’-FL的产量达到5.8 g/L;进一步对基因fucT2进行密码子优化后,2’-FL的最终产量达到了8.1 g/L[64]。
通过优化改造后GRAS微生物生产2’-FL的能力见表2。

表2 GRAS微生物生产2’-FL的能力Table 2 GRAS microbial capacity to produce 2’-FL
4 结 语
近年来,国际上对2’-FL生产和用途的研究热度逐渐提高,如何高效、安全地生产2’-FL正受到越来越多的关注。但是,目前国内外对于2’-FL生产菌株构建技术的研究尚处于前期阶段,主要以合成途径的构建和优化为主。2’-FL的生产包括4 个关键部分:GDP-岩藻糖的产生、乳糖的有效供给、岩藻糖基转移酶的选择以及2’-FL的外排。目前对于GDP-岩藻糖的产生和乳糖的有效供给研究比较多,进一步通过改造提高1,2-藻糖基转移酶的活性,或筛选其他高效的2’-FL转运蛋白会是提高2’-FL产量的方向。此外,在菌株水平上,传代过程中会因为质粒的不稳定性导致目的基因丢失,最重要的是抗生素的使用在食品安全生产中存在风险,所以将目的基因整合到染色体上进行过表达会相对安全许多。据报道,Baumgärtner等以β-半乳糖苷酶缺陷型(lacZ-)的大肠杆菌JM109为宿主菌,通过在染色体上整合从头合成途径和补救合成途径的相关基因来生产2’-FL,2’-FL的产量可达20.28 g/L[41]。但是,选择食品安全级微生物,例如广泛用于乳制品生产的乳酸乳球菌(Lactococcus lactis)作为生产2’-FL的宿主菌,在不引入抗性基因的同时在染色体上整合合成2’-FL的基因,同时优化代谢途径,可能是生产2’-FL时更具应用前景的方法。
