三氯蔗糖对小鼠肠道微生态及机体免疫的影响
2021-09-27徐境含徐珒昭孔祥丽张天阳冯熙瑞武明月滕国新许晓曦
徐境含,徐珒昭,孔祥丽,张天阳,冯熙瑞,武明月,滕国新,许晓曦,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.内蒙古蒙牛乳业(集团)股份有限公司,内蒙古 呼和浩特 011500)
三氯蔗糖是一种人工合成的含氯甜味剂,有低能量、高甜度、性质稳定的特点,在饮料、糕点、糖果等食品中被广泛应用[1]。随着消费者对健康饮食的意识逐渐增强,人工甜味剂应用的安全性倍受广大消费者及使用者的关注。目前已有研究证实,甜味剂的摄入可引起体质量和腰围的增加及肥胖、高血压、代谢综合征、2型糖尿病和心血管疾病的发病率升高,甜味剂摄入量与发胖、高血压、代谢综合征、糖尿病和心脑血管疾病之间存在重要的相关性。三氯蔗糖作为目前应用最为广泛的蔗糖替代品,其对人体健康是否存在负面影响成为备受消费者关注并亟待解决的科学问题。
近年来,越来越多的研究结果证实,膳食成分对肠道微生态具有极其重要的影响,肠道微生态的改变可影响肠道菌群与宿主细胞之间的相互作用,引发炎症,从而导致慢性炎症性疾病的发生[2]。肠道是机体重要的免疫器官,肠道屏障和肠道内环境及其代谢物的相互作用形成肠道稳态[3],肠道微生物结构变化会引起代谢物的改变,当肠道屏障功能受损、肠道通透性增强时,肠道细菌产生的有害物质及促炎因子透过肠黏膜进入其他组织,导致机体持续的炎症和肠道组织损伤[4],并引发自身免疫性疾病、代谢性疾病、癌症、心血管疾病和神经疾病等疾病[5]。随着环境和食物中的抗生素和农药等在人体的暴露剂量逐渐增加,研究人员在人体肠道菌群中发现了耐药性基因[6],这些因素能够引发机体肠稳态失衡,一旦有对肠道稳态起负面作用的外界因素介入,即会促使肠道微生态恶化和免疫系统受损,进而引起各类疾病的出现。食品添加剂通过对肠道菌群以及肠屏障的作用进而干预机体免疫,甚至引发各类疾病等问题。已有的研究表明,人工甜味剂可改变肠道微生物群的组成,影响宿主健康[7-11]。研究发现,经三氯蔗糖干预后肠道微生物中的耐药基因增加,从而导致更恶劣的肠道环境[12]。Bian Xiaoming等[10]连续6 个月向雄性BALB/c小鼠饮用水中添加三氯蔗糖,并通过16S rRNA、代谢组学等分析三氯蔗糖对小鼠肠道微生物的影响,结果表明,三氯蔗糖使小鼠肠道微生物的代谢谱发生改变,并诱发肝脏炎症。因此,相关研究尚无法确定三氯蔗糖绝对安全并适合长期食用。
本实验通过探究三氯蔗糖摄入导致肠道微生态变化对小鼠肠道菌群多样性及物种组成的影响,并结合多项指标综合推断由肠道微生物结构变化导致机体免疫屏障受损而引发慢性疾病的可能。为三氯蔗糖对人体健康不良作用机制提供研究参考,同时为人工甜味剂的实际应用提供指导及理论支持。
1 材料与方法
1.1 动物、材料与试剂
4 周龄清洁级雄性BALB/c小鼠(体质量(16±2)g左右)购自北京维通利华试验动物技术有限公司,实验动物生产许可号:SCXK(京)2016-0006。动物饲料购自北京科澳协力饲料有限公司。
三氯蔗糖(IS0770) 北京索莱宝科技有限公司;小鼠血清白细胞介素(interleukin,IL)-1β、小鼠血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、小鼠肠道组织分泌型免疫球蛋白(secretory immunoglobulin A,SIgA) 南京建成生物工程研究所。
磷酸盐缓冲液 美国HyClone公司;无水乙醇天津市天力化学试剂有限公司;氯化钠(分析纯)天津市天大化学试剂厂;二甲苯、盐酸、氨水、中性树交 国药集团化学试剂有限公司;苏木素-伊红染液上海碧云天生物技术有限公司。
1.2 仪器与设备
DHP-9162型电热恒温培养箱 上海一恒科技有限公司;3K15高速冷冻离心机 德国Sigma公司;BSA224S型分析天平 德国Sartorius公司;HBS-1096A酶标仪 南京德铁实验设备有限公司;RLE30086V型超低温冰箱 美国赛默飞世尔科技有限公司;JJ-12J型脱水机、JB-P5型包埋机、JB-L5型冻台 武汉俊杰电子有限公司;RM2016型病理切片机 德国徕卡仪器有限公司;KD-P型组织摊片机 浙江省金华市科迪仪器设备有限公司;BS203型正置光学显微镜 重庆广电仪器有限公司。
1.3 方法
1.3.1 实验分组及取样
小鼠适应性饲养4 d后分组进行实验,40 只小鼠随机分为空白对照(Control)组、低剂量三氯蔗糖(L-S)组、中剂量三氯蔗糖(M-S)组、高剂量三氯蔗糖(H-S)组,每组各10 只。Control和L-S、M-S、H-S组小鼠每天分别灌胃0.1 mL纯净水和0.1 mL作用剂量分别为15、25、50 mg/kgmb的三氯蔗糖溶液,低剂量根据食品添加剂可接受的三氯蔗糖每日摄入量选取,中剂量依据《食品安全国家标准 食品添加剂使用标准》[13]饮料中三氯蔗糖的最大添加限量选取,高剂量为中剂量的2 倍。每天灌胃时间固定,持续42 d。所有小鼠在标准条件下12 h明暗周期饲养,标准取食及饮水。实验室条件保持在(22±2)℃的恒定温度。
实验第43天,将各组小鼠无水乙醚麻醉后眼球取血,分离得血清[14]。取血后颈椎脱臼处死并在无菌操作台内进行解剖,测定小鼠脾脏、胸腺质量。小鼠腹腔剖开取出完整肠道,取2 g盲肠内容物保存于1 mL冻存管中,液氮速冻后立即保存于-80 ℃冰箱备用;取1 cm回肠放入质量分数10%中性福尔马林溶液中固定,待后续切片观察。
1.3.2 16 S rDNA高通量测序
将1.3.1节中保存于-80 ℃冰箱的小鼠粪便样品取出,每组随机选取3个样品进行16S rDNA高通量测序。使用Fast DNA SPIN提取试剂盒提取细菌基因组总DNA,使用正向引物338F(5′-ACTCCTACGGGAGAGGCAGCA-3′)和反向引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌的16S rDNA基因V3~V4可变区进行聚合酶链式反应扩增。运用Illlumina MiSeq平台和MiSeq试剂盒V3的双末端2×300 bp测序。使用QIIME v1.8.0软件进行序列分析,高质量序列以97%的序列同一性聚类为可操作的分类单位,即操作分类单元(operational taxonomic units,OTU)[15]。
将该OTU中的序列比对到Silva数据库并使用QIIME v1.8.0软件注释到相应的微生物种类,将测序数据与代表序列进行比对,得到每个OTU在该样品中的丰度;按丰度从大到小进行排列,使用R v3.1.1软件作图得到丰度等级曲线;根据Chao1指数、Observed Species指数、Shannon指数及Simpson指数算法进行α多样性分析,同时基于Unweight UniFrac计算方法进行β多样性分析;利用QIIME软件[16]对OTU进行物种组成分析;最后通过LEfSe软件[17],根据组间差异显著的物种进行各组物种丰度差异分析,并将检测到的某分类存在组间差异的微生物群落或物种绘制成丰度直方图。
1.3.3 小鼠体质量及脏器指数的测定
小鼠自适应性饲喂结束后,开始每周固定时间称量并记录其体质量。按1.3.1节取样方法获取脾、胸腺的质量,计算脾脏指数(脾脏质量/体质量)和胸腺指数(胸腺质量/体质量),单位均为mg/g。
1.3.4 小鼠血清炎症因子白细胞介素-1β含量的测定
采用酶联免疫法中的双抗体夹心法测定小鼠IL-1β含量,所有样品均严格按照试剂盒说明书进行操作。
1.3.5 小鼠肠黏膜分泌型免疫球蛋白水平的测定
取每组小鼠1 cm回肠样品,轻轻挤去食糜,用4 ℃去离子水冲洗。纵向剪开肠壁,滤纸吸水后用载玻片轻轻刮取小肠黏膜,称取1 g左右的黏膜,按质量体积比1∶9加入pH 7.2、0.1 mol/L磷酸盐缓冲液,使用匀浆器将黏膜冰浴匀浆,将匀浆4 ℃、3 000×g离心10 min后取上清液。试剂盒双抗体夹心法测定小鼠SIgA水平[18]。
1.3.6 小鼠小肠病理切片观察
将1.3.1节中保存于福尔马林溶液的回肠进行脱蜡二甲苯处理10 min,100%、90%、80%、70%乙醇溶液复水5 min,蒸馏水清洗后,苏木素染色2 min、伊红染色3 min、脱水封片,然后进行显微镜镜检,采集图像进行分析。
1.4 数据处理与分析
实验数据采用Excel软件进行处理,实验结果以平均值±标准差表示,使用SPSS 20软件进行单因素方差分析,P<0.05表示差异显著。采用Origin Pro 8.5.1软件绘图。
2 结果与分析
2.1 三氯蔗糖对小鼠肠道菌群结构的影响
2.1.1 物种多样性分析结果
OTU丰度等级曲线分析如图1所示,丰度等级曲线是展现样品中物种多样性的一种形式,可以同时解释样品多样性的两个方面,即样品所含物种的丰富程度和均匀程度。

图1 测序样品的物种丰度等级曲线Fig.1 Rank-Abundance curves of sequenced samples
由图1可知,测序样品的物种丰度排序主要分布在100~500之间,该范围各曲线变化趋势已趋于平缓,接近平台期,继续增加取样量只会产生极少量新的OTU,说明其高通量测序深度能够满足本研究的分析要求。本实验的12 份样品曲线走势显示在横轴上的排序范围和平滑程度均有较大差异,亦说明小鼠样品间表现出不同的丰度和均匀度。
α多样性主要反映样品内多样性。本实验通过Chao1指数、Observed Species指数、Shannon指数、Simpson指数评估各组之间的α多样性,Chao1指数主要反映菌群丰度,Observed Species指数表示样品中含有的物种数目,Shannon指数用来估算样品中微生物的多样性,Simpson指数表示优势物种在群落中的所占比例的大小。
由表1可知,除M-S组与Control组Simpson指数差异不显著,三氯蔗糖的干预导致H-S组、M-S组、L-S组相较于Control组4 种指数均显著降低。随着三氯蔗糖干预剂量的增加,Chao1指数呈明显下降趋势,Observed Species数目显著降低(P<0.05),Shannon指数和Simpson指数先增大后减小。结果表明随着三氯蔗糖的剂量增加,菌群丰度下降,物种总数减少。三氯蔗糖的干预使肠道菌群多样性显著降低,优势菌群所占比例有所下降。肠道微生物多样性的变化直接或间接与疾病相关,相关研究表明,结肠炎患者组与健康对照组相比,粪便微生物群的多样性显著降低[19-20]。
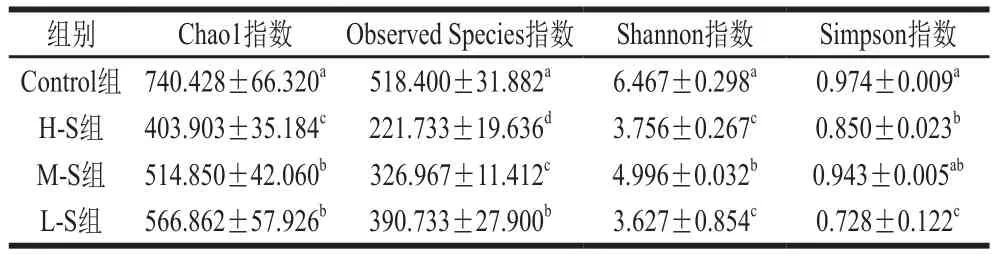
表1 小鼠肠道菌群α多样性Table 1 Alpha diversity of intestinal flora in mice
β多样性主要关注微生物群落构成的不同,评估不同样品间的微生物群落组成差异,以用来比较一对样品在物种多样性方面存在的差异。本实验基于进化的距离(UniFrac),采取非权重(Unweight)方式,根据构建的系统进化树计量在不同剂量的三氯蔗糖环境下样品之间的微生物群落差异。如图2所示,纵坐标为系统进化树树枝的距离,节点的枝长占整个树枝长和的比例,即UniFrac值;每个分支叶节点1、2、3分别代表每组中的3 个样品。由图2可知,Control组与L-S组距离较近,与H-S组、M-S组距离较远,说明Control组与L-S组之间肠道菌群物种组成的相似程度更高。L-S组与H-S组的距离大于L-S组与M-S组之间的距离,说明小鼠摄入高剂量三氯蔗糖对肠道菌群的β多样性影响较大,物种组成与其他组不相似。

图2 测序样品系统进化树Fig.2 Phylogenetic tree of sequenced samples
2.1.2 物种组成分析结果
Venn图可用于统计多组或多个样品中所共有和独有的菌落或物种的数目,反映样品中菌群或物种的数量和组成,及其相似性及重叠情况。由图3可知,各组样品中共有的OTU是116 个,Control组中的OTU数量最多,达到963 个,H-S组OTU数量最少,有425 个。Control组特有475 个OTU;H-S组特有199 个OTU;M-S组特有232 个OTU;L-S组特有242 个OTU;随着三氯蔗糖剂量增加,小鼠特有的OTU数量减少,说明三氯蔗糖的摄入明显改变了小鼠肠道微生物种类,小鼠肠道菌群多样性显著降低,与2.1.1节结果一致。

图3 各组小鼠肠道菌群OUT数量的Venn图Fig.3 Venn diagram showing shared and unique OUTs of intestinal flora in different groups of mice
基于OTU的统计结果,以柱形图的形式展示各组在门水平的物种组成情况,结果如图4所示。空白对照组丰度比例由高到低依次为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、脱铁杆菌门(Deferribacteres)、Patescibacteria、放线菌门(Actinobacteria)、Epsilonbacteraeota、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、软壁菌门(Tenericutes)、蓝藻细菌门(Cyanobacteria)。与空白对照组相比,实验组变形菌门、放线菌门、疣微菌门、Epsilonbacteraeota、酸杆菌门丰度升高,其中H-S组的拟杆菌门丰度显著升高(P<0.05)。在炎症性肠病患者的肠道内发现变形菌门、Epsilonbacteraeota、酸杆菌门的丰度明显升高[21],并且2型糖尿病患者肠道中拟杆菌门、变形菌门丰度也升高[22]。

图4 各组小鼠肠道菌群门水平的物种相对丰度柱状图Fig.4 Relative abundance of intestinal bacterial species at the phylum level in each group
根据OTU的统计结果,对4 组小鼠肠道微生物进行OTU水平的物种进行注释,属水平微生物构成如图5所示。与空白对照组相比,实验组中罗斯氏菌属(Roseburia)、Mucispirillum、瘤胃球菌属(Ruminococcus)、另枝菌属(Alistipes)、粪杆菌属(Faecalibacterium)相对丰度降低,而不动杆菌属(Acinetobacter)、Lachnoclostridium、埃希氏-志贺菌属(Escherichia-Shigella)、乳杆菌属(Lactobacillus)、链球菌属(Streptococcus)、脱硫弧菌属(Desulfovibrio)相对丰度升高。曾有研究检测出2型糖尿病患者粪便中脱硫弧菌属明显增加[23],未发展成AIDS的HIV感染者肠道中罗氏菌属、另枝菌属、瘤胃球菌属的菌群丰度降低[24]。

图5 各组小鼠肠道菌群属水平的物种相对丰度柱状图Fig.5 Relative abundance of intestinal bacterial species at the genus level in each group

如图6所示,与空白组对比,H-S组11 个菌属相对丰度显著增加(P<0.05),34 个菌属相对丰度显著下降(P<0.05),M-S组6 个菌属相对丰度显著增加(P<0.05),31 个菌属相对丰度显著下降(P<0.05),L-S组8 个菌属相对丰度显著增加(P<0.05),25 个菌属相对丰度显著下降(P<0.05)。表明小鼠摄入三氯蔗糖可显著降低肠道微生物物种的相对丰度,使肠道菌群多样性下调,此结论与上述多样性分析结果相符合。

图6 各组小鼠肠道菌群基于属水平的样品组间差异分析Fig.6 Analysis of differences in intestinal bacteria at the genus level between all groups based on the genus level of the intestinal flora of the mice from each group
2.1.3 物种门、属水平特征性差异分析结果
本实验线采用线性判别分析来估算各组物种丰度的差异效果如图7所示,并列出根据线性判别分析结果检测到的各组间具有差异的特征微生物群落或物种的丰度直方图(图8~10)。
图7清晰地展示出各组微生物群落在界、门、纲、目、科、属之间存在明显差异的物种,三氯蔗糖的干预导致物种间丰度差异显著的门分别为拟杆菌门、放线菌门、变形菌门、Patescibacteria(P<0.05)。由图7得到图8~10特征性菌群的相对丰度直方图,三氯蔗糖的摄入导致小鼠肠道中变形菌门、放线菌门相对丰度显著升高(P<0.05),梭菌科、理研菌科相对丰度显著降低(P<0.05),H-S组和M-S组在拟杆菌属的相对丰度显著升高(P<0.05)。

图7 各组小鼠肠道菌群进化分支图Fig.7 Evolutionary branching of intestinal flora in all groups of mice

图8 小鼠肠道菌群组间门水平相对丰度直方图(放线菌门、变形菌门)Fig.8 Histogram relative abundance of intestinal (Actinomycetes and Proteobacteria) in all groups of mice
图9 小鼠肠道菌群组间科水平相对丰度直方图(梭菌科、理研菌科)Fig.9 Histogram of relative abundance of intestinal bacteria in all groups of mice (Clostridium and Ritiaceae)

图10 小鼠肠道菌群组间属水平相对丰度直方图(拟杆菌属)Fig.10 Histogram relative abundance of intestinal bacteria in all groups of mice (Bacteroides)
2.2 三氯蔗糖对小鼠免疫器官指数的影响
脾腺指数和胸腺指数在一定程度上可以反映机体免疫情况[25]。由表2可知,灌胃6 周后,与Control组相比,M-S组、L-S组脾脏指数相近,差异不显著(P>0.05);与Control组相比H-S组脾脏指数显著降低(P<0.05)。与Control组相比,H-S组、L-S组胸腺指数差异不明显,M-S组胸腺指数显著降低(P<0.05)。胸腺是重要的中枢免疫器官,脾脏作为外周免疫器官,当脾腺、胸腺指数下降时,表明三氯蔗糖的摄入导致小鼠免疫力降低[26],抵抗外来微生物感染和入侵的能力减退。

表2 三氯蔗糖对小鼠免疫器官指数的影响(n=6)Table 2 Effect of sucralose on immune organ indexes in mice (n = 6)
2.3 三氯蔗糖对小鼠血清炎症因子IL-1β、TNF-α的影响
IL-1β与TNF-α是激活性巨噬细胞分泌的促炎症细胞因子,可通过诱导其他促炎因子的级联反应介导炎症[27]。
灌胃6 周三氯蔗糖后,IL-1β、TNF-α水平变化如表3所示。与Control组相比,H-S组IL-1β水平显著升高(P<0.05),M-S组与L-S组TNF-α水平也显著升高(P<0.05)。相关研究表明,高脂饮食能够诱导低度系统性炎症和代谢性疾病,并在人类身上得到证实,表现为Toll样受体4、核因子-κB表达量升高以及TNF-α、IL-1β的产生量增加[28-29]。因此,三氯蔗糖的摄入会导致体内促炎因子分泌增多,炎症水平上升,肠道微生物中炎症介质破坏上皮黏膜的完整性,阴止肠外细胞之间的连接,抑制抗微生物肽的分泌[30]。

表3 三氯蔗糖对小鼠血清炎症因子IL-1β、TNF-α含量的影响(n =6)Table 3 Effect of sucralose on serum inflammatory factors IL-1β and TNF-α in mice (n = 6)
2.4 三氯蔗糖对小鼠肠黏膜分泌型免疫球蛋白的影响
位于黏膜相关淋巴组织的SIgA是防御肠道病原微生物的第一道防线,是肠黏膜免疫重要组成部分。当肠道黏膜屏障受到攻击时,肠道黏膜中的SIgA含量急剧下降。
由图11可知,灌胃小鼠6 周后,与Control组相比,H-S组、M-S组和L-S组SIgA质量浓度显著降低(P<0.05),3 组小鼠的肠道黏膜均受到不同程度影响。与L-S组相比,M-S组SIgA质量浓度显著减少(P<0.05)。SIgA的保护作用包括中和肠腔中的细菌毒素、中和转胞吞过程中的轮状病毒以及抑制脂多糖向肠上皮移位以及炎症的发生[31-32]。实验组SIgA质量浓度减少,表明摄入三氯蔗糖可引起肠道细菌毒素和病原体的大量产生,并且SIgA不能及时供给,从而影响微生物群落。
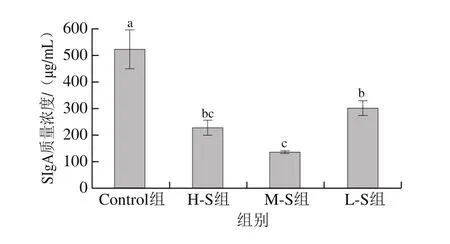
图11 三氯蔗糖对小鼠肠黏膜SIgA的影响(n=6)Fig.11 Effect of sucralose on intestinal mucosal SIgA in mice (n = 6)
2.5 三氯蔗糖对小鼠肠道组织形态的影响
用HE染色法对小鼠小肠组织进行研究,评估一般组织学特征。HE染色结果可以鉴定组织细胞坏死、水肿、变性和炎性细胞浸润等异常病理学改变。小鼠肠道组织形态HE染色结果如图12所示,灌胃6 周时,Control组和L-S组小肠组织结构完整,绒毛上皮、黏膜下层腺体均完整并可见杯状细胞;组织未见水肿、坏死、炎性细胞浸润等病理变化。H-S组的组织黏膜下层局部可见纤维结缔组织大量增生,间隙增大,伴有炎性细胞弥散性浸润(黑色箭头所示);黏膜下层、增生的血管可见管腔扩张(黄色箭头所示)。M-S组的组织内可见部分肠绒毛坏死脱落(蓝色箭头所示);黏膜层下部小肠腺体层可见部分腺体坏死,纤维组织增生(绿色箭头所示)。

图12 三氯蔗糖对小鼠小肠组织形态的影响Fig.12 Effect of sucralose on small intestinal morphology in mice
研究中一般通过图像测量小肠绒毛长度、隐窝深度来评价肠道发育[33-34]。小鼠肠道绒毛越短表征消化吸收面积越小,且肠绒毛长度与肠道上皮细胞数量呈正相关。肠隐窝程度加深,表明细胞成熟率下降,分泌功能减弱。由图13可知,灌胃6 周后,与Control组相比,H-S组小肠绒毛长度显著变短(P<0.05);与Control组相比,H-S组、M-S组小肠隐窝深度显著增加(P<0.05),L-S组小肠隐窝深度与Control组差异不显著(P>0.05)。结果表明,三氯蔗糖摄入对肠道机械屏障具有损伤作用,能够改变肠道绒毛形态,降低肠道隐窝中上皮细胞的增殖力,削弱对营养物质的吸收力。

图13 三氯蔗糖对小鼠小肠绒毛长度和小肠隐窝深度的影响Fig.13 Effect of sucralose on villi length and crypt depth of small intestine in mice
3 讨 论
目前研究发现,肠道菌群的失调与消化系统疾病、代谢性疾病有一定的联系[35-38]。研究人员发现,肥胖志愿者肠道内放线菌门比例升高,其75%的肠道微生物基因来源于放线菌[39],并且肥胖患者肠道内的理研菌科、梭菌科相对丰度降低,这种降低与肠道菌群的ClpB样基因表达呈正相关,而肠道菌群的ClpB样基因表达与身体质量指数、腰围、总脂肪量呈负相关[40]。高脂饮食在增加了肠道通透性的同时,也显著增加变形菌门和疣微菌门丰度[41]。也有研究表示,IBS患者肠道内变形菌门丰度显著升高[42]。本研究结果表明,三氯蔗糖的摄入使肠道中变形菌门、放线菌门的丰度显著升高,高剂量的三氯蔗糖使拟杆菌门显著升高;理研菌科、梭菌科、拟杆菌属的相对丰度显著降低。这意味着摄入三氯蔗糖可导致肠道菌群结构改变,肠道微生物丰富度与均匀度下降;其中,肥胖、糖尿病、肠道炎症等代谢综合征的特征菌群均有所增加或降低。
肠道微生态包括肠道微生物及其生存环境,受宿主基因、生活环境和饮食习惯等多方面因素影响。对肠道来说,这种环境是由宿主的基因和包括饮食在内的外部环境因素共同决定的[43]。当肠道微生态受到影响,会破坏肠道正常的生命活动,并且黏膜免疫系统异常激活会诱发肠道炎症,导致组织损伤和上皮屏障功能失调,损害全身免疫稳态。其次,经过三氯蔗糖干预的肠道微生物组中耐药基因增加,耐药基因增加相应耐药细菌也将繁殖,最终可能导致更恶劣的肠道环境[44]。Abou-Donia等[9]的研究表明,大鼠经12 周灌胃不同剂量含三氯蔗糖的代糖物质(最高剂量为1 000 mg/(kgmb·d))后导致肠道中有益细菌数量明显减少,此外,在12 周的恢复期内,这种有益菌数量减少的现象一直持续。本研究发现,三氯蔗糖摄入后,肠道微生物丰度降低和结构改变可导致小鼠免疫力下降,促炎因子IL-1β、TNF-α水平升高,肠通透性增加,肠道免疫屏障受损且SIgA水平降低,无法有效抵制肠道细菌毒素和病原体,致使肠道稳态失衡。
与此同时,甜味刺激会通过改变肠道微生物群的组成,导致肠道病原体定植,从而影响能量获取,并破坏微生物组向宿主和控制血糖的信号传导[45],进而增加糖尿病发病风险。有研究表明,在小鼠模型中反复暴露人工甜味剂会通过改变肠道微生物组成而导致小鼠葡萄糖不耐受[46]。这也为后续研究三氯蔗糖是否导致糖尿病提供思路。
综上所述,三氯蔗糖的大量摄入会存在一定的危害,改变肠道环境和肠道菌群的丰度和结构,使肠道内有害菌和有益菌的比例失衡,同时证明三氯蔗糖大量干预将会引发肠道组织发生病变、免疫屏障受损、炎症水平升高,也可能引发机体血糖控制异常。综上,本研究为三氯蔗糖对人体健康不良作用机制提供研究思路,同时为人工甜味剂的实际应用提供指导及理论支持。
