胃癌根治术后肺转移的危险因素分析
2021-09-27吕为良
吕为良
永城市人民医院普外科二病区 (河南 商丘 476600)
我国年新发胃癌病例约48万,占癌症总量的10.8%,位列前三[1]。胃癌根治术是目前早期胃癌治愈的唯一手段,使胃癌患者病死率明显下降[2]。但文献报道显示,胃癌根治术术后发生肺转移概率为1.3%~3.8%,约占所有转移病例的40%[3-4]。胃癌术后肺癌转移患者预后差,3年生存率不足4%[5],而肺转移的临床特征不显著,且尚缺乏肺转移诊断的特异性指标,易延误治疗时间。但目前胃癌根治术患者术后发生肺转移危险因素的研究报道较少。为此,本研究分析胃癌根治术后发生肺转移的危险因素,以期为术后肺转移的防治提供参考。
1 资料与方法
1.1 一般资料回顾性分析2016年1月至2020年4月在我院收治的胃癌根治术后发生肺转移患者46例的病例资料,设为转移组。纳入标准:术前经胃镜活检病理、术后病理检查证实为胃癌;术前TNM分期Ⅰ~Ⅲ;经CT、PET-CT等检查排除肺转移。排除标准:合并其他恶性肿瘤;胃癌复发者;术前接受放化疗;病历资料不完整。另选取同期于我院接受胃癌根治术未发生肺转移125例患者,设为未转移组,该组纳排标准同转移组,术后随访时间为3~5年,中位随访时间42个月。其中转移组男27例,女19例,年龄35~89岁,平均年龄(67.50±5.27)岁,平均手术时间(204.34±19.89)min,平均术中出血量(185.20±16.94)mL;未转移组男73例,女52例,年龄32~86岁,平均年龄(67.27±5.80)岁,平均手术时间(202.46±18.65)min,平均术中出血量(192.43±15.27)mL。两组患者性别、年龄、手术时间及术中出血量等资料的差异无统计学意义(P>0.05),具可比性。
1.2 研究方法所有患者均按《腹腔镜胃癌手术指南》[6]进行手术,参照《胃癌治疗指南》[7]行淋巴结清扫;收集两组患者临床资料,包括年龄、发病部位、肿瘤直径、术前TNM分期、病理学类型、浸润深度(T分期)、N分期、术前肿瘤标志物水平、淋巴结清扫程度、术后辅助化疗及其周期、辅助放疗。
1.3 统计学方法采用SPSS 22.0进行分析,计量数据用(±s)描述,组间比较为独立样本t检验。计数资料采用[n(%)]表示,采用χ2检验,等级资料采用非参数检验(秩和检验)。危险因素分析采用Logistic回归分析,以P<0.05为差异具有统计学意义。
2 结 果
2.1 转移组患者临床特征转移组46例患者中,15例(32.61%)患者临床表现咳嗽、胸闷或胸痛等,其余均无明显症状。经血清肿瘤标志物水平异常或胸部X线片检查发现:肺转移部位:双肺转移22例(47.83%)、左肺14例(30.43%)、右肺10例(21.74%)。肺转移时间:在术后第1年内发生24例(52.17%)、术后第2年发生8例(17.39%),术后第3~5年发生14例(30.43%)。
2.2 胃癌根治术后肺转移危险因素分析转移组与未转移组进行单因素组间比较结果显示,胃癌根治术后肺转移与患者年龄、发病部位、肿瘤直径、TNM分期、浸润深度、N分期均有关(P<0.05),而与性别、病理学类型、术前血清肿瘤标志物、淋巴结清扫程度、术后辅助化疗及周期、辅助放疗无关(P>0.05),见表1。
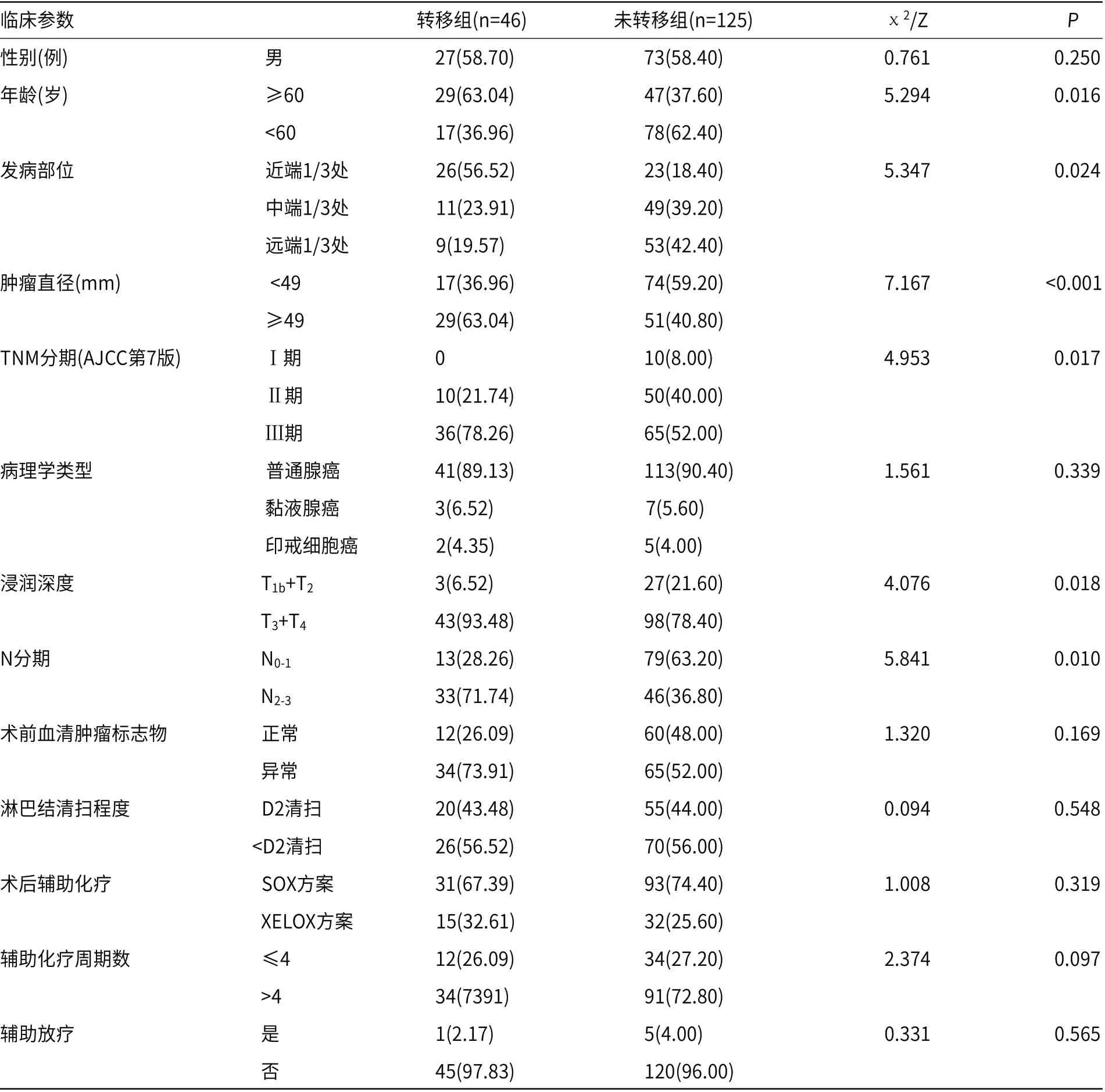
表1 胃癌根治术后肺转移单因素分析结果[n(%)]
2.3 胃癌根治术后肺转移危险因素的Logistic回归分析以胃癌根治术后肺转移为因变量(否=0,是=1),以上述单因素分析中有统计学差异的临床参数为多因素分析自变量,各自变量赋值见表2,进行Logistic回归分析结果显示发病部位、浸润深度、N分期为影响胃癌根治术后肺转移的高风险因素(P<0.05),见表3。

表2 多因素Logistic分析各自变量赋值情况
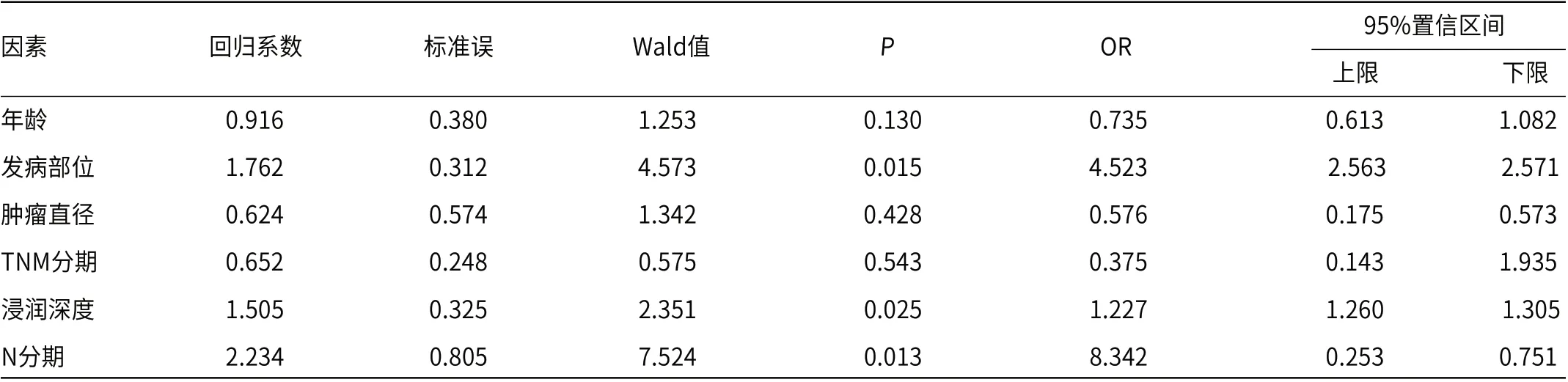
表3 胃癌根治术后肺转移危险因素的Logistic回归分析
3 讨 论
我国为胃癌高发国家,胃癌根治术作为早期胃癌治疗的主要手段,能改善患者预后,但术后复发转移是影响患者预后的主要因素[8]。研究发现,胃癌转移方式主要有直接浸润邻近部位、血行转移及淋巴转移等方式,由于肺部为血液系统和淋巴系统的聚集处,胃癌细胞易侵入血管或淋巴管系统而转移至肺部,使肺部成为胃癌的主要转移器官[9-10]。但肺转移癌早期症状不典型,且缺乏有效的治疗手段,胃癌肺转移患者的中位生存时间仅7个月[11]。因此,明确影响胃癌根治术后肺转移影响因素对预后评估具有重要意义。
本研究中转移组在术后第1、2、3~5年内肺转移发生率依次为52.17%、17.39%、30.43%,且67.39%患者发生肺转移时无明显症状,与文献报道结果一致[12]。提示胃癌根治术后1~2年内应加强肺转移早期监控,严格随访和定期复查,结合胸部X线片和血清肿瘤标志物及时进行筛查。本研究分析发现,60岁以上胃癌患者较低于60岁患者术后肺转移发生风险显著增高,而Logistic回归分析发现年龄并非影响胃癌根治术后肺转移的独立风险因素,与相关文献报道结果一致[13]。但刘丹等[14]认为年龄为胃癌根治术后肺转移的唯一独立预测因子。胃癌发病人群趋于老年化,老年人群机体免疫功能降低,肺功能下降,加之长期的癌症高能量消耗,易使患者术后机体恢复慢,导致术后肺转移病例增多;同时,年龄为非小细胞肺癌发病的高风险因素,而转移性肺癌和原发肺癌鉴别困难,也可能是造成转移组患者年龄趋于高龄化的原因之一。本研究结果显示,发病部位、浸润深度、N分期为影响胃癌根治术后肺转移的高风险因素,与研究报道结果一致[15]。胃体不同部位发病率存在较大差异,其中贲门癌发病率高,而随着年龄增大,胃底黏膜腺体逐渐萎缩,食管胃交界向上移行,导致进食后胃排空时间延长,残留胃癌细胞易侵入食管下段黏膜下静脉丛,再经体循环、肺循环定植于肺部。同时,本研究发现胃癌间质浸润深度T3+T4是术后发生肺癌转移的高风险因素,与文献报道相符[16]。研究认为,随着肿瘤间质浸润深度增加,胃癌根治术中病灶组织清除难度越大,且浸润越深,胃癌组织中缺氧诱导因子1α等基因表达增强,更有利于胃癌细胞侵袭和转移[17]。同时,肿瘤组织浸润过程中易侵犯神经鞘或神经束,而神经鞘、血管及淋巴管相互连接形成通路,胃癌细胞易渗入该通路扩散至肺部[18]。这个也提示对于间质浸润深度胃癌患者应更加严密地制定手术方案,并可通过多靶点阻断转移途径,降低肺转移风险。本研究也发现,N2-3期胃癌患者肺癌转移率明显高于N0-1期患者,但两组术中淋巴清扫程度无明显差异,表明扩大淋巴结清扫范围未能使术后肺转移风险降低。淋巴侵袭是胃癌转移的重要途径,胃癌侵入淋巴系统后可通过诱发全身性炎症反应,释放可溶性因子刺激术后残留胃癌细胞生长[19];同时还能引起宿主免疫抑制,而促进残留的胃癌细胞的增殖,增加其迁移和侵袭能力[20]。
综上所述,近端1/3处胃癌、浸润深度T3+T4期及N2-3期为影响胃癌根治术后发生肺转移的独立危险因素,此类患者值得临床重点关注。但本研究因纳入病例较少、病例跨度较大,可能导致分析结果出现偏倚,有待今后多中心、大样本量研究进一步探索。
