哈茨木霉NBL-Z1定殖动态及对草莓根腐病防治效果
2021-09-26齐素敏冉新炎韩广泉陶宁陈丹丹李圆圆王丽荣
齐素敏 冉新炎 韩广泉 陶宁 陈丹丹 李圆圆 王丽荣


摘要:本研究测定哈茨木霉NBL-Z1菌株无菌发酵滤液对5种病原菌的拮抗活性,并检测该菌的定殖能力及对草莓根腐病的防治效果,以期筛选出对病原真菌具有良好拮抗效果、安全、高效的生防菌。结果表明,哈茨木霉NBL-Z1菌株无菌发酵滤液对5种供试病原真菌有较强的拮抗作用,处理96、144 h,NBL-Z1菌株对尖孢镰刀菌菌丝生长的抑菌率均为100.00%;接种后28 d,菌株NBL-Z在草莓根表定殖数量达到最大,为8.10×107 CFU/g;NBL-Z1菌株对盆栽草莓根腐病的防效为65.6%,同时可促进盆栽草莓植株生长,提高果实产量。研究表明,NBL-Z1菌株能有效防治草莓根腐病并促进草莓植株生长,具有較高的潜在应用价值。
关键词:哈茨木霉;拮抗活性;尖孢镰刀菌;定殖能力;草莓根腐病
中图分类号:S436.68+4 文献标志码: A
文章编号:1002-1302(2021)17-0124-04
收稿日期:2020-12-15
基金项目:山东省2018年重点研发计划(编号:2018JHZ012);泰山产业领军人才(编号:鲁政办字〔2018〕246号);2017年“外专双百计划”(编号:鲁政办字〔2017〕144号);2020年度山东省重点扶持区域引进急需紧缺人才项目(编号:泰发改区域〔2020〕352号)。
作者简介:齐素敏(1989—),女,山东沂源人,硕士,助理研究员,主要从事植物微生态制剂的研发工作。E-mail:qsm20095089@126.com。
木霉菌(Trichoderma spp.)属半知菌亚门木霉属,该类菌适应力强,分布广泛,是一类重要的生防真菌[1],常见的木霉有绿色木霉(Trichoderma viride)、哈茨木霉(Trichoderma harzianum)、棘孢木霉(Trichoderma asperellum)、长枝木霉(Trichoderma longibrachiatum)等。据报道,木霉菌已成功用于防治番茄灰霉病[2]、番茄枯萎病[3]、黄瓜枯萎病[4]、花生根腐病[5]等植物病害,该类菌对植物病害起到防控作用的机制主要归结于竞争[6]、诱导抗性[7-8]、重寄生[9]、抗生等。
哈茨木霉(T. harzianum)是一种常见的木霉菌,该菌对多种病原菌具有较强的抑制效果。Zhang等研究发现,哈茨木霉对尖孢镰刀菌菌丝生长抑制率可达70.99%[10]。据报道,哈茨木霉对尖孢镰刀菌、核盘菌、链格孢菌等植物病原菌具有明显的拮抗作用[11]。Swehla等研究了哈茨木霉对芝麻茎点枯病菌的抑制效果,结果表明菌丝体生长抑制率为76.96%[12]。有关哈茨木霉对尖孢镰刀菌的抑制作用,及哈茨木霉在草莓根系定殖能力及对草莓根腐病的防治效果的研究较少。本研究以哈茨木霉NBL-Z1菌株为试验材料,通过室内拮抗试验发现该菌对5种供试病原真菌均具有抑制效果,后研究NBL-Z1菌株在草莓根际的定殖能力,以及其对草莓根腐病的防治效果和促生作用,以期为防治草莓根腐病等土传病害的生防菌剂的开发应用提供科学依据。
1 材料与方法
1.1 试验材料
哈茨木霉NBL-Z1菌株于土壤中分离纯化获得。该菌株目前保藏于中国普通微生物菌种保藏管理中心,编号为CGMCC19602。
PDB培养基:马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL。
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL。
1.2 菌株NBL-Z1无菌发酵滤液抑菌活性测定
将NBL-Z1菌株接种到PDB培养基中,于28 ℃、180 r/min 恒温摇床中培养120 h后,10 000 r/min离心,用0.22 μm微孔滤膜过滤得无菌发酵滤液,按体积1 ∶9的比例将其与冷却至50 ℃左右的灭菌PDA培养基混匀,倒入灭过菌的平皿中,待平皿冷凝后将直径为9 mm的病原真菌菌饼置于平板中央,以普通PDA培养基平板为对照,于28 ℃光照培养箱中培养,用十字交叉法分别于96、144 h测量菌落直径,并计算相对抑菌率。相对抑菌率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%。
1.3 菌株NBL-Z1在草莓根系定殖量的检测
本试验于2019年12月在山东省泰安市宁阳县乡饮乡(116.80°E,35.77°N)巴夫生态大棚进行。
将 NBL-Z1菌株于PDB 培养液中培养120 h后,用4 层灭菌滤纸过滤,加无菌水制成分生孢子悬浮液,用血球计数板计数调整浓度为1.0×107 CFU/mL。每株草莓灌根接种 10 mL 该菌孢子悬浮液。分别于接种NBL-Z1 菌株后1、7、14、21、28、35 d取样进行定殖量的检测。切取草莓根组织,转移至离心管中。向离心管中加入 1 mL 1×PBS 和玻璃珠若干,依次超声振荡 1 min,漩涡振荡 1 min,冰浴 1 min,重复 3 次。将获得的菌悬液梯度稀释10~106倍,吸取 200 μL 菌悬液涂布于PDA培养基平板,于28 ℃培养120 h,记录平板上的菌落数,计算菌株NBL-Z1 在草莓根系的定殖量。
1.4 菌株NBL-Z1的防病作用
试验设3个处理:对照(CK)、单接病原菌(P)、同时接种病原菌和NBL-Z1菌株(P+NBL-Z1)。每个处理重复20棵番茄。分别刮取PDA培养基平板上 28 ℃、培养120 h的尖孢镰刀菌孢子和NBL-Z1菌株,分散到0.1%吐温-80溶液中制成孢子悬液,调整病原菌和生防菌的浓度至1.0×107 CFU/mL。采取伤根灌注法[13]同时接种病原菌和生防菌,各菌株接种量均为每棵10 mL。接种50 d后挖取植株,统计发病程度,计算病情指数、防效,测定植株鲜质量、单株产量及叶绿素含量(SPAD值)。
根腐病发病程度分为6级:0级为根系未发病;1级为根系发病率≤30%,叶片正常;2级为30%<根系发病率≤60%,叶片正常;3级为60%<根系发病率≤80%,叶片变黄;4级为根系发病率>80%,叶片枯萎;5级为整株死亡,叶片干枯[14]。
病情指数=[∑(各病级株数×各病级代表值)/(总株数×最高病级代表值)]× 100;
防效=(对照病情指数-处理病情指数)/对照病情指数× 100%。
1.5 数据统计与分析
采用Excel 2010和SPSS 19.0软件进行Duncans显著性分析和Probit法回归分析。
2 结果与分析
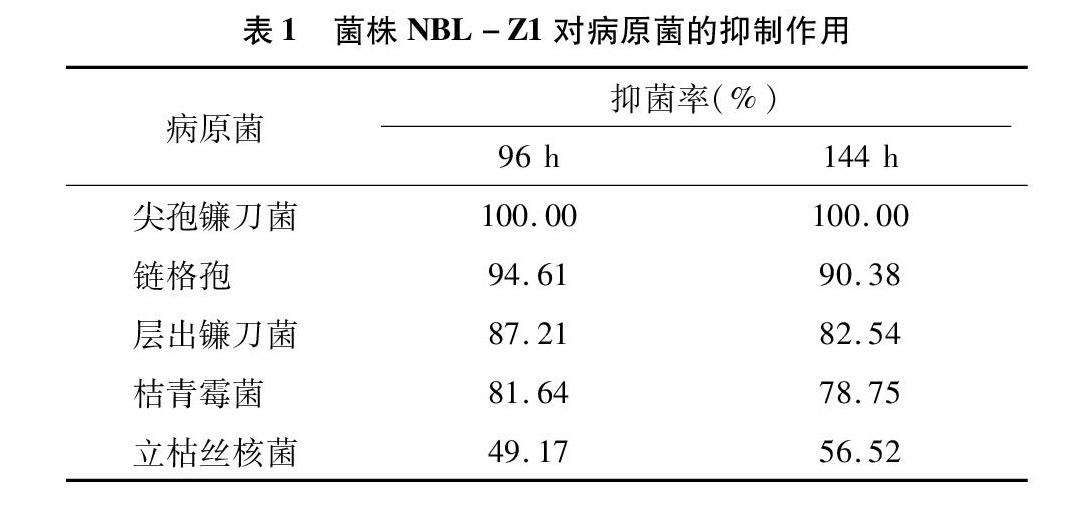
2.1 菌株NBL-Z1对病原菌的抑制作用
从表1可以看出,NBL-Z1菌株无菌发酵液对5种病原真菌菌丝生长均具有较强的抑制作用。NBL-Z1菌株对尖孢镰刀菌菌丝生长抑制效果最好,处理96、144 h,抑菌率均为100.00%(图1)。处理96 h后,NBL-Z1菌株对链格孢的菌丝生长抑菌率达94.61%(图2),但对立枯丝核菌的抑菌率仅为49.17% 。培养144 h,NBL-Z1菌株对链格孢的菌丝生长抑菌率为90.38%,对其他病原真菌的菌丝生长抑菌率为56.52%~82.54%。总体来看,NBL-Z1 菌株对5种病原真菌96 h的拮抗效果优于144 h。
2.2 菌株NBL-Z1在草莓根域的定殖
植物根际促生菌在植物根际定殖能力是影响其生防效果的重要原因之一,是发挥其有益功能的前提。为了检测NBL-Z1菌株在草莓根表的定殖,在NBL-Z1菌株接种后的1、7、14、21、28、35 d采集根系样品,分离并培养定殖于根表的NBL-Z1菌株,统计其定殖量。由图3可知,接种后1 d,NBL-Z1菌株在草莓根表的定殖量为0.68×107 CFU/mL,随着草莓的生长,该菌株在草莓根表的定殖量逐渐增加,接种后28 d,NBL-Z1菌株的定殖量达到最大,为 8.10×107 CFU/mL。接种后35 d,NBL-Z1菌株的定殖量略微下降,为6.47×107 CFU/mL。试验结果表明,哈茨木霉菌能够在草莓根际土壤中定殖和生长繁殖,定殖量呈现先增加后降低的动态变化过程。
2.3 NBL-Z1菌株对草莓防病促生的作用
由表2可知,接种NBL-Z1菌株可促进接种根腐病原菌尖孢镰刀菌的草莓生长,提高其产量,降低根腐病发生率。与单接病原菌处理P相比,混合接种NBL-Z1菌株处理的草莓植株鲜质量、单株产量分别增加28.17%、25.92%。接种NBL-Z1菌株
处理组草莓叶绿素含量显著增加,较单接病原菌组增加27.89%。
以上结果表明,混合接种NBL-Z1菌株不仅能促进草莓生长发育,提高其光合指标,还能有效降低草莓根腐病的发病率,防效为65.6%。
3 讨论与结论
草莓根腐病是草莓生产中的一种主要病害,该病由多种土传病原真菌复合侵染所致[15-16],其中尖孢镰刀菌是重要的病原菌之一[17]。近年来,利用微生物防治植物病虫害具有安全、环保、高效等优势已经成为了研究热点。陈哲等研究发现,解淀粉芽孢杆菌CM3菌株对尖孢镰刀菌引起的草莓根腐病的防治效果达到了 64.86%[17]。王占武等的田间试验结果表明,枯草芽孢杆菌B501菌株对草莓根腐病的防效高达94%[18];Kurze等研究发现,沙雷氏菌HRO-C48菌株可有效降低草莓根腐病的发生[19]。孙敬祖等研究报道,放线菌Act12菌剂对草莓根腐病的相对防效为84.7%[20]。除生防细菌和放线菌外,一些真菌如哈茨木霉[14,21]、钩木霉[22]等木霉菌对草莓根腐病也具有良好效果。本研究发现,哈茨木霉NBL-Z1菌株对尖孢镰刀菌96 h的抑菌率可达100. 00%;NBL-Z1菌株能够在草莓根际土壤中稳定定殖,接种后28 d,在草莓根表定殖数量为8.10×107 CFU/g;在田间条件下,NBL-Z1菌株对草莓根腐病具有良好的防治效果,防效为65.6%。
大量研究表明,木霉菌能促进植株生长,改善植物营养状况[23-24]。郭成瑾等研究发现,哈茨木霉处理的马铃薯株高、茎粗和分枝数均明显高于对照[25]。Es-Soufi等研究发现,哈茨木霉可以促进植物发育并延长其开花和结果的持续时间[26]。李松鹏等研究報道,哈茨木霉发酵液有利于促进种子发芽与生长的作用[27]。本试验中,用哈茨木霉 NBL-Z1 无菌上清液浇灌草莓植株,发现处理组的草莓植株鲜质量、单株产量和叶绿素含量分别增加28.17%、25.92%、27.89%。说明哈茨木霉 NBL-Z1菌株能够有效促进草莓植株的生长。
本研究结果表明,哈茨木霉NBL-Z1无菌发酵滤液对5种供试病原真菌有较强的拮抗作用,处理后96、144 h,NBL-Z1菌株对尖孢镰刀菌菌丝生长抑菌率均为100. 00%;接种后28 d,NBL-Z菌株在草莓根表定殖数量最大,为8.10×107 CFU/g;菌株NBL-Z1对草莓根腐病的防效为65.6%,同时可促进盆栽草莓植株生长,提高果实产量。在接下来的研究中,我们将检测NBL-Z1菌株对根系土壤中其他微生物的影响,并补充相应的田间使用规范等。
哈茨木霉NBL-Z1菌株能有效防治草莓根腐病并促进草莓植株生长,具有较高的潜在应用价值。
参考文献:
[1]Srivastava R K,Singh R K,Prasad R D. Relative antogonistic effect of different isolates of Trichoderma viridi and Trichoderma harzanium against Rhizoctonia solani[J]. National Academy Science Letters,2012,35(1):49-52.
[2]刘波微,彭化贤,陈素清. 番茄灰霉病拮抗木霉菌的筛选及效果评价[J]. 西南农业学报,2007,20(4):650-653.
[3]康萍芝,张丽荣,沈瑞清,等. 哈茨木霉制剂对设施连作番茄根际土壤微生物的生态效应及防病作用[J]. 农药,2013,52(2):128-131.
[4]庄敬华,高增贵,杨长城,等. 绿色木霉菌T23对黄瓜枯萎病防治效果及其几种防御酶活性的影响[J]. 植物病理学报,2005,35(2):179-183.
[5]陳建爱,陈为京,刘凤吉. 黄绿木霉T1010对花生根腐病生防效果研究[J]. 生态环境学报,2018,27(8):1446-1452.
[6]梁巧兰,王 芳,魏列新,等. 深绿木霉T2菌株对百合疫霉病菌拮抗作用及机制[J]. 植物保护,2011,37(6):164-167.
[7]Bae H,Roberts D P,Lim H S,et al. Endophytic Trichoderma isolates from tropical environments delay disease onset and induce resistance against Phytophthora capsici in hot pepper using multiple mechanisms[J]. Molecular Plant-Microbe Interactions,2011,24(3):336-351.
[8]Brunner K,Zeilinger S,Ciliento R,et al. Improvement of the fungal biocontrol agent Trichoderma atroviride to enhance both antagonism and induction of plant systemic disease resistance[J]. Applied and Environmental Microbiology,2005,71(7):3959-3965.
[9]Kubicek C P,Herrera-Estrella A,Seidl-Seiboth V,et al. Comparative genome sequence analysis underscores mycoparasitism as the ancestral life style of Trichoderma[J]. Genome Biology,2011,12(4):R40.
[10]Zhang S X,Sun F F,Liu L J,et al. Dragonfly-associated Trichoderma harzianum QTYC77 is not only a potential biological control agent of Fusarium oxysporum f. sp. cucumerinum but also a source of new antibacterial agents[J]. Journal of Agricultural and Food Chemistry,2020,68(48):14161-14167.
[11]Wang Y F,Hou X Y,Jiang C Y,et al. A native Trichoderma harzianum strain Th62 displays antagonistic activities against phytopathogenic fungi and promotes the growth of Celosia cristata[J]. Horticulture,Environment,and Biotechnology,2021,62(2):169-179.
[12]Swehla A,Pandey A K,Nair R M. Bioactivity of Trichoderma harzianum isolates against the fungal root rot pathogens with special reference to Macrophomina phaseolina causing dry root rot of mungbean[J]. Indian Phytopathology,2020,73(4):787-792.
[13]孙广宇,宗兆锋. 植物病理学实验技术[M]. 北京:中国农业出版社,2002.
[14]Vestberg M,Kukkonen S,Saan K,et al. Microbial inoculation for improving the growth ecology,and health of micropropagated strawberry[J]. Applied Soil,2004,27(3):243-258.
[15]张悦丽,张 博,任凤山,等. 草莓腐霉根腐病病原菌鉴定[J]. 植物保护学报,2015,42(3):477-478.
[16]Fang X L,Finnegan P M,Barbetti M J. Wide variation in virulence and genetic diversity of binucleate Rhizoctonia isolates associated with root rot of strawberry in Western Australia[J]. PLoS One,2013,8(2):e55877.
[17]陈 哲,黄 静,赵 佳,等. 草莓根腐病的病原菌分离鉴定及拮抗菌CM3的抑制作用研究[J]. 生物技术通报,2018,34(2):135-141.
[18]王占武,李晓芝,刘彦利,等. 枯草芽孢杆菌B501在草莓根际的定殖及其动态变化[J]. 植物病理学报,2003,33(2):188-189.
[19]Kurze S,Bahl H,Dahl R,et al. Biological control of fungal strawberry diseases by Serratia plymuthica HRO-C48[J]. Plant Disease,2001,85(5):529-534.
[20]孫敬祖,薛泉宏,唐 明,等. 放线菌制剂对连作草莓根区微生物区系的影响及其防病促生作用[J]. 西北农林科技大学学报(自然科学版),2009,37(12):153-158.
[21]Lamondia J A,Cowles R S. Effect of entomopathogenic nematodes and Trichoderma harzianum on the strawberry black root rot pathogens Pratylenchus penetrans and Rhizoctonia fragariae[J]. Journal of Nematology,2002,34(4):351-357.
[22]Olatimvo R O,Sabaratnam S,Schilder A C. Trichoderma stromaticum:a potential biological control agent for black root rot in strawberries[J]. Phytopathology,2004,94(6):S78-S78.
[23]Harman G E,Howell C R,Viterbo A,et al. Trichoderma species-opportunistic,avirulent plant symbionts[J]. Nature Reviews Microbiology,2004,2(1):43-56.
[24]叶旻硕,俞键烽,马 艳,等. 不同微生物菌剂对辣椒疫病的防控效果及对土壤性状的影响[J]. 江苏农业学报,2019,35(4):811-817.
[25]郭成瑾,沈瑞清,张丽荣,等. 哈茨木霉协同秸秆对马铃薯黑痣病及根际土壤微生态的影响[J]. 核农学报,2020,34(7):1447-1455.
[26]Es-Soufi R,Tahiri H,Oualkadis A E,et al. Evaluation of plant growth promoting ability of Bacillus amyloliquefaciens Bc2 and Trichoderma harzianum TR in vivo[J]. Agricultural Sciences,2020,11(3):247-259.
[27]李松鹏,崔琳琳,程家森,等. 两株哈茨木霉菌株防治水稻纹枯病及促进水稻生长的潜力研究[J]. 植物病理学报,2018,48(1):98-107.
