调节性B细胞在脑梗死患者外周血中的表达及其与预后的关系①
2021-09-26何谦益石晓娟连晶瑶刘莎莎
何谦益 石晓娟 连晶瑶 刘莎莎 张 毅
(郑州大学第一附属医院生物细胞治疗中心,郑州450052)
卒中是继心脏病和癌症之后的第三大疾病死亡原因,并且具有最高的致残率,约有80%的卒中患者遗留有终身残疾[1-2]。在世界范围内,卒中造成了患者死亡率及伤残调整寿命年仍居高不下[3]。因此,找到有效治疗卒中的新方法刻不容缓。卒中可以分为缺血性和出血性两种,其中85%为缺血性的,又称之为脑梗死。目前,脑梗死的概念已经由单纯的血管疾病扩展到了由神经胶质细胞、神经元、血管细胞以及基质成分、免疫细胞等多种成分之间相互作用的复杂疾病。其中免疫系统引起的继发性神经炎症既可以加剧缺血性神经损伤,导致大量神经元死亡,也可以发挥促进神经修复的积极作用,近年来逐渐成为脑梗死研究领域的热点[4]。
调节性 B 细胞(regulatory B cells,Breg)是维持免疫耐受的免疫抑制性细胞,Breg 细胞可以通过分泌 IL-10、IL-35 和 TGF-β 来抑制包括 T 细胞在内的促进炎症性细胞的扩增进而抑制免疫反应[5]。既往研究表明,Breg 在缺血性卒中动物实验模型中能发挥强大的免疫抑制功能并且有潜在的神经保护功能[6]。即使在脑梗死发生 24 h 后给予 Breg 细胞,也能大大降低实验小鼠的脑梗死体积,其治疗时间窗远远超过了目前脑梗死治疗领域最有效的组织型纤溶酶原激活剂[7]。但是目前仍缺乏Breg细胞在急性脑梗死患者中的相关研究。本研究旨在检测急性脑梗死患者外周血中Breg 细胞的表达,并且分析Breg 与患者预后的关系,为后续Breg 的临床转化研究提供一定的数据支持。
1 资料与方法
1.1 资料 纳入2018年10月至2019年10月郑州大学第一附属医院就诊的症状发作7 d 内的首发脑梗死患者128 例(急性脑梗死组)以及同时期性别、年龄相匹配的体检者100例(健康对照组)。所有纳入研究的对象均自愿参加本研究并签署了知情同意书。所有脑梗死患者均符合《中国急性缺血性脑卒中诊治指南2018》的诊断标准,并且均经过核磁共振检查确认。纳入的脑梗死患者排除标准为:①患有感染、自身免疫性疾病、癌症或其他可能影响免疫系统稳态的疾病;②近期应用过类固醇、免疫抑制剂等影响外周血中免疫细胞水平的药物;③妊娠或合并其他重要脏器功能不全者。两组纳入对象一般临床资料的比较:除急性脑梗死组高血压患病率高于健康对照组(P=0.009)之外,其余在性别、年龄、吸烟比例、糖尿病患病率、血清三酰甘油和胆固醇水平等方面差异均无统计学意义,见表1。
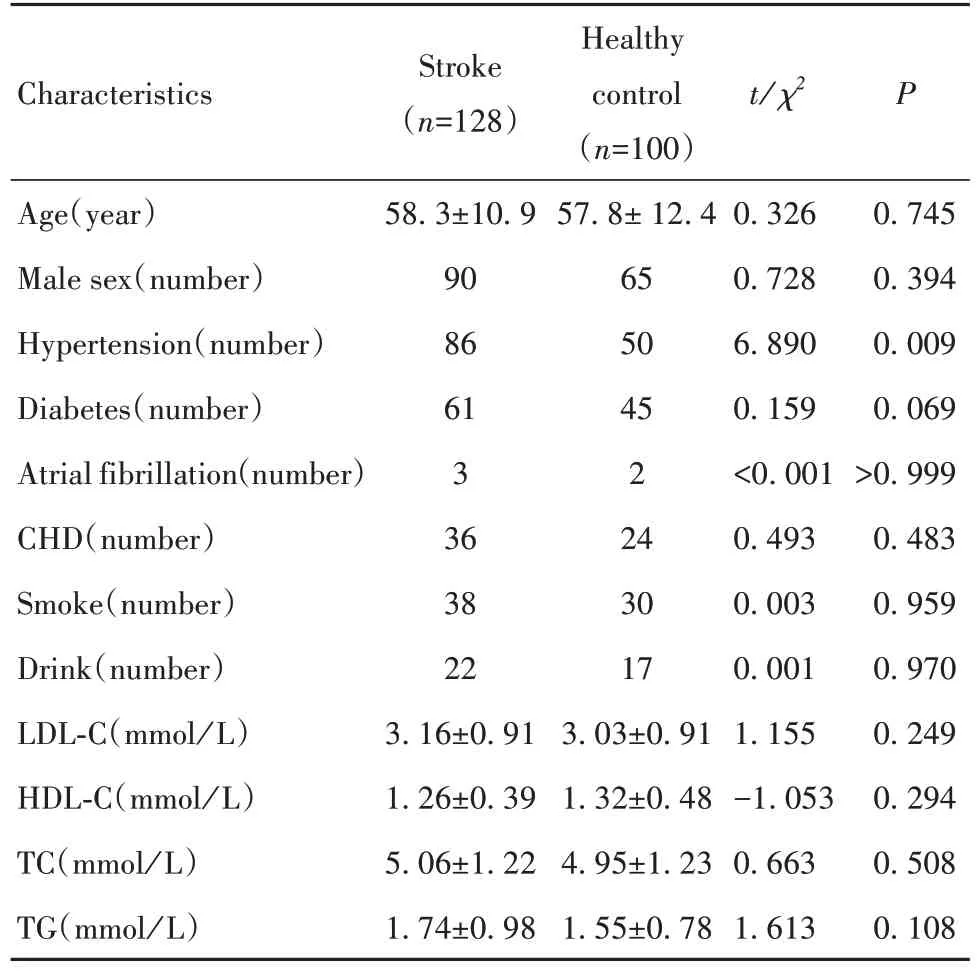
表1 急性脑梗死患者与健康对照的一般情况Tab. 1 Clinical characteristics of acute ischemic stroke patients and healthy controls
1.2 方法
1.2.1 临床参数的采集以及患者疾病严重程度评价 对纳入对象的临床资料如性别、年龄、糖尿病病史、高血压病史、房颤病史、吸烟史、冠心病病史、饮酒史等进行了采集。并在纳入对象入院当天或第二天采集清晨空腹静脉血,按我院检验医学科标准,运用全自动生化分析仪检测低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、三酰甘油(TG)、总胆固醇(TC)水平。用酶联免疫吸附法(R&D Systems Inc,Minneapolis,MN)检测 IL-10、TGF-β 与IL-35 的含量。对所有急性脑梗死患者进行了为期90 d 的随访。随访结束时进行modified Rankin Scale(mRS)评分,mRS 评分 0~2 分为预后好,3~5分为预后差。
1.2.2 流式细胞技术检测外周血中总B 细胞与Breg 细胞 取每位纳入对象空腹清晨静脉血5 ml用肝素钠抗凝后采用梯度-密度离心法分离外周单个核细胞(PBMC)。向分离出来的PBMC 中加入an⁃ti-CD19、anti-CD24 及 anti-CD38 抗体,所有抗体均购自Biolegend公司。抗体加入后4℃避光孵育30 min,再用 PBS 清洗细胞并用 300 μl 的 FACS Buffer 将细胞重悬,流式细胞仪(BD Biosciences)检测总B 细胞(CD19+)与Breg细胞(CD19+CD24highCD38high)。
1.3 统计学处理 采用SPSS23.0进行数据的统计分析。采用单因素方差分析或者χ2检验比较两组纳入对象的一般临床资料。用t检验分析两组纳入对象 Breg、总 B 细胞、IL-10、TGF-β 及 IL-35 水平的差异。多因素分析采用Logistic回归分析法,受试者工作特征(ROC)曲线用于确定总Breg、IL-10、TGF-β以及IL-35 水平,预测急性脑梗死患者较好预后的截断点水平。检验水准α=0.05。
2 结果
2.1 两组纳入对象PBMC 中Breg 细胞 与健康对照组相比,急性脑梗死患者外周血中B 细胞的比例有所上升(22.05%±3.21% vs 18.21%±2.89%,P<0.001),但是 Breg 细胞比例显著上升(7.56%±1.12%vs 1.48%±0.54%,P<0.001),详见表2。
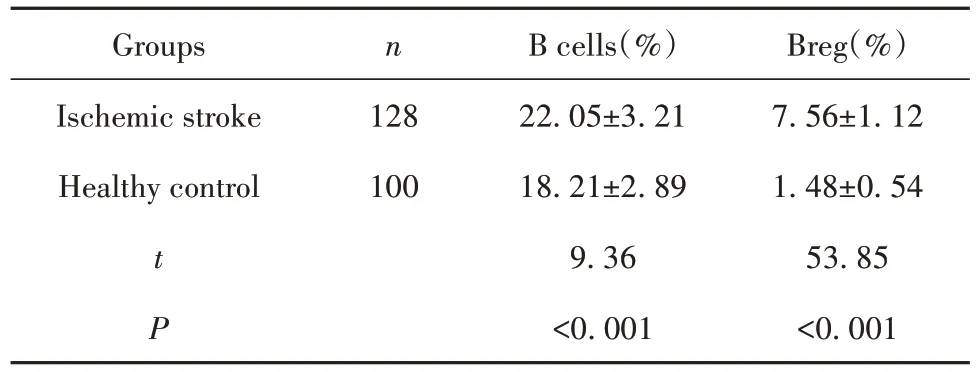
表2 急性脑梗死患者与健康对照外周血中的Breg比较Tab.2 Breg in PBMC of patients with acute ischemic stroke and healthy controls
2.2 两组纳入对象血清中 IL-10、TGF-β 与 IL-35 水平 与健康对照组相比,急性脑梗死组患者血清中的IL-10、TGF-β 与IL-35水平显著上升(表3)。但是Breg 细胞的表达水平仅与血清IL-10 的含量呈正相关(图1)。
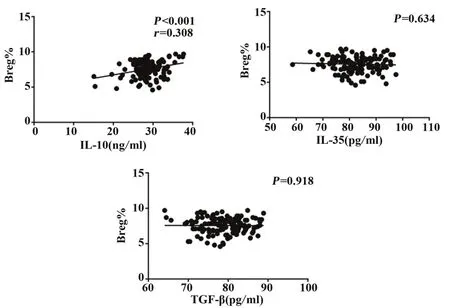
图1 Breg比例与TGF-β、IL-10以及IL-35水平的相关性Fig.1 Correlation between Breg percentage and TGF-β,IL-10 as well as IL-35 levels

表3 急性脑梗死患者与健康对照血清中IL-10、TGF-β 与IL-35比较Tab.3 Serum IL-10,TGF-β and IL-35 level in acute isch⁃emic stroke and healthy controls
2.3 急性脑梗死预后影响因素的Logistic分析 以Breg比例、血清IL-10、TGF-β、IL-35水平,年龄、性别(女=0,男=1),吸烟史(无=0,有=1),高血压病史(无=0,有=1),糖尿病病史(无=0,有=1)等为自变量,以是否为急性脑梗死较好预后为因变量,进行Logistic回归(表4)。结果显示仅Breg 比例是预后的独立影响因素(OR:3.382,95%CI:1.978~5.782)。
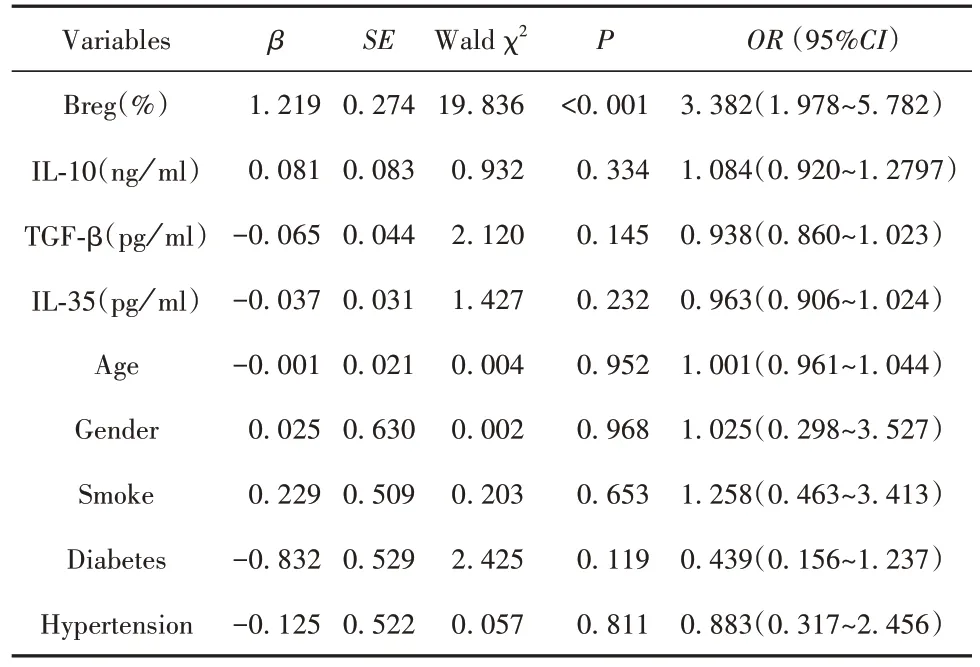
表4 急性脑梗死预后影响因素的Logistics分析Tab.4 Logistics analysis of factors affecting prognosis of acute ischemic stroke
2.4 Breg 比例,血清 IL-10、TGF-β 和 IL-35 水平对急性脑梗较好预后的预测价值 Breg 比例预测急性脑梗较好预后的曲线下面积为0.818(0.735~0.900),当总 Breg 比 例为 7.95% 时 ,特 异度 为83.3%,敏感度为74.0%(图2、表5)。而血清IL-10、TGF-β和IL-35水平不能较好地预测患者预后。

图2 Breg、TGF-β、IL-10和IL-35预测脑梗死的ROC曲线Fig.2 ROC analysis for Breg,TGF-β,IL-10 and IL-35 levels in acute ischemic stroke

表5 Breg、TGF-β、IL-10及IL-35对急性脑梗死的预测价值Tab.5 Predictive value of Breg,TGF-β,IL-10 and IL-35 in acute ischemic stroke
3 讨论
脑梗死发生24 h 后,由淋巴细胞介导的特异性免疫就开始激活[8]。一般认为,B 淋巴细胞可以产生针对中枢神经系统抗原分子的抗体,在脑梗死发病后通过体液免疫进一步加重神经元的损伤,甚至可以导致卒中后痴呆[9]。但是,在脑梗急性期B 细胞表现出神经保护作用。动物实验表明,B 细胞缺乏会导致小鼠梗死面积增加,死亡率增加,表现出更严重的卒中后炎症反应以及更严重的神经功能缺失[7]。并且在急性卒中患者中,外周B 细胞数量的减少预示着较差的预后[10]。B 细胞的这种神经保护功能主要与 Breg 这一 B 细胞亚型有关[7,11-12]。在中枢神经系统中,Breg 可以通过分泌IL-10、IL-35 和TGF-β在多发性硬化、视神经脊髓炎、重症肌无力等神经系统疾病中起重要的免疫抑制作用[13-14]。而在脑梗死动物模型中,Breg主要通过分泌IL-10来发挥神经保护作用[6]。Breg 过继输入脑梗死小鼠后,通过减少浸润至缺血脑组织中的激活T细胞与单核细胞数量,减少缺血脑组织周围炎症因子如TNF-a 和IL-17的含量;增加调节性T细胞(Treg)的数量;以及减轻脑梗死后脾脏萎缩,增加脾脏中免疫细胞数量等多种途径发挥神经保护作用[6]。
既往动物实验发现,相比野生小鼠,免疫缺陷小鼠脑梗死面积更大,神经功能受损更严重,过继Breg 之后免疫缺陷小鼠的脑梗死面积减少并且神经功能有所好转,但是过继回输的Breg 只存在于小鼠外周血中,提示主要由外周Breg 发挥脑梗后神经保护作用[7],所以本试验旨在分析急性脑梗死患者外周血Breg 的比例及其临床意义。发现在急性脑梗死患者的外周血中,B 细胞的比例轻度升高,而Breg的比例显著升高。推测B细胞比例轻度升高的原因是脑梗死发生后B细胞较晚进入脑梗死灶发挥特异性免疫功能[4],而进入脑梗死灶的免疫细胞会因为过度激活而导致凋亡,因此相比较其他免疫细胞,B 细胞的凋亡比例低故而整体比例上调。既往研究表明,炎症因子如 IL-1β、IL-6、IL-21 等可以促进Breg 的分化[5],而这些炎症因子不仅在脑梗死灶并且在外周血中也显著增加[15],故而Breg 不仅凋亡比例低,增殖分化程度也增加,所以其比例显著上调。本研究结果显示,虽然急性脑梗死患者血清IL-10、TGF-β 和 IL-35 水平较健康对照均上升,但是Breg 水平只与血清IL-10 水平呈正相关,提示Breg可能主要通过分泌IL-10 发挥作用。为了说明Breg比例与脑梗患者较好预后之间的关系,进行Logistic回归,结果表明Breg 细胞比例每增加1%,患者获得较好预后的概率增加 2.5 倍(OR:3.508;95%CI:2.071~5.943),说明Breg 细胞比例越高,患者的预后越好。上述结果与既往动物实验结果相一致。
除了Breg,其他类型的免疫细胞如调节性T 细胞(regulatory T cells,Treg)、调节性树突细胞、小胶质细胞、巨噬细胞和单核细胞都可以减轻脑梗死后炎症反应[13]。在这些细胞中,研究最为深入的是Treg 细胞。脑梗死发生后Treg 细胞可以通过分泌TFG-β 和IL-10;表达跨膜抑制分子 CTLA-4、CD39;消耗促进淋巴细胞增殖的IL-2;分泌细胞溶解分子如颗粒酶和穿孔素等途径发挥强大的免疫抑制功能[16]。与 Treg 细胞相比,Breg 有其独特的优势:①目前关于Treg 在脑梗死中的作用尚无定论,有些研究提示Treg 对脑梗死起保护作用,而有些研究却得出相反的结论[16]。SEIFERT 等[6]发现,Treg 细胞在减小MCAO 后梗死体积方面并没有显著作用。相反,Breg 细胞亚群可能在减少梗死体积以及神经炎症方面发挥关键的调节作用。②Breg 也可以通过增加Treg的数量来发挥免疫抑制作用。③Treg细胞可以通过LFA-1/ICAM-1 途径增强脑血管内皮细胞与血小板之间的相互作用,导致体内微血管血栓形成,而Treg 介导的微血管血栓形成与脑梗后期退行性改变相关[17]。而目前的研究尚未发现Breg 有促进微血管血栓形成的作用。
综上所述,本研究发现在急性脑梗死患者外周血中Breg 细胞的比例明显较正常患者增高,且患者血清中Breg分泌的细胞因子如IL-10、TGF-β和IL-35也增高。并且Breg 的增高与患者的较好预后呈正相关。Breg有望成为治疗急性脑梗死的新手段。