MiR-221在肝癌中的表达及其作用机制研究*
2021-09-26焦文鹏郭秀娟焦文静马鸣张金艳
焦文鹏 郭秀娟 焦文静 马鸣 张金艳
肝癌是全球范围内常见的消化道恶性肿瘤,最新数据显示,2018年全球新发肝癌病例1 033 701 例,居恶性肿瘤发病率第7 位;死亡病例782 685 例,死亡率居恶性肿瘤第2 位[1]。我国癌症中心最新数据显示肝癌是我国常见恶性肿瘤,其死亡率和发病率均高于世界平均水平,是我国的第二大恶性肿瘤死亡原因[2]。且大多数肝癌发生于乙型或丙型肝炎病毒感染或酒精滥用等潜在肝病患者,加大早期诊断的难度,同时肝癌患者的预后较差,其3年生存率低于20%[3]。同时肝癌的的发病机制尚未明确,缺乏针对性治疗方法,因此寻找特异性的早期诊断和治疗的肿瘤标志物对于肝癌的早期诊断、治疗和改善肝癌患者的预后尤为重要。
MicroRNA(miRNA)是控制基因表达和癌症发展的内源性小型非编码RNA,可以靶向结合蛋白编码基因而影响靶基因的稳定性或在转录后调控基因表达[4-7]。尤其是在恶性肿瘤的发生发展中发挥着重要的作用[8-10]。多项研究表明miR-221 在宫颈癌[11-12]、喉癌[13]、前列腺癌[14-15]和胃癌[16]中异常表达,发挥着重要的作用。而miR-221 在肝癌中的研究较少,本研究利用基因表达数据库(gene expression omnibus database,GEO)[17]公共数据库的肝癌大样本数据和临床样本验证的方式分析miR-221 在肝癌织中的表达水平及其与临床病理参数之间的相关性,进一步分析miR-221 在肝癌患者诊断及临床预后方面的价值。利用生物信息学的手段分析了miR-221 在肝癌发生发展中的机制,以期为肝癌患者的诊断和治疗提供理论依据。
1 材料与方法
1.1 数据集的选择和芯片数据的差异性分析
本次研究所用到的公共数据库的数据集是来自基因表达数据库GEO 中的GSE10694 和GSE108724两个芯片数据集,且芯片数据经过标准化处理。R 软件中Limma 包[18]用于数据的标准化以及癌组织和正常组织的差异性分析。利用Targetscan、miRWalk和miRTarBase 数据库进行miR-221 的靶基因预测,利用韦恩图取交集,对所得的靶基因利用Clusterprofile 包进行基因本体论(gene ontology,GO)与京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
1.2 临床样本信息
本次实验所用临床样本均收集于2016年1月至2018年12月间河北医科大学第四医院和河北医科大学附属儿童医院手术切除的74 例肝癌患者,所有患者术前均未接受过放射治疗和化疗。此外,分别收集了25 例肝癌患者和正常人的血浆样本,用于评估miR-221 在血浆中的表达水平。同时收集患者原发灶组织及距肿瘤原发灶边缘>5 cm 的癌旁非肿瘤组织,且获得患者知情同意以及本次研究通过河北医科大学第四医院和河北医科大学附属儿童医院伦理委员会的批准。
1.3 细胞及主要试剂
人肝癌细胞系HepG2 和MHCC97H 细胞由河北医科大学第四医院和河北医科大学附属儿童医院保留并传代培养。重组质粒及引物均由生工生物工程(上海)股份有限公司合成。反转录试剂盒、转染试剂Lipofectamine2000和MTS 试剂均购自美国Promega公司,胰蛋白酶和TRIzol 试剂购自北京索莱宝科技有限公司,胎牛血清购自美国BI 公司,RPMI 1 640 培养液购自美国Gibco 公司。兔抗人E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)与波形蛋白(vimentin)及GAPDH 单克隆抗体购自武汉伊莱瑞特生物科技股份有限公司,二抗(辣根过氧化物酶标记的羊抗兔IgG)购自美国KPL 公司,电化学发光试剂购自北京索莱宝生物科技有限公司。
1.4 方法
1.4.1 RNA 提取及实时荧光定量PCR 法检测肝癌组织和血浆中miR-221 的表达 按TRIzol 试剂说明书提供的操作流程,采用苯酚-氯仿抽提法分别提取肝癌及癌旁组织中总RNA。用紫外分光光度计检测各组织中总RNA 的浓度和纯度,并进行琼脂糖凝胶电泳以评估RNA 的完整性。将总RNA 反转录成cDNA,再以cDNA 为模板进行实时荧光定量PCR 检测。miR-221 的正义链:5'-GGGAAGCTACTAAGTCTGC-3';反义链:5'- GTGCGTGTCGTGGAGTCG -3'。U6 为实时荧光定量PCR 验证时的内参,其正义链序列为:5'-AAAGACCTGTACGCCAACAC-3,反义链序列为5'-GTCATACTCCTGCTTGCTGAT-3'。应用实时定量荧光PCR 法检测miR-221 在肝癌组织及癌旁正常组织和血浆中的表达水平,反应条件为95℃,30 s 预变性,95℃,12 s,62℃,30 s,72℃延伸40 s,共40 个循环。以每个荧光信号达到阈值时经历的循环次数作为Ct 值,U6 作为miR-221 的内参,ΔCt=Ct(miR-221)-Ct(U6),miR-221 的相对表达量以2-ΔΔCt表示。
1.4.2 miR-221 与肝癌患者预后相关性的分析及其在诊断肝癌患者方面的能力 用R 软件中的pROC[19]包进行的受试者工作特征(ROC)曲线分析,以探索miR-221 区分肝癌患者与健康个体的敏感性和特异性。Kaplan-Meier plotter (http://kmplot.com/)[20]是一个在线数据库,包含了多基因大样本的预后分析。为了分析miR-221 的表达水平与肝癌患者生存时间之间的相关性,本研究将肝癌患者分为miR-221 高表达组和miR-221 低表达组,利用K-M 生存曲线分析了miR-221 表达水平与肝癌患者的总生存时间(overall survival,OS)以及无病生存时间(disease-free Survival,DFS)之间的相关性。
1.4.3 细胞转染 取对数生长期的HepG2 和MHCC97H 细胞接种于6 孔板中,接种密度以过夜培养后细胞融合度为70%~80% 为标准。按照Lipofectamine2000说明书提供的操作流程,以无血清DMEM培养液配制转染试剂及质粒工作液,分别向HepG2和MHCC97H 细胞中转染两种miR-221inhibitor 及阴性对照(NC 组)。转染6 h 后更换为含10% 胎牛血清的完全培养液,继续培养。细胞继续培养24~48 h,收集HepG2 和MHCC97H 细胞,提取总RNA,采用实时荧光定量PCR 法检测转染效率。
1.4.4 MTS法检测低表达miR-221 对HepG2 和MHCC97H 细胞增殖能力的影响 转染后的HepG2和MHCC97H 细胞培养24 h 后常规消化并重悬于培养液中,调整细胞密度,分别接种于96 孔培养板中(1×103个/孔),每组设置6 个复孔。分别于细胞贴壁生长后0、24、48、72 和96 h 时在每孔加入20 μL MTS试剂,继续培养2 h,用酶联免疫检测仪在波长490 nm处检测各孔的OD 值,表示细胞的增殖水平。
1.4.5 细胞克隆形成实验 转染后的HepG2 和MHCC97H 细胞培养24 h 后常规消化并重悬于培养液 中,调整细胞密度分别接种于6 孔板(5×103个/孔),常规培养1 周。用4%多聚甲醛溶液固定30 min 后,0.1% 结晶紫染色30 min,光学显微镜下计数克隆形成数(>50 个细胞计为1 个克隆),并计算克隆形成率。克隆形成率(%)=克隆数/接种细胞数×100%。
1.4.6 Transwell 小室实验检测肝癌细胞侵袭能力 转染后的HepG2 和MHCC97H 细胞培养24 h后常规消化并重悬于培养液 中,调 整细胞密度为1×105个/mL。将细胞悬液 以100 μL/孔接种于Transwell 小室的上室中,下室中加入750 μL/孔完全培养液。将细胞悬液接种于基质胶包被的Transwell小室上室。将接种细胞后的Transwell 小室置于培养箱中常规培养24 h 后,用4%多聚甲醛溶液固定,并进行结晶紫染色。棉签擦去上室面残余细胞,在倒置相差显微镜下计数穿过小室膜的细胞数量,以此反映细胞的侵袭能力。
1.4.7 实时荧光定量PCR 法检测低表达miR-221对EMT 标志物mRNA 水平的影响 应用实时荧光定量PCR 法检测低表达miR-221 后HepG2 和MHCC97H 细胞中E-cadherin、N-cadherin 及vimentin mRNA 的表达情况。E-cadherin 的正义链:5'-CGAG AGCTACACGTTCACGG-3';反义链:5'- GGCCTTT TGACTGTAATCACACC-3'。N-cadherin 的正义链:5'-CAACTTGCCAGAAAACTCCAGG-3';反义链:5'-ATGAAACCGGGCTATCTGCTC-3'。Vimentin 的正义链:5'-CGCCTGCAGGATGAGATTCAG-3';反义链:5'- TCAGGGAGGAAAAGTTTGGAAA-3'。
1.4.8 蛋白质印迹法检测低表达miR-221 对EMT 标志物蛋白表达水平的影响 按照蛋白提取试剂盒操作流程抽提细胞总蛋白。按照BCA 蛋白浓度测定试剂盒说明书测定蛋白浓度。取适量蛋白样品进行10% SDS-PAGE 分离蛋白,以80 V 为起始电压进行电泳,分离胶电压至120 V,电泳约90 min。将分离后的蛋白转至PVDF 膜上,取出后放入含5%脱脂奶粉的封闭液中室温孵育1 h,加入稀释后的一抗 [兔抗人E-cadherin、N-cadherin、vimentin 及GAPDH(内参照)单克隆抗体(体积稀释比例分别为1∶2 000、1∶6 000、1∶2 000 和1∶10 000)],在摇床上4℃孵育过夜;用TBST 清洗膜3 次,每次5 min;加入稀释的二抗[辣根过氧化物酶标记的羊抗兔IgG(体积稀释比例为1∶100 000)],室温孵育1 h 后,用TBST 清洗膜3 次,每次5 min;在PVDF 膜上滴加电化学发光剂,曝光,显影。
1.5 统计学分析
采用SPSS 21.0 和R 3.6.2 软件对所有的数据进行统计学分析。所有实验均独立重复3 次,计量资料以x¯ ±s表示。MiR-221 在肝癌组织及相应癌旁组织和血浆中的表达差异及其与临床病理资料间的关系均采用秩和检验,两独立样本比较采用t检验和近似t检验,且均为双侧检验。以P<0.05 为差异具有统计学意 义。
2 结果
2.1 miR-221 在GEO 数据集中的表达水平
本研究从GEO 数据库中下载获得GSE10694和GSE108724 两个数据集,利用R 和Graphpad 软件分析发现,miR-221 在肝癌患者肿瘤组织中的表达水平显著高于正常组织。MiR-221 在GSE10694 和GSE108724 两个数据集中的相对表达量分别为:13.58±0.11vs. 12.05±0.09(P<0.001图1A,1B)和7.42±0.43vs.3.25±0.83(P<0.001 图1C,1D)。
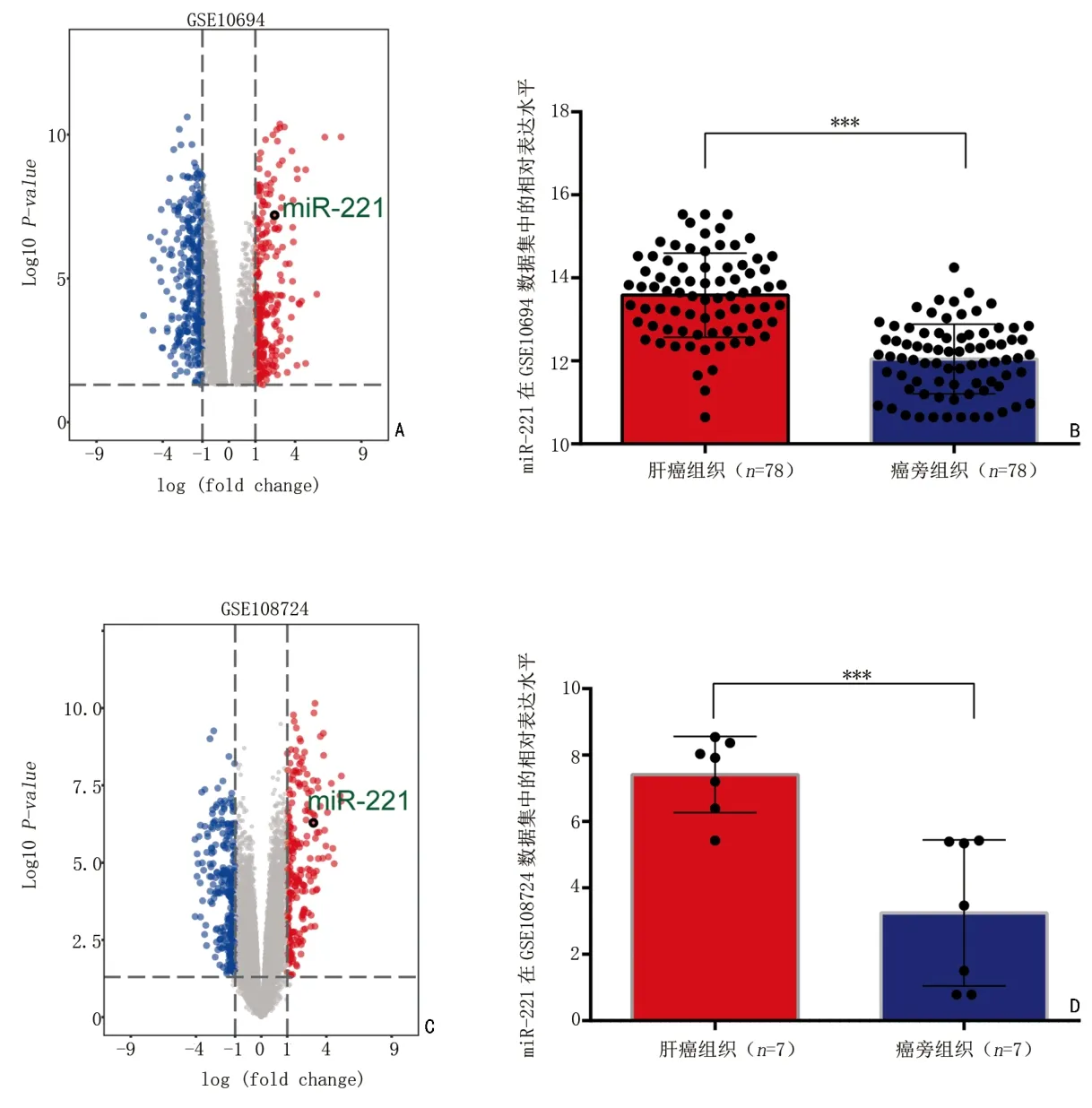
图1 miR-221 在GEO 数据集中的表达水平
2.2 miR-221 在肝癌患者肿瘤组织和血浆中的表达及其表达水平与肝癌患者临床病理特征之间的相关性
本研究经过实时荧光定量PCR 法检测结果显示,miR-221 在肝癌患者肿瘤组织中的表达水平显著高于对应癌旁正常组织中的表达水平,差异具有统计学意义,其相对表达量分别为:5.51±0.11vs. 4.05±0.09(P<0.001,图2A)。此外,实时荧光定量PCR 结果显示,在25 例肝癌患者血浆中miR-221 的相对表达水平显著高于正常健康人群,差异具有统计学意义,其相对表达量分别为:4.04±0.20vs. 2.54±0.16(P<0.001,图2B)。
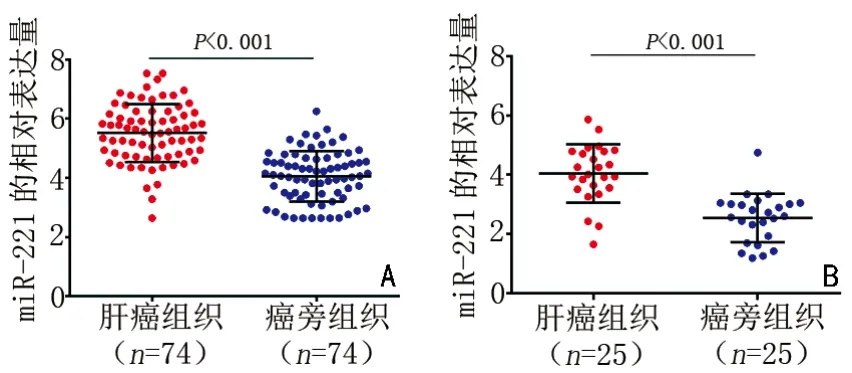
图2 miR-221 在肝癌组织和血浆中的表达水平
进一步分析miR-221 的表达水平与74 例肝癌患者临床病理特征之间的相关性发现,miR-221 的表达水平与肝癌患者的TNM 分期和肿瘤大小显著相关(P<0.05,表1)。

表1 miR-221 的表达水平与74 例肝癌患者临床病理特征之间的相关性
2.3 miR-221 在肝癌患者中的诊断及预后价值
利用74 例肝癌患者组织中miR-221 的表达量分析其在诊断肝癌患者方面的价值,ROC 分析结果显示曲线下面积为0.967(图3A),说明miR-221 具有较强的诊断价值。进一步利用Kaplan-Meier plotter 数据库分析了miR-221 的表达水平与肝癌患者预后之间的相关性,结果显示低miR-221 表达组的肝癌患者的总生存时间(图3B)和无病生存时间(图3C)均显著长于高miR-221 表达组的肝癌患者。

图3 miR-221 在肝癌诊断方面的价值及其表达水平与肝癌患者预后之间的相关性
2.4 miR-221 靶基因的富集分析
对所获得的miR-221 的包括轴形成抑制因子2(the Axin-related protein 2,AXIN2)、丝裂原活化蛋白激酶(mitogen-activated protein kinase 10,MAPK10)、内皮素转换酶1(endothelin converting enzyme 1,ECE1)等基因在内的456 个靶基因进行GO 和KEGG通路富集分析发现,miR-221 主要参与的生物过程包括调节细胞生长、发育细胞生长、肌醇脂质介导的信号传导、细胞对肽激素刺激的反应以及磷脂酰肌醇3-激酶信号转导的正调控等(图4A)。而所参与的信号通路主要为p53 信号通路、调节干细胞多能性的信号通路、ErbB 信号通路、RNA 转运、mTOR 信号通路、cGMP-PKG 信号通路、PI3K-Akt 信号通路和MAPK信号通路(图4B)。此结果可表明miR-221 在肝癌的发生发展中发挥着重要的作用。

图4 miR-221 靶基因的功能富集分析
2.5 沉默miR-221 的表达显著抑制肝癌细胞的增殖和侵袭能力
MTS 分析结果显示,与空白对照组相比,48、72和96 h miR-221 inhibitor 转染组HepG2 和MHCC97H 细胞的OD 值显著降低,差异具有统计学意义(P<0.05,图5A)。克隆形成实验结果显示,沉默miR-221 的表达后,HepG2 和MHCC97H 的细胞克隆形成数明显减少(P<0.01,图5B)。Transwell 小室分析结果显示,敲低miR-221 可显著抑制HepG2 和MHCC97H 细胞的侵袭能力(P<0.01,图5C)。
2.6 沉默miR-221 对EMT 过程相关分子表达的影响
实时荧光定量PCR 分析结果显示,敲低miR-221 后,肝癌HepG2 和MHCC97H 细胞的E-cadherin mRNA 表达水平显著上调(P<0.01),N-cadherin 和vimentin mRNA 的表达水平明显降低(P<0.01)(图6A,B)。蛋白质印记法分析结果显示(图5C),下调miR-221 表达后,肝癌HepG2 和MHCC97H 细胞中E-cadherin 蛋白表达水平显著上调(P<0.01),而N-cadherin 和vimentin 蛋白的表达水平明显降低(P<0.01)(图6C)。此结果表明miR-221 可能通过调控肝癌细胞的EMT 进程而影响肝癌的发生和发展。
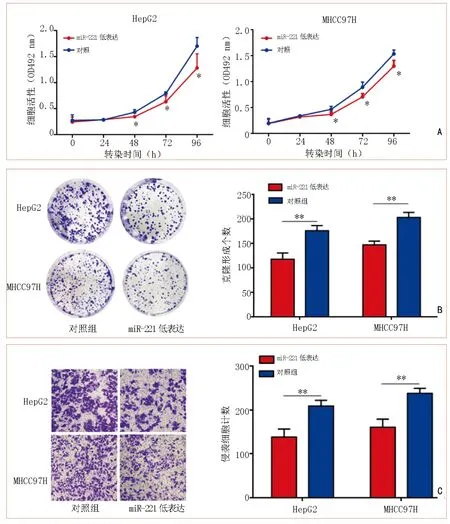
图5 低表达miR-221 对肝癌细胞增殖和侵袭能力的影响
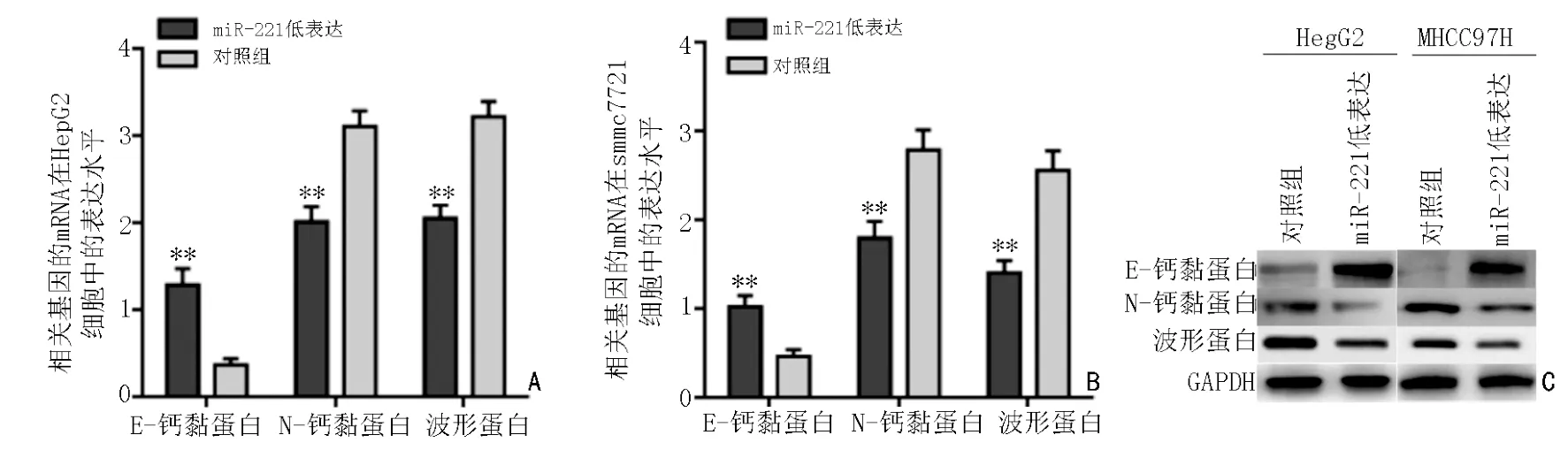
图6 分别采用实时荧光定量PCR 法(A 和B)和蛋白质印迹法(C)检测miR-221 低表达后对HepG2 和MHCC97H 细胞中EMT 标志物Ecadherin、N-cadherin 和vimentin mRNA 和蛋白表达水平的影响
3 讨论
肝癌是全球范围内最常见的消化道恶性肿瘤之一,尽管近年来诊疗手段的快速发展,使得肝癌的诊断和治疗效果显著,但3年生存率仅为18%,因此寻找特异性的肿瘤标志物对于肝细胞癌的治疗尤为迫切。越来愈多的研究表明miR-221 在恶性肿瘤的发生发展中发挥着重要的作用。Dong 等[21]研究发现miR-221-3p 在肝癌组织和细胞系中显著高表达,且与肝癌患者的不良预后显著相关,且通过促进肝癌细胞的增殖、侵袭和迁移而促进肝癌的发生和发展。Shanmugapriya 等[11]研究发现miR-221 在宫颈癌HeLa 细胞系中高表达,且过表达miR-221 可显著促进HeLa 细胞的增殖能力,并减少癌细胞的凋亡。zhang 等[12]通过微阵列的基因表达谱及RT-qPCR 验证分析发现miR-221 在宫颈癌组织和细胞中明显高表达,且通过上调MAPK10 的表达来抑制宫颈癌细胞的增殖、侵袭、迁移以及血管生成。Shi 等[13]分析发现miR-221 在喉癌组织中表达显著升高,且通过PI3K/AKT 信号通路显著抑制喉癌细胞的增殖和细胞周期,并诱导喉癌细胞的凋亡。有研究[22]发现miR-221 在复发性乳头状甲状腺癌中的表达水平显著高于非复发性乳头状甲状腺癌,且与初始手术时的肿瘤大小和淋巴结转移等临床病理特征显著相关。同样Wang 等[23]通过生物信息学手段分析发现miR-221在乳头状甲状腺癌组织中的表达水平显著高于正常组织,且通过ErbB 信号通路而在乳头状甲状腺癌的发生发展中发挥着重要的作用,认为miR-221 可以作为乳头状甲状腺癌诊断和治疗的潜在靶标。Neagu[24]分析发现miR-221 在皮肤癌中异常高表达,且在皮肤癌的发生发展中发挥着重要的作用。而Krebs 等[14]的研究发现miR-221 在前列腺癌组织中的表达显著下调,抑制前列腺癌的增殖和诱导凋亡,进一步分析发现miR-221 主要通过调节致癌基因SOCS3 和PIK3R1 的表达使前列腺癌细胞对酪氨酸激酶抑制剂敏感性增加。而Krebs 研究[15]发现miR-221 在前列腺癌组织中显著高表达,且与高危前列腺癌患者的不良预后显著相关,且靶向VEGFR2 而发挥着致癌基因的作用。
有研究[25]发现miR-221 在乳腺癌组织中低表达,且主要作为长非编码RNA 生长停滞特异性5(GAS5)的海绵体而抑制Wnt /β-catenin 途径的激活,进而在阿霉素的耐药性中发挥作用。Li 等[26]研究发现miR-221 在乳腺癌组织中的表达水平显著高于正常组织,且与乳腺癌患者的不良预后显著相关。Jiang 等[16]发现miR-221-5p 在胃癌组织和细胞系中的表达显著降低。miR-221-5p 的高表达降低了胃癌细胞对顺铂的耐药性,并抑制了胃癌细胞的增殖和迁移。此外,机制研究miR-221-5p 的表达水平升高通过靶向DDR1 来提高胃癌细胞对顺铂的化学敏感性,并抑制GC 细胞的增殖、侵袭、迁移和EMT 进程。本研究通过分析GEO 数据库中的大样本样本发现miR-221 在肝癌组织中的表达水平显著高于正常组织,进一步利用临床患者的肿瘤组织和血浆样本同样发现其在肝癌组织和血浆中显著高表达,且与肝癌患者的肿瘤大小、TNM分期和不良预后显著相关。靶基因预测发现轴形成抑制因子2(AXIN2)、丝裂原活化蛋白激酶(MAPK10)、内皮素转换酶1(ECE1)等基因可能是miR-221 的关键靶基因,而AXIN2[21]以及MAPK10[12]已经实验验证过,本研究将在接下来的研究中实验验证ECE1 是否是miR-221 的下游关键靶基因。功能富集分析发现miR-221 主要参与p53 信号通路、调节干细胞多能性的信号通路、ErbB 信号通路、RNA 转运、mTOR信号通路、cGMP-PKG 信号通路、PI3K-Akt 信号通路和MAPK 信号通路以及细胞生长等而在肝癌的发生发展中发挥着重要的作用,且PI3K-Akt 信号通路所富集的靶基因最多。体外实验研究发现miR-221主要通过调控EMT 进程相关分子的表达水平变化而促进肝癌的发生发展。今后,本课题组将会进一步扩大样本量,并研究体内实验miR-221 在肝癌中的具体作用机制,以期为肝癌的诊断和靶向治疗提供更多的依据。
