生物可降解镁对人胆管癌细胞和小鼠H22肿瘤抑制作用研究
2021-09-26何金瞳张丹阳隋凯达张洲博邵海波
李 天, 刘 冲, 何金瞳, 张丹阳, 隋凯达, 张洲博, 邵海波
原发性肝胆肿瘤包括肝细胞癌和胆管癌,肝细胞癌可能以肿瘤压迫、瘤栓形成、弥漫性肿瘤浸润等方式累及胆道[1],引起胆道狭窄或阻塞,而胆管癌晚期也可引起胆管狭窄和梗阻[2]。胆道支架植入术已成为缓解晚期梗阻性黄疸、延长患者生存期的有效方法[3]。然而胆道支架植入术后再狭窄率超过50%[4],主要由肿瘤侵入导致,相当多患者需要再次干预[5]。传统胆道支架材料为钛合金,在体内不能降解,对肿瘤生长无抑制作用。近年来具有可降解性质的金属镁以良好的力学性能和生物相容性、较高的生物活性和可降解性显示出巨大的应用潜力,已成为生物医用材料领域研究热点[6]。镁金属作为植入医疗器械材料在骨折内固定[7],骨组织多孔支架和心血管支架[8-9],食管良性狭窄药物镁合金支架及胃肠外科手术[10-11]中均得到广泛研究或应用。有研究证明,金属镁在降解过程中可抑制骨肉瘤、口腔表皮样癌等肿瘤细胞生长[12-14]。为探讨可降解金属镁应用于胆道支架材料解决肿瘤侵入支架所致胆道支架再狭窄的可行性,本研究利用人胆管癌细胞观察镁降解引起的细胞毒性、细胞凋亡,采用H22荷瘤小鼠模型观察纯镁在肿瘤组织中的生物降解过程及其对肿瘤生长的抑制作用,并对其可能的作用机制进行初步探究。
1 材料与方法
1.1 样品制备和材料表征
实验所用金属材料由中国科学院金属研究所制备并提供,铸态纯镁纯度为99.95%,挤压成型,选择钛合金(Ti6AL4V)作为阴性对照,培养基作为空白对照。实验前将样品打磨至2.5 μm级,用丙酮和无水乙醇超声清洗,紫外线正反两面照射30 min消毒待用;金属片用于提取浸提液,尺寸为10 mm×15 mm,按可降解材料表面积/浸提介质为1.25 cm2/mL比例,加入含10%胎牛血清(FBS,美国Gibco公司)细胞培养液,置于37℃恒温箱中浸提,分别于第1、3、5天检测各组浸提液pH值。金属丝直径1.5 mm,长度10 mm,用于体内植入实验。
1.2 细胞培养
实验所用细胞系为人胆管癌细胞(RBE),由中国科学院典型培养物保藏委员会细胞库提供。用90%不完全RPMI-1640培养基(美国HyClone公司)、10%FBS配置细胞培养液,置于37℃、5%CO2培养箱内培养,每2天更换1次培养基。
1.3 镁体外抑制肿瘤实验
1.3.1 细胞毒性 采用细胞抑制率(%)作为细胞膜完整性指标,并作为细胞毒性一般指标。将RBE细胞(100 μL)分配在96孔板(2×103个细胞/孔)并置于37℃、5%CO2培养箱内培养过夜,待细胞贴壁后处理。弃掉培养液后,实验组分别在每孔加入纯镁和钛合金于第1、3、5天的浸提液200 μL,空白对照组加入相同体积培养液。培养24 h后,弃去各孔培养液,向每孔加入100 μL细胞培养基及10 mL细胞计数试剂盒(CCK)-8溶液(上海碧云天生物技术公司),放入细胞培养箱中继续孵育3 h后用酶标仪OD490 nm处检测各孔吸光值。计算各组细胞抑制率(%),即抑制率=(1-实验组/空白对照组)×100%。
1.3.2 细胞凋亡 采用膜联蛋白(annexin)Ⅴ-异硫氰酸荧光素(FITC)/碘化丙啶(PI)双染试剂盒(上海碧云天生物技术公司)检测RBE细胞凋亡率。取对数生长期细胞接种于6孔板中,待细胞贴壁后,加入纯镁和钛合金第1、3、5天浸提液,空白对照组加入相同体积培养液。培养24 h后,用不含乙二胺四乙酸(EDTA)胰酶消化收集细胞,冷的磷酸缓冲液(PBS)洗涤离心细胞2次,加入100 μL 1×结合缓冲液(binding buffer)后置细胞悬液于流式管内,分别向各组中相应加入annexinⅤ-FITC和PI各5 μL,避光孵育15 min,最后每管加入400 μL 1×结合缓冲液,震荡后用流式细胞仪进行检测。计算凋亡率后进行统计分析。
1.4 体内抑制肿瘤实验
所有动物实验均遵循《中国医科大学实验动物规范》。
1.4.1 体内抑制肿瘤作用 动物实验选用近交系Balb/c小鼠,皮下肿瘤最长径约0.8 cm时入组。随机分为纯镁组和钛合金组,每组20只。所有手术器械经高压蒸汽法灭菌,手术台乙醇消毒,小鼠以1%戊巴比妥钠按50 mg/kg剂量腹腔注射麻醉;切开小鼠皮肤,暴露肿瘤组织,金属丝横穿肿瘤组织;缝合伤口,继续饲养。在第3、6、9、12、15天分别测量每组小鼠肿瘤最长径和最短径(n=6),处死每组3只小鼠,观察肿瘤生长情况。根据Steel公式计算肿瘤体积,即体积=(短径2×长径)/2(mm3)。
1.4.2 体内金属降解 在第3、6、9、12、15天处死小鼠,依次将小鼠俯卧于检查台上,进行钼靶X线摄影(曝光条件:28 kV,18 mAs),监测体内金属降解情况。
1.4.3 组织病理学分析 术后第15天,肿瘤组织以4%多聚甲醛固定2周,石蜡包埋,切片,制备肿瘤切片进行组织病理学分析。常规苏木精-伊红(HE)染色,免疫组织化学染色。经脱蜡、脱水、修复、灭活和阻断后,组织切片分别与低氧诱导因子(HIF)-1α(1∶100)一抗和碳酸酐酶(CA)Ⅸ(1∶500)一抗(英国Abcam公司)在4℃孵育过夜。二抗孵育后,用二氨基联苯胺(DAB)染色。脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)检测材料周围肿瘤细胞凋亡情况。最后在显微镜下观察染色结果。
1.5 统计学分析
采用SPSS 17.0软件进行统计学处理。两组间同一时间点比较用两样本t检验,3组数据比较用方差分析和Bonferroni两两均数比较,以P<0.05为差异有统计学意义。
2 结果
2.1 纯镁浸提时间对pH值影响
分别测定各组第1、3、5天提取液pH值,结果表明,随着纯镁浸提天数增加,浸提液pH值逐渐增加,其各个时间点pH值均显著高于钛合金浸提液;第5天纯镁浸提液pH值最高可达到11.0,而钛合金浸提液pH值最高则维持在8.6,见图1。

图1 不同时间点各组对应pH值
2.2 纯镁浸提液对RBE细胞增殖影响
CCK-8试验结果表明,第1、3、5天纯镁浸提液均抑制RBE细胞增殖(P<0.05),且呈现明显的时间依赖性。第1、3、5天纯镁浸提液对RBE细胞抑制率分别为24.7%、60.2%、70.7%,而钛合金浸提液分别为-3.1%、1.3%、1.0%,差异有统计学意义(P<0.05),见图2。

图2 不同时间点不同材料浸提液对RBE细胞毒性的影响
2.3 纯镁浸提液对RBE细胞凋亡影响
流式细胞仪检测结果显示,纯解镁浸提液可诱导RBE细胞凋亡,随着浸提时间延长和pH值增高,凋亡细胞百分比相应增加。第1、3、5天细胞凋亡率,纯镁浸提液分别为13.8%、33.8%、46.7%,钛合金浸提液分别为6.1%、7.1%、5.6%,空白组为4.1%,纯镁组与空白对照组、钛合金组差异均有统计学意义(P<0.05),见图3。

图3 不同时间点不同材料浸提液对RBE细胞凋亡的影响
2.4 纯镁对小鼠H22肿瘤生长的影响
通过对小鼠肿瘤体积和重量的监测,结果如图4所示。随着时间增加,植入纯镁金属丝小鼠肿瘤大小和重量均明显小于钛合金金属丝处理的肿瘤。第9、12、15天,植入钛合金小鼠肿瘤平均体积分别为11.4 cm3、18.0 cm3、21.7 cm3,而植入纯镁小鼠肿瘤平均体积分别为5.6 cm3、8.2 cm3、11.2 cm3,差异均有统计学意义(P<0.05)。术后小鼠生存率达到90%以上,生存时间可达25 d;因肿瘤组织过大,对小鼠实施安乐死。
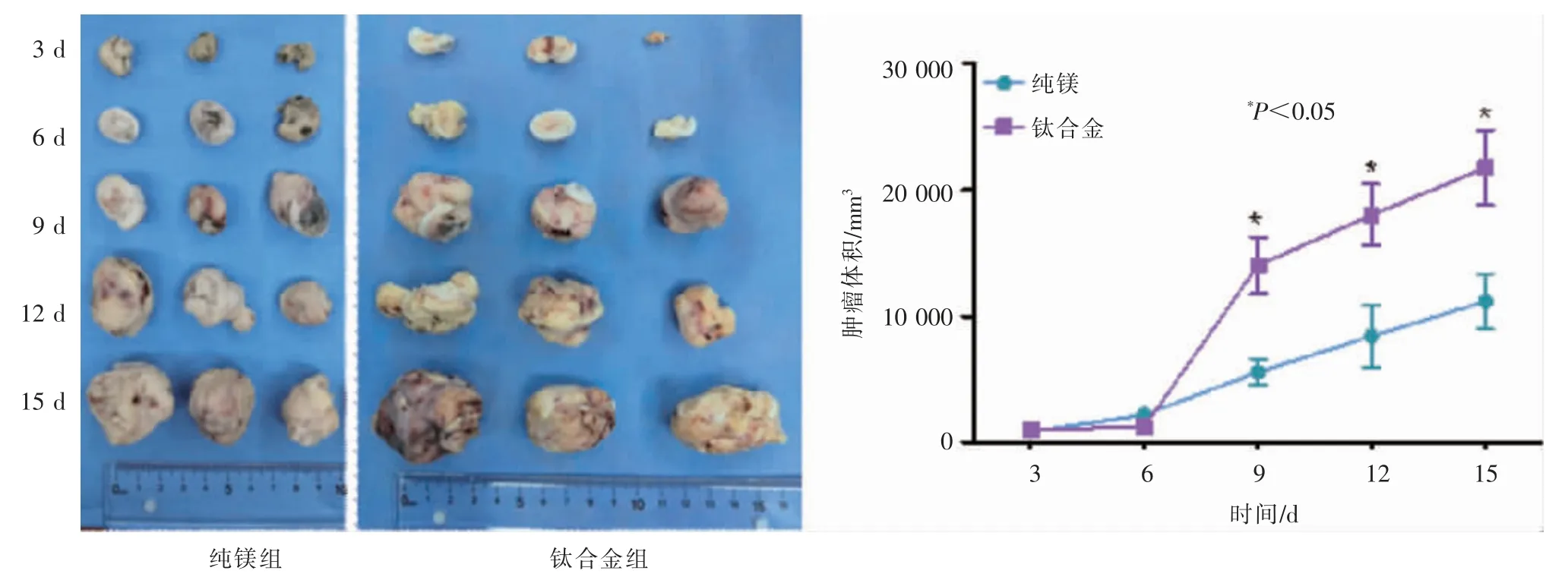
图4 不同时间点不同材料组小鼠H22肿瘤重量和体积
2.5 纯镁在小鼠H22肿瘤中降解情况
从钼靶影像(图5)上可以看到,随着时间的推移,传统钛合金材料在小鼠体内并未发生明显变化。与钛合金相比,纯镁金属边缘变得模糊,且在金属周围存在少量气体。
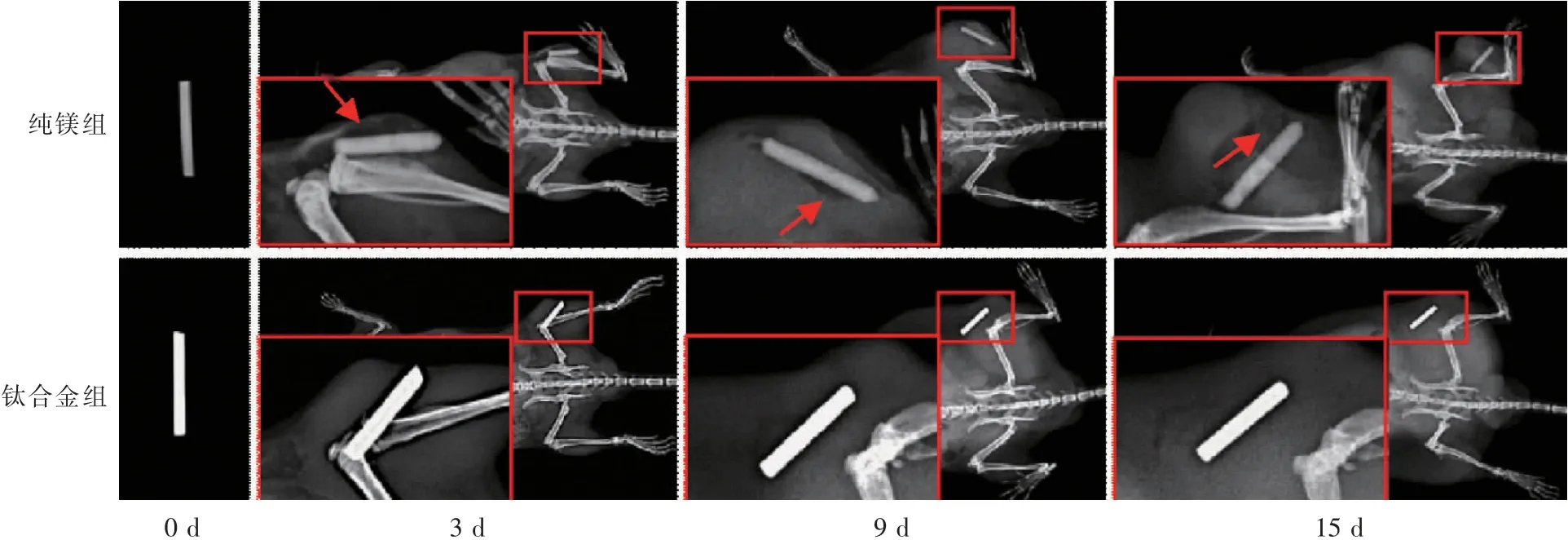
图5 不同时间点不同材料在小鼠H22肿瘤内降解情况
2.6 纯镁植入小鼠H22肿瘤后组织病理学分析
通过术后第15天肿瘤组织HE染色、TUNEL染色和免疫组织化学染色,进一步证明纯镁对肿瘤细胞的抑制作用。HE染色上可看到植入纯镁的材料周围肿瘤细胞皱缩,细胞核消失。TUNEL染色凋亡细胞标记为棕色,纯镁组凋亡细胞比率为平均9.7%,而钛合金组为5.3%,差异有统计学意义(P<0.05);免疫组化染色结果显示,植入纯镁小鼠肿瘤组织CAⅨ蛋白表达显著降低(P<0.05),其上游蛋白HIF-1α也有下降,但未达到统计学意义(P>0.05),见图6。

图6 不同材料对小鼠H22细胞凋亡及相关蛋白的影响(×100)
3 讨论
支架内再狭窄已成为目前影响恶性梗阻性黄疸胆道支架植入术后疗效和预后的主要原因,尽管再狭窄原因中良、恶性因素混杂,但恶性肿瘤生长仍然是影响支架远期通畅率和患者预后的主要因素[15],尤其是肝细胞癌、胆管癌呈浸润性生长趋势时,往往可很快生长入支架内[16]。因此,如何预防胆道支架植入术后再狭窄成为临床研究热点。目前研究主要集中在支架材料、覆膜支架、光动力疗法、支架植入术后联合介入治疗及放化疗[15,17]。生物可降解金属镁在降解过程中被证实具有良好的抗肿瘤性能,但能否抑制肝胆肿瘤尚不清楚。本研究分别采用人胆管癌细胞和H22荷瘤小鼠模型,旨在体内外测试可降解金属镁对肿瘤生长的影响。本实验结果表明,随着纯镁浸提天数增加,其pH值逐渐增加(图1);纯镁浸提液对RBE细胞毒性与对照组相比显著增加,随着浸提时间增加,细胞毒性也越来越大(图2)。有研究证明碱性环境能抑制肿瘤细胞生长,金属镁降解时溶液中主要产物是Mg(OH)2,但溶液中Cl-使Mg(OH)2转换为MgCl2,溶液中OH-增多,导致溶液中pH迅速上升[18]。Witte等[19]研究显示体内外金属镁均能显著增加材料周围的碱度,从而抑制在此环境中残存的肿瘤细胞。Wang等[13]研究显示Mg2+浓度在50 mmol/L时,骨肉瘤U2-OS细胞于第7天相对生长速率(RGR)为98.6%,并无明显细胞毒性,且其在腐蚀介质环境中的主要降解产物为Mg(OH)2。Pompa等[20]研究表明,金属镁对正常小鼠胚胎成骨细胞前体细胞(MC3T3-E1)毒性处于理想范围内。因此可推测纯镁浸提液能抑制RBE增殖,可能与其降解导致浸提液pH上升,改变了肿瘤生长的酸性环境有关。肿瘤细胞凋亡调控失调导致的细胞凋亡抵抗(resistance to apoptosis)是肿瘤发生的主要原因之一[21]。本研究进一步采用流式细胞术体外观察纯镁对RBE细胞凋亡的影响,发现纯镁浸提液可导致RBE细胞凋亡,凋亡细胞数随着浸提天数增加而增加(图3),这与前述RBE细胞CCK-8结果相一致。
本实验结果表明,纯镁与钛合金同时植入小鼠H22皮下肿瘤后第3、6、9、12、15天,纯镁组肿瘤体积增长更慢(图4),金属边缘变得模糊,周围有一定的气体产生(图5),钼靶摄影也观察到体内气体产生。Wang等[13]研究显示可降解镁材料降解时产生气泡,不利于肿瘤细胞黏附生长。CAⅨ是一种缺氧导致高表达的肿瘤相关蛋白,是HIF-1α下游蛋白,正常组织中几乎不表达,而肿瘤组织中呈高表达。CAⅨ参与调节肿瘤细胞增殖、转移和侵袭,并可使肿瘤细胞维持周围微环境弱酸性,适应微环境变化,促进肿瘤侵袭、转移和对放疗的抵抗[22]。本实验结果显示,纯镁组小鼠肿瘤组织中CAⅨ含量较钛合金组明显降低,其上游蛋白HIF-1α虽有变化,但差异无统计学意义(图6),这也与浸提液中pH值变化相对应。不过还需要进一步实验补充证明这一观点。本研究还观察到植入纯镁的肿瘤细胞凋亡率相比钛合金更高(图6),进一步证实可降解金属镁对肿瘤细胞有一定的抑制作用。
综上,本研究表明可降解金属镁是一种具有选择性、有潜力抗肿瘤的胆道支架材料。可降解金属镁在体内腐蚀虽较快,但通过合金化、表面处理和特种加工工艺等方法可有效提升镁合金材料的耐腐蚀性能,满足临床上对其降解率的要求,且研究证明经过微弧氧化处理的纯镁降解速率变慢[23-24]。然而可降解金属镁与钛合金相比对肿瘤细胞仍有一定毒性作用[25]。本研究仅探究纯镁与传统钛合金相比对肿瘤的抑制作用,未检测其他镁合金对肿瘤的抑制作用。Qiao等[26]研究显示,可降解金属镁植入动物体内肿瘤后对其他脏器并无明显毒性作用。但可降解金属镁抑制肿瘤的机制仍需更多实验研究加以证明。镁基金属材料在抑制肿瘤作用方面,相对于现有钛合金材料有独特优势,有望成为一种可行的胆道支架替代材料。
